专利摘要
本发明公开了致癌融合蛋白。本发明提供了用于治疗基于基因融合体的癌症的方法。
权利要求
1.一种纯化的融合蛋白,其包含与多肽融合的FGFR蛋白的酪氨酸激酶结构域,所述多肽组成型地激活所述FGFR蛋白的所述酪氨酸激酶结构域。
2.一种纯化的融合蛋白,其包含与具有酪氨酸激酶结构域的多肽融合的转化型酸性卷曲螺旋(TACC)结构域,其中所述TACC结构域组成型地激活所述酪氨酸激酶结构域。
3.一种纯化的融合蛋白,其包含与含有转化型酸性卷曲螺旋(TACC)的蛋白的所述TACC结构域5’融合的FGFR蛋白的所述酪氨酸激酶结构域。
4.如权利要求1或3所述的纯化的融合蛋白,其中所述FGFR蛋白是FGFR1、FGFR2、FGFR3或FGR4。
5.如权利要求3所述的纯化的融合蛋白,其中所述TACC蛋白是TACC1、TACC2或TACC3。
6.一种由FGFR1-TACC1核酸编码的纯化的融合蛋白,其中FGFR1-TACC1包含与位于人染色体8p11上的TACC1的外显子7-13的组合5’剪接的位于人染色体8p11上的FGFR1的外显子1-17的组合,其中基因组断裂点出现在FGFR1的外显子1-17的任何一个和TACC1的外显子7-13的任何一个中。
7.一种由FGFR2-TACC2核酸编码的纯化的融合蛋白,其中FGFR2-TACC2包含与位于人染色体10q26上的TACC2的任何外显子1-23的组合5’剪接的位于人染色体10q26上的FGFR2的任何外显子1-18的组合。
8.一种由FGFR3-TACC3核酸编码的纯化的融合蛋白,其中FGFR3-TACC3包含与位于人染色体4p16上的TACC3的外显子8-16的组合5’剪接的位于人染色体4p16上的FGFR3的外显子1-16的组合,其中基因组断裂点出现在FGFR3的外显子1-16的任何一个和TACC3的外显子8-16的任何一个中。
9.一种由FGFR3-TACC3核酸编码的纯化的融合蛋白,其中FGFR3-TACC3包含与位于人染色体4p16上的TACC3的外显子8-16的组合5’剪接的位于人染色体4p16上的FGFR3的外显子1-16的组合,其中基因组断裂点出现在FGFR3的内含子1-16的任何一个和TACC3的外显子8-16的任何一个中。
10.一种由FGFR3-TACC3核酸编码的纯化的融合蛋白,其中FGFR3-TACC3包含与位于人染色体4p16上的TACC3的外显子8-16的组合5’剪接的位于人染色体4p16上的FGFR3的外显子1-16的组合,其中基因组断裂点出现在FGFR3的外显子1-16的任何一个和TACC3的内含子7-16的任何一个中。
11.一种由FGFR3-TACC3核酸编码的纯化的融合蛋白,其中FGFR3-TACC3包含与位于人染色体4p16上的TACC3的外显子8-16的组合5’剪接的位于人染色体4p16上的FGFR3的外显子1-16的组合,其中基因组断裂点出现在FGFR3的内含子1-16的任何一个和TACC3的内含子7-16的任何一个中。
12.一种合成的核酸,其编码如权利要求1、2、3、6、7、8、9、10或11所述的融合蛋白。
13.一种纯化的FGFR3-TACC3融合蛋白,其包括SEQ ID NO:79、158、159、160或161。
14.一种纯化的FGFR3-TACC3融合蛋白,其具有基因组断裂点,所述基因组断裂点包括来自SEQ ID NO:90的氨基酸730-758的至少3个连续氨基酸并且包括来自SEQ ID NO:92的氨基酸549-838的至少3个连续氨基酸。
15.一种纯化的FGFR3-TACC3融合蛋白,其具有基因组断裂点,所述基因组断裂点包括SEQ ID NO:78。
16.一种纯化的FGFR3-TACC3融合蛋白,其具有基因组断裂点,所述基因组断裂点包括SEQ ID NO:85、86、87或89的任何一个。
17.一种纯化的FGFR1-TACC1融合蛋白,其包括SEQ ID NO:150。
18.一种纯化的FGFR1-TACC1融合蛋白,其具有基因组断裂点,所述基因组断裂点包括来自SEQ ID NO:146的氨基酸746-762的至少3个连续氨基酸并且包括来自SEQ ID NO:148的氨基酸572-590的至少3个连续氨基酸。
19.一种纯化的FGFR1-TACC1融合蛋白,其具有基因组断裂点,所述基因组断裂点包括SEQ ID NO:88。
20.一种编码FGFR3-TACC3融合蛋白的合成的核酸,其包括SEQ ID NO:94。
21.一种编码FGFR3-TACC3融合蛋白的合成的核酸,其具有基因组断裂点,所述基因组断裂点包括来自SEQ ID NO:91的核苷酸2443-2530的至少9个连续框内核苷酸并且包括来自SEQ ID NO:93的核苷酸1800-2847的至少9个连续框内核苷酸。
22.一种编码FGFR3-TACC3融合蛋白的合成的核酸,其具有基因组断裂点,所述基因组断裂点包括SEQ ID NO:1-77的任何一个。
23.一种编码FGFR1-TACC1融合蛋白的合成的核酸,其包括SEQ ID NO:151。
24.一种编码FGFR1-TACC1融合蛋白的合成的核酸,其具有基因组断裂点,所述基因组断裂点包括来自SEQ ID NO:147的核苷酸3178-3228的至少9个连续框内核苷酸并且包括来自SEQ ID NO:149的核苷酸2092-2794的至少9个连续框内核苷酸。
25.一种编码FGFR1-TACC1融合蛋白的合成的核酸,其具有基因组断裂点,所述基因组断裂点包括SEQ ID NO:83。
26.一种抗体或其抗原结合片段,其特异性结合纯化的融合蛋白,所述纯化的融合蛋白包含与多肽融合的FGFR蛋白的酪氨酸激酶结构域,所述多肽组成型地激活所述FGFR蛋白的所述酪氨酸激酶结构域。
27.如权利要求26所述的抗体或抗原结合片段,其中所述FGFR蛋白是FGFR1、FGFR2、FGFR3或FGFR4。
28.如权利要求26所述的抗体或抗原结合片段,其中所述融合蛋白是FGFR-TACC融合蛋白。
29.如权利要求28所述的抗体或抗原结合片段,其中所述FGFR-TACC融合蛋白是FGFR1-TACC1、FGFR2-TACC2或FGFR3-TACC3。
30.如权利要求29所述的抗体或抗原结合片段,其中所述FGFR1-TACC1融合蛋白包含SEQ ID NO:150的所述氨基酸序列。
31.如权利要求29所述的抗体或抗原结合片段,其中所述FGFR3-TACC3融合蛋白包含SEQ ID NO:79、158、159、160或161的氨基酸序列。
32.一种用于降低受试者中融合蛋白的表达水平或活性的组合物,所述融合蛋白包含与多肽融合的FGFR蛋白的所述酪氨酸激酶结构域,所述多肽组成型地激活所述FGFR蛋白的所述酪氨酸激酶结构域,与药学上可接受的载体混合的所述组合物包含所述融合蛋白的抑制剂。
33.如权利要求32所述的组合物,其中所述融合蛋白是FGFR-TACC融合蛋白。
34.如权利要求32所述的组合物,其中所述抑制剂包括特异性结合FGFR-TACC融合蛋白的抗体或其片段;特异性结合FGFR蛋白的小分子;特异性结合TACC蛋白的小分子;降低FGFR-TACC融合多肽的表达的反义RNA或反义DNA;特异性靶向FGFR-TACC融合基因的siRNA;或其组合。
35.如权利要求32所述的组合物,其中所述FGFR蛋白是FGFR1、FGFR2、FGFR3或FGFR4。
36.如权利要求33所述的组合物,其中所述FGFR-TACC融合蛋白是FGFR1-TACC1、FGFR2-TACC2或FGFR3-TACC3。
37.如权利要求34所述的组合物,其中所述特异性结合FGFR蛋白的小分子包括AZD4547、NVP-BGJ398、PD173074、NF449、TK1258、BIBF-1120、BMS-582664、AZD-2171、TSU68、AB1010、AP24534、E-7080、LY2874455或其组合。
38.一种用于降低相应需要的受试者中融合蛋白的表达水平或活性的方法,所述融合蛋白包含与多肽融合的FGFR蛋白的所述酪氨酸激酶结构域,所述多肽组成型地激活所述FGFR蛋白的所述酪氨酸激酶结构域,所述方法包括:
(a)向所述受试者施用治疗量的如权利要求32所述的组合物;和
(b)确定所述融合蛋白表达水平或活性与施用所述组合物之前的融合蛋白表达水平或活性相比是否降低,
从而降低所述融合蛋白的表达水平或活性。
39.一种用于治疗有需要的受试者中基因融合体相关癌症的方法,所述方法包括向所述受试者施用有效量的FGFR融合分子抑制剂。
40.一种降低有需要的受试者中实体瘤生长的方法,所述方法包括向所述受试者施用有效量的FGFR融合分子抑制剂,其中所述抑制剂降低所述实体瘤的大小。
41.如权利要求39所述的方法,其中所述基因融合体相关癌症包括多形性胶质母细胞瘤、乳腺癌、肺癌、前列腺癌或结肠直肠癌。
42.如权利要求40所述的方法,其中所述实体瘤包括多形性胶质母细胞瘤、乳腺癌、肺癌、前列腺癌或结肠直肠癌。
43.如权利要求39或40所述的方法,其中所述FGFR融合蛋白包括与多肽融合的FGFR蛋白,所述多肽组成型地激活所述FGFR蛋白的所述酪氨酸激酶结构域。
44.如权利要求38、39或40所述的方法,其中所述融合蛋白是FGFR-TACC融合蛋白。
45.如权利要求39或40所述的方法,其中所述抑制剂包括特异性结合FGFR-TACC融合蛋白的抗体或其片段;特异性结合FGFR蛋白的小分子;特异性结合TACC蛋白的小分子;降低FGFR-TACC融合多肽的表达的反义RNA或反义DNA;特异性靶向FGFR-TACC融合基因的siRNA;或其组合。
46.如权利要求38或43所述的方法,其中所述FGFR蛋白是FGFR1、FGFR2、FGFR3或FGFR4。
47.如权利要求45所述的方法,其中所述FGFR-TACC融合蛋白是FGFR1-TACC1、FGFR2-TACC2或FGFR3-TACC3。
48.如权利要求45所述的方法,其中所述特异性结合FGFR蛋白的小分子包括AZD4547、NVP-BGJ398、PD173074、NF449、TK1258、BIBF-1120、BMS-582664、AZD-2171、TSU68、AB1010、AP24534、E-7080、LY2874455或其组合。
49.一种用于确定来自受试者的样本是否表现FGFR融合体的存在的诊断试剂盒,所述试剂盒包括至少一个与FGFR融合体特异性杂交的寡核苷酸,或其部分。
50.如权利要求49所述的试剂盒,其中所述寡核苷酸包括一组核酸引物或原位杂交探针。
51.如权利要求49所述的试剂盒,其中所述寡核苷酸包括SEQ ID NO:162、163、164、165、166、167、168、169或其组合。
52.如权利要求50所述的试剂盒,其中所述引物仅当FGFR融合体存在时引发聚合酶反应。
53.如权利要求49所述的试剂盒,其中所述确定包括基因测序、选择性杂交、选择性扩增、基因表达分析或其组合。
54.一种用于确定来自受试者的样本是否表现FGFR融合蛋白的存在的诊断试剂盒,所述试剂盒包括特异性结合FGFR融合蛋白的抗体,所述FGFR融合蛋白包括SEQ ID NO:79、85、86、87、88、89、150、158、159、160或161,其中所述抗体仅当FGFR融合蛋白存在时识别所述蛋白。
55.如权利要求54所述的试剂盒,其中所述抗体针对FGFR融合体,所述FGFR融合体包括SEQ ID NO:79、85、86、87、88、89、150、158、159、160或161。
56.如权利要求49或54所述的试剂盒,其中所述FGFR融合体是FGFR-TACC融合体。
57.如权利要求49或54所述的试剂盒,其中所述FGFR是FGFR1、FGFR2、FGFR3或FGFR4。
58.如权利要求55所述的试剂盒,其中所述FGFR-TACC融合体是FGFR1-TACC1、FGFR2-TACC2或FGFR3-TACC3。
59.一种用于检测人受试者中FGFR融合体的存在的方法,所述方法包括:
(a)从所述人受试者获得生物样本;和
(b)检测所述受试者中是否存在FGFR融合体。
60.如权利要求59所述的方法,其中所述检测包括通过以下方式来测量FGFR融合蛋白水平:使用针对SEQ ID NO:79、85、86、87、88、89、150、158、159、160或161的抗体的ELISA;使用针对SEQ ID NO:79、85、86、87、88、89、150、158、159、160或161的抗体的western印迹;质谱法、等电聚焦或其组合。
61.一种用于检测人受试者中FGFR融合体的存在的方法,所述方法包括:
(a)从人受试者获得生物样本;和
(b)检测所述受试者中是否存在编码FGFR融合蛋白的核酸序列。
62.如权利要求61所述的方法,其中所述核酸序列包括SEQ ID NO:1-77、80-84或95-145的任何一个。
63.如权利要求61所述的方法,其中所述检测包括使用杂交、扩增或测序技术来检测FGFR融合体。
64.如权利要求63所述的方法,其中所述扩增使用包括SEQ ID NO:162、163、164、165、166、167、168或169的引物。
65.如权利要求59或61所述的方法,其中所述FGFR融合体是FGFR-TACC融合体。
66.如权利要求59或61所述的方法,其中所述FGFR是FGFR1、FGFR2、FGFR3或FGFR4。
67.如权利要求65所述的方法,其中所述FGFR-TACC融合体是FGFR1-TACC1、FGFR2-TACC2或FGFR3-TACC3。
68.一种在体外引发致癌转化的方法,所述方法包括:
(a)用FGFR-TACC融合DNA转导体外培养的细胞;和
(b)确定所述细胞是否获得在锚定非依赖性条件下生长、形成多层病灶或其组合的能力。
69.一种在体外引发致癌转化的方法,所述方法包括:
(a)用FGFR-TACC融合DNA转导体外培养的细胞;
(b)用所述经转导的细胞注射小鼠;和
(c)确定肿瘤是否在所述小鼠中生长。
70.如权利要求69所述的方法,其中所述注射是皮下或颅内注射。
71.一种鉴别降低FGFR-TACC融合体的致癌活性的化合物的方法,所述方法包括:
(a)用FGFR-TACC DNA转导在体外培养的细胞;
(b)使细胞与配体源接触有效的时段;和
(c)确定所述细胞与在所述测试化合物不存在的情况下培养的细胞相比是否获得在锚定非依赖性条件下生长、形成多层病灶或其组合的能力。
说明书
本申请要求2012年7月24日提交的美国临时专利申请号61/675,006的权益和优先权,其内容在此通过引用整体并入。
本文引用的所有专利、专利申请和出版物在此通过引用整体并入。这些出版物的公开内容在此通过引用整体并入本申请。
本专利公开内容包含受版权保护的材料。版权拥有者不反对本专利文件或专利公开内容在美国专利商标局专利文档或记录中出现时被任何人传真复制,但是在其他情况下保留任何和全部版权权利。
政府支持
本发明根据美国国家癌症研究所授予的资助号R01CA101644和R01CA085628在政府支持下进行。政府拥有本发明的某些权利。
发明背景
多形性胶质母细胞瘤(GBM)是脑癌的最常见形式并且是所有人癌症中最难治和致命的。目前的护理标准包括外科手术、化疗和放疗。然而,GBM的预后一贯保持很差。很少有可用的靶向疗法,并且没有一个特异性靶向GBM。
据估计,世界范围内可能携带FGFR-TACC基因融合体并且会受益于靶向抑制FGFR激酶活性的GBM患者目标群体相当于每年6,000名患者。
发明概述
本发明至少部分基于GBM中高表达类型的基因融合体的发现,所述基因融合体将FGFR基因的酪氨酸激酶结构域与TACC1或TACC3的TACC结构域结合。本发明至少部分基于FGFR-TACC融合体鉴别会受益于靶向抑制FGFR的酪氨酸激酶活性的GBM患者亚组的发现。胶质母细胞瘤患者和罹患基因融合体相关癌症(例如,上皮癌)的其他受试者中FGFR和TACC基因的融合体的鉴别是有用的治疗靶标。
本发明的一个方面提供了一种纯化的融合蛋白,其包含与多肽融合的FGFR蛋白的酪氨酸激酶结构域,所述多肽组成型地激活所述FGFR蛋白的酪氨酸激酶结构域。在一个实施方案中,所述FGFR蛋白是FGFR1、FGFR2、FGFR3或FGR4。在另一个实施方案中,所述纯化的融合蛋白基本不含其他人蛋白。
本发明的一个方面提供了一种纯化的融合蛋白,其包含与具有酪氨酸激酶结构域的多肽融合的转化型酸性卷曲螺旋(TACC)结构域,其中所述TACC结构域组成型地激活所述酪氨酸激酶结构域。在一个实施方案中,所述TACC蛋白是TACC1、TACC2或TACC3。在另一个实施方案中,所述纯化的融合蛋白基本不含其他人蛋白。
本发明的一个方面提供了一种纯化的融合蛋白,其包含与含有转化型酸性卷曲螺旋(TACC)的蛋白的TACC结构域5’融合的FGFR蛋白的酪氨酸激酶结构域。在一个实施方案中,所述FGFR蛋白是FGFR1、FGFR2、FGFR3或FGR4。在另一个实施方案中,所述TACC蛋白是TACC1、TACC2或TACC3。在另一个实施方案中,所述纯化的融合蛋白基本不含其他人蛋白。
本发明的一个方面提供了一种由FGFR1-TACC1核酸编码的纯化的融合蛋白,其中FGFR1-TACC1包含与位于人染色体8p11上的TACC1的外显子7-13的组合5’剪接的位于人染色体8p11上的FGFR1的外显子1-17的组合,其中基因组断裂点出现在FGFR1的外显子1-17的任何一个和TACC1的外显子7-13的任何一个中。在另一个实施方案中,所述纯化的融合蛋白基本不含其他人蛋白。
本发明的一个方面提供了一种由FGFR2-TACC2核酸编码的纯化的融合蛋白,其中FGFR2-TACC2包含与位于人染色体10q26上的TACC2的任何外显子1-23的组合5’剪接的位于人染色体10q26上的FGFR2的任何外显子1-18的组合。在另一个实施方案中,所述纯化的融合蛋白基本不含其他人蛋白。
本发明的一个方面提供了一种由FGFR3-TACC3核酸编码的纯化的融合蛋白,其中FGFR3-TACC3包含与位于人染色体4p16上的TACC3的外显子8-16的组合5’剪接的位于人染色体4p16上的FGFR3的外显子1-16的组合,其中基因组断裂点出现在FGFR3的外显子1-16的任何一个和TACC3的外显子8-16的任何一个中。在另一个实施方案中,所述纯化的融合蛋白基本不含其他人蛋白。
本发明的一个方面提供了一种由FGFR3-TACC3核酸编码的纯化的融合蛋白,其中FGFR3-TACC3包含与位于人染色体4p16上的TACC3的外显子8-16的组合5’剪接的位于人染色体4p16上的FGFR3的外显子1-16的组合,其中基因组断裂点出现在FGFR3的内含子1-16的任何一个和TACC3的外显子8-16的任何一个中。在另一个实施方案中,所述纯化的融合蛋白基本不含其他人蛋白。
本发明的一个方面提供了一种由FGFR3-TACC3核酸编码的纯化的融合蛋白,其中FGFR3-TACC3包含与位于人染色体4p16上的TACC3的外显子8-16的组合5’剪接的位于人染色体4p16上的FGFR3的外显子1-16的组合,其中基因组断裂点出现在FGFR3的外显子1-16的任何一个和TACC3的内含子7-16的任何一个中。在另一个实施方案中,所述纯化的融合蛋白基本不含其他人蛋白。
本发明的一个方面提供了一种由FGFR3-TACC3核酸编码的纯化的融合蛋白,其中FGFR3-TACC3包含与位于人染色体4p16上的TACC3的外显子8-16的组合5’剪接的位于人染色体4p16上的FGFR3的外显子1-16的组合,其中基因组断裂点出现在FGFR3的内含子1-16的任何一个和TACC3的内含子7-16的任何一个中。在另一个实施方案中,所述纯化的融合蛋白基本不含其他人蛋白。
本发明的一个方面提供了一种编码上述融合蛋白的合成的核酸。
本发明的一个方面提供了一种纯化的FGFR3-TACC3融合蛋白,其包括SEQ ID NO:79、158、159、160或161。在另一个实施方案中,所述纯化的融合蛋白基本不含其他人蛋白。
本发明的一个方面提供了一种纯化的FGFR3-TACC3融合蛋白,其具有基因组断裂点,所述基因组断裂点包括来自SEQ ID NO:90的氨基酸730-758的至少3个连续氨基酸并且包括来自SEQ ID NO:92的氨基酸549-838的至少3个连续氨基酸。在另一个实施方案中,所述纯化的融合蛋白基本不含其他人蛋白。
本发明的一个方面提供了一种纯化的FGFR3-TACC3融合蛋白,其具有基因组断裂点,所述基因组断裂点包括SEQ ID NO:78。在另一个实施方案中,所述纯化的融合蛋白基本不含其他人蛋白。
本发明的一个方面提供了一种纯化的FGFR3-TACC3融合蛋白,其具有基因组断裂点,所述基因组断裂点包括SEQ ID NO:85、86、87或89的任何一个。在另一个实施方案中,所述纯化的融合蛋白基本不含其他人蛋白。
本发明的一个方面提供了一种纯化的FGFR1-TACC1融合蛋白,其包括SEQ ID NO:150。在另一个实施方案中,所述纯化的融合蛋白基本不含其他人蛋白。
本发明的一个方面提供了一种纯化的FGFR1-TACC1融合蛋白,其具有基因组断裂点,所述基因组断裂点包括来自SEQ ID NO:146的氨基酸746-762的至少3个连续氨基酸并且包括来自SEQ ID NO:148的氨基酸572-590的至少3个连续氨基酸。在另一个实施方案中,所述纯化的融合蛋白基本不含其他人蛋白。
本发明的一个方面提供了一种纯化的FGFR1-TACC1融合蛋白,其具有基因组断裂点,所述基因组断裂点包括SEQ ID NO:88。在另一个实施方案中,所述纯化的融合蛋白基本不含其他人蛋白。
本发明的一个方面提供了一种编码FGFR3-TACC3融合蛋白的纯化的DNA,其包括SEQ ID NO:94。在另一个实施方案中,所述纯化的融合蛋白基本不含其他人蛋白。
本发明的一个方面提供了一种编码FGFR3-TACC3融合蛋白的合成的核酸,其具有基因组断裂点,所述基因组断裂点包括来自SEQ ID NO:91的核苷酸2443-2530的至少9个连续框内核苷酸并且包括来自SEQ ID NO:93的核苷酸1800-2847的至少9个连续框内核苷酸。
本发明的一个方面提供了一种编码FGFR3-TACC3融合蛋白的合成的核酸,其具有基因组断裂点,所述基因组断裂点包括SEQ ID NO:1-77的任何一个。
本发明的一个方面提供了一种编码FGFR1-TACC1融合蛋白的合成核酸,其包括SEQ ID NO:151。
本发明的一个方面提供了一种编码FGFR1-TACC1融合蛋白的合成的核酸,其具有基因组断裂点,所述基因组断裂点包括来自SEQ ID NO:147的核苷酸3178-3228的至少9个连续框内核苷酸并且包括来自SEQ ID NO:149的核苷酸2092-2794的至少9个连续框内核苷酸。
本发明的一个方面提供了一种编码FGFR1-TACC1融合蛋白的合成的核酸,其具有基因组断裂点,所述基因组断裂点包括SEQ ID NO:83。
本发明的一个方面提供了一种抗体或其抗原结合片段,其特异性结合纯化的融合蛋白,所述纯化的融合蛋白包含与多肽融合的FGFR蛋白的酪氨酸激酶结构域,所述多肽组成型地激活所述FGFR蛋白的酪氨酸激酶结构域。在一个实施方案中,所述FGFR蛋白是FGFR1、FGFR2、FGFR3或FGFR4。在另一个实施方案中,所述融合蛋白是FGFR-TACC融合蛋白。在一个另外的实施方案中,所述FGFR-TACC融合蛋白是FGFR1-TACC1、FGFR2-TACC2或FGFR3-TACC3。在一些实施方案中,所述FGFR1-TACC1融合蛋白包含SEQ ID NO:150的氨基酸序列。在其他实施方案中,所述FGFR3-TACC3融合蛋白包含SEQ ID NO:79、158、159、160或161的氨基酸序列。
本发明的一个方面提供了一种用于降低受试者中融合蛋白的表达水平或活性的组合物,所述融合蛋白包含与多肽融合的FGFR蛋白的酪氨酸激酶结构域,所述多肽组成型地激活所述FGFR蛋白的酪氨酸激酶结构域,与药学上可接受的载体混合的所述组合物包含所述融合蛋白的抑制剂。在一个实施方案中,所述融合蛋白是FGFR-TACC融合蛋白。在另一个实施方案中,所述抑制剂包括特异性结合FGFR-TACC融合蛋白的抗体或其片段;特异性结合FGFR蛋白的小分子;特异性结合TACC蛋白的小分子;降低FGFR-TACC融合多肽的表达的反义RNA或反义DNA;特异性靶向FGFR-TACC融合基因的siRNA;或所列抑制剂的组合。在一个另外的实施方案中,所述FGFR蛋白是FGFR1、FGFR2、FGFR3或FGFR4。在一些实施方案中,所述FGFR-TACC融合蛋白是FGFR1-TACC1、FGFR2-TACC2或FGFR3-TACC3。在其他实施方案中,所述特异性结合FGFR蛋白的小分子包括AZD4547、NVP-BGJ398、PD173074、NF449、TK1258、BIBF-1120、BMS-582664、AZD-2171、TSU68、AB1010、AP24534、E-7080、LY2874455或所列小分子的组合。
本发明的一个方面提供了一种用于降低有需要的受试者中融合蛋白的表达水平或活性的方法,所述融合蛋白包含与多肽融合的FGFR蛋白的酪氨酸激酶结构域,所述多肽组成型地激活所述FGFR蛋白的酪氨酸激酶结构域。在一个实施方案中,所述方法包括向所述受试者施用治疗量的用于降低受试者中融合蛋白的表达水平或活性的组合物,所述融合蛋白包含与多肽融合的FGFR蛋白的酪氨酸激酶结构域,所述多肽组成型地激活所述FGFR蛋白的酪氨酸激酶结构域。在一个实施方案中,所述方法包括从受试者获得样本以确定受试者中FGFR融合分子的表达水平。在一些实施方案中,使样本与结合FGFR融合分子的物质例如抗体、探针、核酸引物等一起孵育。在一个实施方案中,检测或确定包括核酸测序、选择性杂交、选择性扩增、基因表达分析或其组合。在另一个实施方案中,检测或确定包括蛋白质表达分析,例如通过western印迹分析、ELISA或其他抗体检测方法。在一个另外的实施方案中,所述方法包括确定所述融合蛋白表达水平或活性与施用所述组合物之前的融合蛋白表达水平或活性相比是否降低,从而降低所述融合蛋白的表达水平或活性。在一个实施方案中,所述融合蛋白是FGFR-TACC融合蛋白。在一个另外的实施方案中,所述FGFR蛋白是FGFR1、FGFR2、FGFR3或FGFR4。在一些实施方案中,所述FGFR-TACC融合蛋白是FGFR1-TACC1、FGFR2-TACC2或FGFR3-TACC3。在一个实施方案中,用于降低融合蛋白的表达水平或活性的组合物包含特异性结合FGFR-TACC融合蛋白的抗体或其片段;特异性结合FGFR蛋白的小分子;特异性结合TACC蛋白的小分子;降低FGFR-TACC融合多肽的表达的反义RNA或反义DNA;特异性靶向FGFR-TACC融合基因的siRNA;或所列抑制剂的组合。在一个另外的实施方案中,所述FGFR蛋白是FGFR1、FGFR2、FGFR3或FGFR4。在一些实施方案中,所述FGFR-TACC融合蛋白是FGFR1-TACC1、FGFR2-TACC2或FGFR3-TACC3。在其他实施方案中,所述特异性结合FGFR蛋白的小分子包括AZD4547、NVP-BGJ398、PD173074、NF449、TK1258、BIBF-1120、BMS-582664、AZD-2171、TSU68、AB1010、AP24534、E-7080、LY2874455或所列小分子的组合。
本发明的一个方面提供了一种用于治疗有需要的受试者中基因融合体相关癌症的方法,所述方法包括向所述受试者施用有效量的FGFR融合分子抑制剂。在一个实施方案中,所述基因融合体相关癌症包括上皮癌。在一个实施方案中,所述基因融合体相关癌症包括多形性胶质母细胞瘤、乳腺癌、肺癌、前列腺癌或结肠直肠癌。在一个实施方案中,所述方法包括从受试者获得样本以确定所述受试者中FGFR融合分子的表达水平。在一些实施方案中,使样本与结合FGFR融合分子的物质例如抗体、探针、核酸引物等一起孵育。在一个实施方案中,检测或确定包括核酸测序、选择性杂交、选择性扩增、基因表达分析或其组合。在另一个实施方案中,检测或确定包括蛋白质表达分析,例如通过western印迹分析、ELISA或其他抗体检测方法。在另一个实施方案中,FGFR融合蛋白包括与多肽融合的FGFR蛋白,所述多肽组成型地激活所述FGFR蛋白的酪氨酸激酶结构域。在一个实施方案中,所述融合蛋白是FGFR-TACC融合蛋白。在另一个实施方案中,所述抑制剂包括特异性结合FGFR-TACC融合蛋白的抗体或其片段;特异性结合FGFR蛋白的小分子;特异性结合TACC蛋白的小分子;降低FGFR-TACC融合多肽的表达的反义RNA或反义DNA;特异性靶向FGFR-TACC融合基因的siRNA;或所列抑制剂的组合。在一个另外的实施方案中,所述FGFR蛋白是FGFR1、FGFR2、FGFR3或FGFR4。在一些实施方案中,所述FGFR-TACC融合蛋白是FGFR1-TACC1、FGFR2-TACC2或FGFR3-TACC3。在其他实施方案中,所述特异性结合FGFR蛋白的小分子包括AZD4547、NVP-BGJ398、PD173074、NF449、TK1258、BIBF-1120、BMS-582664、AZD-2171、TSU68、AB1010、AP24534、E-7080、LY2874455或所列小分子的组合。
本发明的一个方面提供了一种降低有需要的受试者中实体瘤的生长的方法,所述方法包括向所述受试者施用有效量的FGFR融合分子抑制剂,其中所述抑制剂降低所述实体瘤的大小。在一个实施方案中,所述实体瘤包括多形性胶质母细胞瘤、乳腺癌、肺癌、前列腺癌或结肠直肠癌。在一个实施方案中,所述方法包括从受试者获得样本以确定所述受试者中FGFR融合分子的表达水平。在一些实施方案中,使样本与结合FGFR融合分子的物质例如抗体、探针、核酸引物等一起孵育。在一个实施方案中,检测或确定包括核酸测序、选择性杂交、选择性扩增、基因表达分析或其组合。在另一个实施方案中,检测或确定包括蛋白质表达分析,例如通过western印迹分析、ELISA或其他抗体检测方法。在另一个实施方案中,FGFR融合蛋白包括与多肽融合的FGFR蛋白,所述多肽组成型地激活所述FGFR蛋白的酪氨酸激酶结构域。在一个实施方案中,所述融合蛋白是FGFR-TACC融合蛋白。在另一个实施方案中,所述抑制剂包括特异性结合FGFR-TACC融合蛋白的抗体或其片段;特异性结合FGFR蛋白的小分子;特异性结合TACC蛋白的小分子;降低FGFR-TACC融合多肽的表达的反义RNA或反义DNA;特异性靶向FGFR-TACC融合基因的siRNA;或所列抑制剂的组合。在一个另外的实施方案中,所述FGFR蛋白是FGFR1、FGFR2、FGFR3或FGFR4。在一些实施方案中,所述FGFR-TACC融合蛋白是FGFR1-TACC1、FGFR2-TACC2或FGFR3-TACC3。在其他实施方案中,所述特异性结合FGFR蛋白的小分子包括AZD4547、NVP-BGJ398、PD173074、NF449、TK1258、BIBF-1120、BMS-582664、AZD-2171、TSU68、AB1010、AP24534、E-7080、LY2874455或所列小分子的组合。
本发明的一个方面提供了一种用于确定来自受试者的样本是否表现FGFR融合体的存在的诊断试剂盒,所述试剂盒包括至少一个与FGFR融合体特异性杂交的寡核苷酸,或其部分。在一个实施方案中,所述寡核苷酸包括一组核酸引物或原位杂交探针。在另一个实施方案中,所述寡核苷酸包括SEQ ID NO:162、163、164、165、166、167、168、169或所列寡核苷酸的组合。在一个实施方案中,所述引物仅当FGFR融合体存在时引发聚合酶反应。在另一个实施方案中,所述确定包括基因测序、选择性杂交、选择性扩增、基因表达分析或其组合。在一个另外的实施方案中,所述FGFR融合体是FGFR-TACC融合体。在一些实施方案中,所述FGFR是FGFR1、FGFR2、FGFR3或FGFR4。在其他实施方案中,所述FGFR-TACC融合体是FGFR1-TACC1、FGFR2-TACC2或FGFR3-TACC3。
本发明的一个方面提供了一种用于确定来自受试者的样本是否表现FGFR融合蛋白存在的诊断试剂盒,所述试剂盒包括特异性结合FGFR融合蛋白的抗体,所述FGFR融合蛋白包括SEQ ID NO:79、85、86、87、88、89、150、158、159、160或161,其中所述抗体仅当FGFR融合蛋白存在时识别所述蛋白。在一个实施方案中,所述抗体针对FGFR融合体,所述FGFR融合体包括SEQ ID NO:79、85、86、87、88、89、150、158、159、160或161。在一个另外的实施方案中,所述FGFR融合体是FGFR-TACC融合体。在一些实施方案中,所述FGFR是FGFR1、FGFR2、FGFR3或FGFR4。在其他实施方案中,所述FGFR-TACC融合体是FGFR1-TACC1、FGFR2-TACC2或FGFR3-TACC3。
本发明的一个方面提供了一种用于检测人受试者中FGFR融合体的存在的方法。在一个实施方案中,所述方法包括从人受试者获得生物样本。在一些实施方案中,使样本与结合FGFR融合分子的物质例如抗体一起孵育。在另一个实施方案中,检测或确定包括核蛋白质表达分析,例如通过western印迹分析、ELISA或其他抗体检测方法。在一些实施方案中,所述方法还包括基于受试者的表达模式评估是否施用FGFR融合分子抑制剂。在另外的实施方案中,所述方法包括向受试者施用FGFR融合分子抑制剂。在另一个实施方案中,所述方法包括检测所述受试者中是否存在FGFR融合体。在一个实施方案中,所述检测包括通过以下方式来测量FGFR融合蛋白水平:使用针对SEQ ID NO:79、85、86、87、88、89、150、158、159、160或161的抗体的ELISA;使用针对SEQ ID NO:79、85、86、87、88、89、150、158、159、160或161的抗体的western印迹;质谱法、等电聚焦或所列方法的组合。在一些实施方案中,所述FGFR融合体是FGFR-TACC融合体。在其他实施方案中,所述FGFR是FGFR1、FGFR2、FGFR3或FGFR4。在其他实施方案中,所述FGFR-TACC融合体是FGFR1-TACC1、FGFR2-TACC2或FGFR3-TACC3。
本发明的一个方面提供了一种用于检测人受试者中FGFR融合体的存在的方法。在一个实施方案中,所述方法包括从人受试者获得生物样本。在一些实施方案中,使样本与结合FGFR融合分子的物质例如探针、核酸引物等一起孵育。在其他实施方案中,检测或确定包括核酸测序、选择性杂交、选择性扩增、基因表达分析或其组合。在一些实施方案中,所述方法还包括基于受试者的表达模式评估是否施用FGFR融合分子抑制剂。在另外的实施方案中,所述方法包括向所述受试者施用FGFR融合分子抑制剂。在另一个实施方案中,所述方法包括检测所述受试者中是否存在编码FGFR融合蛋白的核酸序列。在一个实施方案中,所述核酸序列包括SEQ ID NO:1-77、80-84或95-145的任何一个。在另一个实施方案中,所述检测包括使用杂交、扩增或测序技术来检测FGFR融合体。在一个另外的实施方案中,所述扩增使用包括SEQ ID NO:162、163、164、165、166、167、168或169的引物。在一些实施方案中,所述FGFR融合体是FGFR-TACC融合体。在其他实施方案中,所述FGFR是FGFR1、FGFR2、FGFR3或FGFR4。在其他实施方案中,所述FGFR-TACC融合体是FGFR1-TACC1、FGFR2-TACC2或FGFR3-TACC3。
本发明的一个方面提供了一种在体外引发致癌转化的方法。所述方法包括(a)用FGFR-TACC融合DNA转导体外培养的细胞;和(b)确定所述细胞是否获得在锚定非依赖性条件下生长、形成多层病灶或其组合的能力。
本发明的一个方面提供了一种在体外引发致癌转化的方法。所述方法包括(a)用FGFR-TACC融合DNA转导体外培养的细胞;(b)用经转导的细胞注射小鼠;和(c)确定肿瘤是否在所述小鼠中生长。在一个实施方案中,所述注射是皮下或颅内注射。
本发明的一个方面提供了一种鉴别降低FGFR-TACC融合体的致癌活性的化合物的方法。所述方法包括(a)用FGFR-TACC DNA转导在体外培养的细胞;(b)使细胞与配体源接触有效的时段;和(c)确定所述细胞与在测试化合物不存在的情况下培养的细胞相比是否获得在锚定非依赖性条件下生长、形成多层病灶或其组合的能力。
附图简述
为了符合PCT专利申请的要求,本文提供的许多附图是最初以彩色生成的图像的黑白呈现。在以下描述和实施例中,彩色图表和图像以其黑白外观描述。最初的彩色版本可以参见Singh等人,Science(2012),337(6099):1231-5(包括可在Science网站上获得的在线形式的原稿中可得的附带补充信息)。为了PCT的目的,Singh等人,Science(2012),337(6099):1231-5的内容,包括附带的“补充信息”,通过引用并入本文。
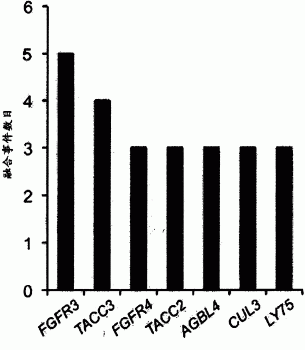
图1A是显示在TCGA中反复参与基因融合体的基因的图表。仅展示了不同样本中参与至少三个基因融合体中的基因。
图1B显示通过GSC的完整转录组测序鉴别的FGFR3-TACC3基因融合体。显示了在断裂点上比对的76个分裂read(split-read)(分别是SEQ ID NO:2-77)。在断裂点预测的阅读框显示于上部(紫色的FGFR3核苷酸序列(左)和绿色的TACC3核苷酸序列(右);SEQ ID NO:1),在预测的阅读框下面有红色的FGFR3序列(左)和蓝色的TACC3(右)。在预测的阅读框上面显示对应于SEQ ID NO:1的推定氨基酸序列(SEQ ID NO:78)。
图1C显示通过GSC的完整转录组测序鉴别的FGFR3-TACC3基因融合体。在左侧,显示源自GSC和GBM的cDNA的FGFR3-TACC3-特异性PCR。在右侧,Sanger测序图谱显示阳性样本中在断裂点处的阅读框(SEQ ID NO:80)和融合蛋白的推定翻译(SEQ ID NO:85)。
图1D显示通过GSC的完整转录组测序鉴别的FGFR3-TACC3基因融合体。显示了FGFR3-TACC3蛋白的氨基酸序列(SEQ ID NO:79)。对应于FGFR3或TACC3的残基分别以绿色或红色(加下划线)显示。融合蛋白使FGFR3的酪氨酸激酶结构域与TACC3的TACC结构域结合。
图1E显示通过GSC的完整转录组测序鉴别的FGFR3-TACC3基因融合体。显示了FGFR3外显子17与TACC3的内含子7的基因组融合体。在融合的mRNA中,FGFR3的外显子16与TACC3的外显子85’剪接。实心箭头指示融合体基因组引物的位置,其产生GSC-1123和GBM-1123中融合体特异性PCR产物。
图2A显示GBM中FGFR和TACC基因之间反复的基因融合体。具体地,显示了通过外显子组测序分析鉴别的FGFR3-TACC3基因融合体。显示了在四个TCGA GBM样本中比对FGFR3和TACC3基因的基因组断裂点的分裂read。对于TCGA-27-1835,SEQ ID NO:95显示了在断裂点处的阅读框(粗体),而SEQ ID NO:96-107分别显示了基因组断裂点的比对。对于TCGA-19-5958,SEQ ID NO:108显示了在断裂点处的阅读框(粗体),而SEQ ID NO:109-111分别显示了基因组断裂点的比对。对于TCGA-06-6390,SEQ ID NO:112显示了在断裂点处的阅读框(粗体),而SEQ ID NO:113-131分别显示了基因组断裂点的比对。对于TCGA-12-0826,SEQ ID NO:132显示了在断裂点处的阅读框(粗体),而SEQ ID NO:133-145分别显示了基因组断裂点的比对。
图2B显示GBM中FGFR和TACC基因之间反复的基因融合体。在左侧,显示来自GBM cDNA样本的FGFR3-TACC3的FGFR-TACC特异性PCR的凝胶。在右侧,Sanger测序图谱显示阳性样本中在断裂点处的阅读框(SEQ ID NO:81)和融合蛋白的推定翻译(SEQ ID NO:86)。
图2C显示GBM中FGFR和TACC基因之间反复的基因融合体。在左侧,显示来自GBM cDNA样本的FGFR3-TACC3的FGFR-TACC特异性PCR的凝胶。在右侧,Sanger测序图谱显示阳性样本中在断裂点处的阅读框(SEQ ID NO:82)和融合蛋白的推定翻译(SEQ ID NO:87)。
图2D显示GBM中FGFR和TACC基因之间反复的基因融合体。图表显示了来自Atlas-TCGA的四个GBM肿瘤中FGFR3和TACC3的联合异常表达。
图2E显示GBM中FGFR和TACC基因之间反复的基因融合体。CNV分析显示相同的四个Atlas-TCGA GBM样本中的FGFR3和TACC3基因的重排部分的显微放大。
图2F显示GBM中FGFR和TACC基因之间反复的基因融合体。在左侧,显示来自GBM cDNA样本的FGFR1-TACC1的FGFR-TACC特异性PCR的凝胶。在右侧,Sanger测序图谱显示阳性样本中在断裂点处的阅读框(SEQ ID NO:83)和融合蛋白的推定翻译(SEQ ID NO:88)。
图2G显示GBM中FGFR和TACC基因之间反复的基因融合体。在左侧,显示来自GBM cDNA样本的FGFR3-TACC3的FGFR-TACC特异性PCR的凝胶。在右侧,Sanger测序图谱显示阳性样本中在断裂点处的阅读框(SEQ ID NO:84)和融合蛋白的推定翻译(SEQ ID NO:89)。
图3A显示FGFR-TACC融合蛋白的转化活性。FGFR1-TACC1和FGFR3-TACC3诱导了Rat1A成纤维细胞的锚定非依赖性生长。在铺板之后14天从三个重复样本记录软琼脂集落数目。显示了代表性的显微照片。
图3B是显示来自用表达FGFR3-TACC3的Ink4A;Arf-/-星形细胞注射的小鼠的肿瘤的免疫荧光染色的显微照片,显示了神经胶质瘤特异性(巢蛋白、Oig2和GFAP)和增殖标志物(Ki67和pHH3)的阳性。通过表达FGFR-TACC融合体的Ink4A;Arf-/-星形细胞产生了皮下肿瘤。
图3C显示了用pTomo-shp53(n=8)或pTomo-EGFRvIII-shp53(n=7)(绿色线;黑白图像中的“浅灰色”)和pTomo-FGFR3-TACC3-shp53(n=8,红色线;黑白图像中的“深灰色”)颅内注射的小鼠的Ka plan-Meier存活曲线。曲线上的点指示死亡(对数秩检验,p=0.00001,pTomo-shp53对pTomo-FGFR3-TACC3-shp53)。
图3D显示了示出高级神经胶质瘤的组织学特征的晚期FGFR3-TACC3-shp53产生的肿瘤的苏木精和伊红染色的代表性显微照片。需要注意的是肿瘤细胞对正常脑的高度浸润。免疫荧光染色显示,神经胶质瘤和干细胞标志物(巢蛋白、Olig2和GFAP)、增殖标志物(Ki67和pHH3)和FGFR3-TACC3蛋白在FGFR3-TACC3-shp53脑肿瘤中广泛表达。F1-T1:FGFR1-TACC1;F3-T3:FGFR3-TACC3;F3-T3-K508M:FGFR3-TACC3-K508M。
图4A显示FGFR3-TACC3定位于纺锤体极,延迟有丝分裂进展并诱导染色体分离缺陷和FGFR3-TACC3融合体的非整倍性的组成型自磷酸化。用空白的慢病毒或表达FGFR3-TACC3或FGFR3-TACC3-K508M的慢病毒转导的Ink4A;Arf-/-星形细胞未经处理(0)或者用100nM FGFR抑制剂PD173074处理所示时间。使用所示抗体通过Western印迹分析磷酸化蛋白和总蛋白。
图4B显示FGFR3-TACC3定位于纺锤体极,延迟有丝分裂进展并诱导染色体分离缺陷。显示了Ink4A;Arf-/-星形细胞中FGFR3-TACC3的共聚焦显微镜分析的显微照片。z堆叠图像的最大密度投影显示覆盖代表性有丝分裂细胞的纺锤体极的FGFR3-TACC3(红色;黑白图像中“深灰色”)(上图)。在细胞分裂末期(下图),FGFR3-TACC3定位于中体。α-微管蛋白(绿色;黑白图像中的“灰色”),DNA(DAPI,蓝色;黑白图像中的“浅灰色”)。
图4C显示了用载体或FGFR3-TACC3转导的细胞的代表性荧光视频显微镜法的图。
图4D显示代表从核膜破裂(NEB)到细胞分裂末期开始和从NEB到核膜重建(NER)的时间分析的盒须图(Box and Whisker plot)。通过时差显微术(time-lapse microscopy)跟踪每种条件的50次有丝分裂,测量了有丝分裂的持续时间。
图4E显示FGFR3-TACC3定位于纺锤体极,延迟有丝分裂进展并诱导染色体分离缺陷。显示了具有染色体错分离的细胞的代表性图像。箭头指向染色体错排列、落后染色体和染色体桥。
图4F显示表达FGFR1-TACC1和FGFR3-TACC3的Rat1A中的分离缺陷的定量分析。F3-T3:FGFR3-TACC3;F3-T3-K508M:FGFR3-TACC3-K508M。
图5A显示用对照、FGFR3、TACC3或FGFR3-TACC3表达慢病毒转导的Rat1A细胞的染色体组型分析。有丝分裂中捕获细胞的染色体数分布并使用DAPI分析染色体组型。对于每种条件在100个中期细胞中计数染色体,以确定细胞群中染色体数的倍性和多样性。FGFR3-TACC3融合诱导了非整倍性。
图5B显示代表性染色体组型,并且图5C显示用对照或FGFR3-TACC3表达慢病毒转导的人星形细胞的染色体数的分布。对于每种条件在100个中期细胞中计数染色体,以确定细胞群中染色体数的倍性和多样性。
图5D显示对于每种条件在100个中期细胞中染色体数的定量分析,以确定细胞群中染色体数的倍性和多样性。(n=3独立实验)。
图6A显示FGFR-TK活性的抑制校正由FGFR3-TACC3引发的非整倍性。上图是用对照或FGFR3-TACC3慢病毒转导并用媒介物(DMSO)或PD173470(100nM)处理5天的Rat1A细胞的染色体组型分析。下图显示细胞群内的染色体数的倍性和多样性由每种条件的100个中期细胞中的染色体数的定量分析来确定。
图6B显示FGFR-TK活性的抑制校正由FGFR3-TACC3引发的非整倍性。在表达FGFR3-TACC3的细胞中通过PD173470对姐妹染色单体过早分离(PMSCS)的校正。各图显示代表性的中期扩展。通过DAPI使DNA染色。图6C显示姐妹染色单体粘连缺失的中期的定量分析(n=3;p=0.001,用DMSO处理的FGFR3-TACC3对用PD173470处理的FGFR3-TACC3)。
图7A显示FGFR-TK活性的抑制阻抑由FGFR3-TACC3引发的肿瘤生长。用所示慢病毒转导并用递增浓度的PD173074处理三天的Rat1A的生长速率。通过MTT测定确定细胞生长。数据表示为平均值±标准误差(n=4)。
图7B显示用PD173470以所示浓度处理所示时间的GSC-1123的生长速率。通过MTT测定来确定细胞生长。数据表示为平均值±标准误差(n=4)。
图7C显示沉默FGFR3-TACC3融合体的生长抑制效果。在左侧,将GSC-1123细胞的平行培养物以一式三份转导。用表达非靶向shRNA(Ctr)或靶向FGFR3的shRNA序列(sh2,sh3,sh4)的慢病毒转导表达FGFR3-TACC3融合体的Rat1A细胞。感染后五天,将细胞以2×104个细胞/孔的密度一式三份地铺板,并在所示时间记录台盼蓝排除细胞的数目。用表达sh-3和sh-4(最有效的FGFR3沉默序列)的慢病毒感染使FGFR3-TACC3表达培养物的生长速率恢复至与用空载体转导的Rat1A的水平相当的水平。值是平均值±标准偏差(n=3)。在右侧图中,将GSC-1123细胞用表达非靶向shRNA(sh-Ctr)的慢病毒或表达靶向FGFR3的sh-3和sh-4序列的慢病毒转导。使用FGFR3抗体对平行培养物进行western印迹分析以检测FGFT3-TACC3融合蛋白。显示β-肌动蛋白为用于加载的对照。
图7D显示FGFR抑制剂PD173074阻抑表达由FGFR3-TACC3的Ink4A;Arf-/-星形细胞产生的神经胶质瘤皮下异种移植物的肿瘤生长。在肿瘤建立之后(200-300mm3,箭头),小鼠用媒介物或PD173074(50mg/kg)处理14天。值是平均肿瘤体积±标准误差(n=7只小鼠每组)。
图7E是携带神经胶质瘤的小鼠在原位植入用FGFR3-TACC3转导的Ink4A;Arf-/-星形细胞之后的Kaplan-Meier分析。在肿瘤移植之后,将小鼠用媒介物(n=9)或AZD4547(50mg/kg)(n=7)处理20天(p=0.001)。
图8显示用于从由9个GSC培养物产生的RNA-Seq数据鉴别融合转录物的TX-Fuse流程示意图。续图显示用于鉴别来自84个GBM TCGA肿瘤样本的DNA外显子组序列的基因融合体重排的Exome-Fuse流程。
图9显示通过9个GSC的RNA-seq鉴别的融合转录物的验证。Sanger测序图谱显示阳性样本中在断裂点处的阅读框和融合蛋白的推定翻译(右侧)。左侧显示进行的RT-PCR的凝胶。(A)POLR2A-WRAP53。(B)CAPZB-UBR4。(C)ST8SIA4-PAM。(D)PIGU-NCOA6。
图9E显示通过9个GSC的完整转录组测序鉴别的融合转录物。显示在POLR2A-WRAP53融合体的断裂点上比对的54个分裂read。在上部显示在断裂点处的预测阅读框,其中POLR2A序列为红色(左)并且WRAP53为蓝色(右)。在续页上,显示在CAPZB-UBR4融合体的断裂点上比对的48个分裂read。在上部显示在断裂点处的预测阅读框,其中CAPZB序列为红色(左)并且UBR4为蓝色(右)。在之后的续页上,显示在ST8SIA4-PAM融合体的断裂点上比对的29个分裂read。在上部显示在断裂点处的预测阅读框,其中ST8SIA4序列为红色(左)并且PAM为蓝色(右)。在之后的续页上,显示在PIGU-NCOA6融合体的断裂点上比对的17个分裂read(上部)。在上部显示在断裂点处的预测阅读框,其中PIGU序列为红色(左)并且NCOA6为蓝色(右)。还(下部)显示在IFNAR2-IL10RB融合体的断裂点上比对的6个分裂read。在上部显示在断裂点处的预测阅读框,其中IFNAR2序列为红色(左)并且IL10RB为蓝色(右)。
图10A显示GSC和GBM样本中融合转录物表达的分析和验证。通过来自RNA-seq数据的read深度测量表达。浅灰色圆弧指示融合在一起的转录物的预测组分。图表中描绘了总体read深度(蓝色;黑白图像中的“灰色”)和分裂插入深度(红色;黑白图像中的“深灰色”),具有50-read增量和1800read的最大范围。注意融合事件中涉及的基因区域中极高的表达水平,特别是对于FGFR3-TACC3。
图10B显示GSC和GBM样本中融合转录物表达的分析和验证。上图,qRT-PCR显示GSC-1123中FGFR3-TACC3融合转录物中包括的FGFR3和TACC3mRNA序列的极高表达。下图,为了对比,还显示了GSC-0114中POLR2A-WRAP53融合体中包括的WRAP53mRNA的序列的表达。
图10C显示GSC-1123和GBM-1123中FGFR3-TACC3蛋白的表达。使用识别人FGFR3的N末端区域的单克隆抗体的western印迹分析显示GSC-1123中而非缺少FGFR3-TACC3重排的GSC培养物GSC-0331和GSC-0114中约150kD蛋白的表达。
图10D显示GSC和GBM样本中融合转录物表达的分析和验证。用肿瘤GBM-1123(上图)和缺少FGFR3-TACC3重排的GBM肿瘤的FGFR3抗体的免疫染色分析。FGFR3(红色;黑白图像中的“浅灰色”),DNA(DAPI,蓝色;黑白图像中的“灰色”)。以低(左)和高(右)放大倍数拍照。
图10E显示通过来自GSC-1123的单克隆抗FGFR3抗体免疫沉淀的约150kD融合蛋白的MS/MS分析,鉴别定位于FGFR3的三个独特肽(FGFR3肽1、2和3)和定位于TACC3的C末端区域的三个肽(TACC肽1、2和3)。
图11A-C显示用对照慢病毒或表达FGFR3、TACC3、FGFR3-TACC3的慢病毒转导的Rat1A细胞(图11A),其通过使用识别FGFR3的N末端(包括在FGFR3-TACC3融合蛋白中)或TACC3的N末端(不包括在FGFR3-TACC3融合蛋白中)的抗体的Western印迹分析。图11B显示与Rat1A中慢病毒表达的FGFR3-TACC3相比较,GSC-1123中内源性FGFR3-TACC3的定量Western印迹分析。图11C显示Rat1A中FGFR3-TACC3和FGFR3-TACC3-K508M的Western印迹分析。显示α-微管蛋白为用于加载的对照。
图11D-F显示FGFR3-TACC3融合构建体的表达分析(图11D),GBM-1123(左上图)、BTSC1123(右上图)、由FGFR3-TACC3表达慢病毒诱导的小鼠GBM(左下图)和通过FGFR3-TACC3融合体转化的小鼠星形细胞的皮下异种移植物(右下图)的FGFR3免疫染色;FGFR3-TACC3,红色(黑白图像中的“浅灰色”);DNA(DAPI),蓝色(黑白图像中的“灰色”)。图11E显示图11D中所示肿瘤和细胞培养物中FGFR3-TACC3阳性细胞的定量。图11F显示小鼠星形细胞和FGFR3-TACC3诱导的小鼠GBM(mGBM-15和mGBM-17)中异位FGFR3-TACC3融合蛋白的定量Western印迹分析,与GBM1123中的内源表达相对比。显示β-肌动蛋白为用于加载的对照。F3-T3:FGFR3-TACC3。显示α-微管蛋白或β-肌动蛋白为用于加载的对照。
图12A显示western印迹。使用空慢病毒或表达FGFR3-TACC3的慢病毒转导的Ink4A;Arf-/-星形细胞不接触丝裂原,并保持未处理(时间0)或用浓度50ng/ml的FGF-2处理所示时间。使用所示抗体通过Western印迹分析磷酸化蛋白和总蛋白。显示α-微管蛋白为用于加载的对照。
图12B显示western印迹。使用空慢病毒或表达FGFR3-TACC3或FGFR3-TACC3-K508M的慢病毒转导的Ink4A;Arf-/-星形细胞不接触丝裂原,并保持未处理(时间0)或用所示浓度的FGF-1处理10分钟。使用所示抗体通过Western印迹分析磷酸化蛋白和总蛋白。显示β-肌动蛋白为用于加载的对照。
图12C显示western印迹。使用空慢病毒或表达FGFR3-TACC3或FGFR3-TACC3-K508M的慢病毒转导的Ink4A;Arf-/-星形细胞不接触丝裂原,并保持未处理(时间0)或用所示浓度的FGF-8处理10分钟。使用所示抗体通过Western印迹分析磷酸化蛋白和总蛋白。显示β-肌动蛋白为用于加载的对照。
图12D-F显示FGFR3-TACC3融合蛋白的有丝分裂定位。图12D显示使用FGFR3抗体免疫染色(红色;黑白图像中的“深灰色”)的中期代表性FGFR3-TACC3表达Ink4A;Arf-/-小鼠星形细胞的最大强度投影共聚焦图像。FGFR3-TACC3展示一个纺锤体极上部的不对称定位。图12E显示使用TACC3抗体免疫染色(红色;(黑白图像中的“深灰色”)的中期代表性TACC3表达Ink4A;Arf-/-小鼠星形细胞的最大强度投影共聚焦图像。TACC3染色与纺锤体微管一致。图12F显示使用FGFR3抗体免疫染色(红色;(黑白图像中的“深灰色”)的中期代表性FGFR3表达Ink4A;Arf-/-小鼠星形细胞的最大强度投影共聚焦图像。FGFR3不显示有丝分裂中的特异性染色模式。将细胞用α-微管蛋白共免疫染色(绿色;(黑白图像中的“浅灰色”)以使有丝分裂纺锤体可见。用DAPI复染DNA(蓝色;(黑白图像中的“灰色”)。以0.250μm间隔获得图像。在应用的实验条件下,FGFR3或TACC3的内源性水平是不可检测的。F3-T3:FGFR3-TACC3。
图13A显示FGFR3-TACC3蛋白诱导染色体错分离、染色单体粘连缺陷和有缺陷的纺锤体检查点。表达载体对照或FGFR3-TACC3的Ink4A;ARF-/-星形细胞中染色体分离缺陷的中期扩展的定量分析(上图)。表达FGFR3-TACC3或载体对照的Ink4A;Arf-/-星形细胞中染色体分离缺陷的显微镜成像分析。具有染色体错分离的细胞的代表性图像。箭头指向染色体错排列、落后染色体和染色体桥。
图13B-D显示表达FGFR3-TACC3的Ink4A;Arf-/-星形细胞(图13B)和Rat1A细胞(图13C)中姐妹染色单体过早分离(PMSCS)的代表性图像。左,各图显示代表性的中期扩展。右,具有姐妹染色单体粘连缺失的中期的定量分析。在三次独立实验中对每种条件在至少100个中期中记录Ink4A;Arf-/-星形细胞中具有PMSCS的有丝分裂数目。在Rat1A细胞的一式三份样本中记录具有PMSCS的有丝分裂数目。图13D是显示向用指定的慢病毒转导的Rat1A-H2B-GFP细胞添加噻氨酯哒唑持续所示持续时间的图表。通过在每个时间点定量有丝分裂中的H2B-GFP阳性细胞来确定每个时间点的有丝分裂指数。数据表示为平均值和标准偏差(n=3)。F3-T3:FGFR3-TACC3。
图14A-B显示用表达FGFR3-TACC3融合体的慢病毒或空载体转导的人原代星形细胞的生长曲线。进行FGFR3-TACC3融合体介导的生长改变和RTK抑制剂对携带FGFR-TACC融合体的细胞的特异性作用的分析。图14A是显示通过在感染后7天(第1代)的MTT测定来确定用表达FGFR3-TACC3融合体的慢病毒或空载体转导的人原代星形细胞的细胞增殖的图表。值是平均值±标准偏差(n=4)。p值:0.0033。图14是显示通过在感染后六周(第10代)的MTT测定来确定用表达FGFR3-TACC3融合体的慢病毒或空载体转导的人原代星形细胞的细胞增殖的图表。值是平均值±标准偏差(n=4)。p值:0.0018。
图14C-D显示FGFR抑制剂对FGFR-TACC融合体表达细胞的特异性生长抑制作用。通过MTT测定确定细胞生长。用所示慢病毒转导的Rat1A细胞用BGJ398(图14C)或AZD4547(图14D)以所示浓度处理三天。值是平均值±标准误差(n=4)。
图14E显示沉默FGFR3-TACC3融合体的生长抑制作用。(左)用表达非靶向shRNA(Ctr)的慢病毒或表达靶向FGFR3的sh-3和sh-4序列的慢病毒以一式三份转导GSC-1123细胞。感染五天之后,将细胞以2×104个细胞/孔的密度一式三份地铺板,并在所示时间记录台盼蓝排除细胞的数目。值是平均值±标准偏差(n=3)。(右)对在感染后五天收集的平行培养物使用FGFR3抗体进行Western印迹分析以检测FGFT3-TACC3融合蛋白。β-肌动蛋白显示为用于加载的对照。(**:p值=<0.005;***:p值=<0.0001)。
图15显示用PD173074、NVP-BGJ398或AZD4547处理的细胞的存活曲线图。
图16显示通过GSC的完整转录组测序鉴别的FGFR3-TACC3基因融合体。直方图描述了跨越断裂点的每个正向和反向序列read的绝对频率。
图17显示FGFR3-TACC3的转化活性。FGFR3-TACC3诱导Rat1A成纤维细胞中锚定非依赖性生长(上图)和Ink4A;Arf-/-初级星形细胞中转化的表型(下图)。
图18显示FGFR3-TACC3的转化活性。显示了用pTomo-shp53(n=8)、pTomo-FGFR3-TACC3-shp53(n=8)和pTomo-EGFRvIII-sh p53(n=7)颅内注射的小鼠的Kaplan-Meier存活曲线。曲线上的各点指示死亡(对数秩检验,p=0.025,pTomo-shp53对pTomo-FGFR3-T ACC3-shp53)。
图19显示FGFR-TK活性的抑制校正由FGFR3-TACC3引发的非整倍性并阻抑由FGFR3-TACC3引发的肿瘤生长。显示了用所示慢病毒转导并用所示浓度的PD173470处理的Rat1A的短期生长抑制测定。细胞被处理三天。通过MTT测定确定细胞存活。误差线显示平均值±标准误差(n=4)。
图20是用所示慢病毒转导并用PD173470以所示浓度处理四天的人星形细胞的生长抑制测定。通过MTT测定确定细胞活力。误差线显示平均值±标准误差(n=4)。
图21是显示用所示慢病毒转导并用PD173470以所示浓度处理四天的人星形细胞的生长抑制测定的图表。通过MTT测定确定细胞活力。误差线显示平均值±标准误差(n=4)。
图22显示短期生长抑制测定中Rat1A细胞的存活的图表。(上图表)将Rat1A细胞用所示ptomo构建体转导并用PD173074以所示浓度处理。细胞被处理三天。通过MTT测定确定细胞活力。误差线显示平均值±标准误差(n=4)。在下图中,显示了western印迹照片。
图23显示FGFR-TK活性的抑制校正由FGFR3-TACC3引发的非整倍性并阻抑由FGFR3-TACC3引发的肿瘤生长。显示了用对照或FGFR3-TACC3慢病毒转导并用媒介物(DMSO)或PD173470(100nM)处理五天的Rat1A细胞的染色体组型分析的图表。
图24显示在颅内植入用FGFR3-TACC3转导的Ink4A;Arf-/-星形细胞之后追踪携带神经胶质瘤的小鼠的存活。在肿瘤移植之后,将小鼠用媒介物或AZD4547(50mg/kg)处理20天(媒介物,n=7;AZD4547,n=6;p=0.001)。
图25显示FGFR3-TACC3融合蛋白的氨基酸序列中来自图10E的肽的位置,其以粉色(FGFR3;加下划线)和蓝色(TACC3;虚线)突出显示。
图26显示IDH突变体和FGFR3-TACC3阳性人GBM的Kaplan-Meier分析。对数秩检验p值:0.0169。
图27是显示在皮下注射用慢病毒转导的Ink4A;Arf-/-小鼠星形细胞之后诱导的肿瘤异种移植物的图片,所述慢病毒表达FGFR3-TACC3(上图A,右侧)或FGFR1-TACC1(下图B,右侧)融合体但没有空载体(上图,左侧)或在激酶结构域中携带K508M突变的FGFR3-TACC3(FGFR3-TACC3-K508M;下图,左侧)。
图28显示FGFR3-TACC3融合体的组成型自磷酸化。源自FGFR3-TACC3或RasV12诱导小鼠GBM的BTSC未经处理或者用500nM PD173074处理所示时间。使用所示抗体通过Western印迹分析磷酸化蛋白和总蛋白。显示β-肌动蛋白为用于加载的对照。
图29显示代表性FGFR3-TACC3表达Ink4A;Arf-/-小鼠星形细胞的Z堆叠共聚焦图像,显示为最大强度投影。将细胞用FGFR3(红色;黑白图像中的“深灰色”)和α-微管蛋白(绿色;(黑白图像中的“浅灰色”)免疫染色。DNA用DAPI复染(蓝色;(黑白图像中的“灰色”)。以0.250μm间隔获取图像。指示了图像系列的坐标。F3-T3:FGFR3-TACC3。
图30显示SKY染色体组型分析的实例,描绘了来自GSC-1123的相同培养物的两种不同细胞,示例说明了正在进行的CIN和非整倍性。表6报告了20种细胞的染色体组型分析的细节。
图31是使用Integrated Genomic Viewers软件显现的区段CNV数据的图示。三个膀胱尿路上皮癌携带FGFR3-TACC3基因融合体(黑色框)。红色指示扩增(A),蓝色指示缺失(D)。
图32是使用Integrated Genomic Viewers软件显现的区段CNV数据的图示。一个乳腺癌携带FGFR3-TACC3基因融合体(黑色框)。红色指示扩增(A),蓝色指示缺失(D)。
图33是使用Integrated Genomic Viewers软件显现的区段CNV数据的图示。一个结肠直肠癌携带FGFR3-TACC3基因融合体(黑色框)。红色指示扩增(A),蓝色指示缺失(D)。
图34是使用Integrated Genomic Viewers软件显现的区段CNV数据的图示。一个肺鳞状细胞癌携带FGFR3-TACC3基因融合体(黑色框)。红色指示扩增(A),蓝色指示缺失(D)。
图35是使用Integrated Genomic Viewers软件显现的区段CNV数据的图示。一个头颈鳞状细胞癌携带FGFR3-TACC3基因融合体(黑色框)。红色指示扩增(A),蓝色指示缺失(D)。
发明详述
多形性胶质母细胞瘤(GBM)是成人脑肿瘤的最常见形式,占颅内肿瘤的12-15%和原发性脑肿瘤的50-60%。GBM是人癌症的最致命形式。癌症的成功靶向疗法的历史大大符合恶性血液病和近期一些类型的上皮癌中反复且致癌的基因融合体的失活。GBM是人癌症的最致命且难治的形式。针对GBM中常见遗传改变的靶向疗法没有改变疾病的差的临床结果,最可能是因为它们未能系统消除GBM的真正成瘾癌蛋白活性。GBM中还没有发现导致致癌基因融合体产生的反复的染色体重排。
GBM是人中待治疗癌症的最困难形式(1)。迄今为止,已经针对GBM中可能重要的致癌靶测试的治疗方法实现了有限的成功(2-4)。导致致癌融合体蛋白生成的反复的染色体易位被视为人癌症发病机理中的引发和成瘾事件,因此提供了癌症疗法的最希望的分子靶(5,6)。还没有在GBM中发现反复且致癌的基因融合体。染色体重排是恶性血液病的标志,但是近期,还在实体瘤亚组(乳腺癌、前列腺癌、肺癌和结肠直肠癌)中发现它们(7,8)。其肿瘤携带这些重排的患者的重要且成功的靶向治疗介入源自功能性基因融合体的发现,特别是当易位涉及激酶编码基因(BCR-ABL,EML4-ALK)时(9,10)。
GBM的标志是强烈的染色体不稳定性(CIN),其导致非整倍性(11)。CIN和非整倍性是癌症发病机理中的早期事件(12)。已经表明,靶向有丝分裂保真度的遗传改变可能是有丝分裂期间染色体错分离的原因,从而导致非整倍性(13,14)。
成纤维细胞生长因子受体(FGFR)是结合成纤维细胞生长因子蛋白家族成员的跨膜受体。FGFR的结构由以下组成:保护三个Ig样结构域的细胞外配体结合结构域、单跨膜螺旋结构域和具有酪氨酸激酶活性的细胞内结构域(Johnson,D.E.,Williams,E.T.Structural and functional diversity in the FGF receptor multigene family.(1993)Adv.Cancer Res,60:1–41)。
转化型酸性卷曲螺旋蛋白(TACC)通过将迷你纺锤体(Msp)/XMAP215蛋白募集到中心体而使微管稳定。癌症中已经涉及TACC。
从医学角度,FGFR-TACC融合体提供了GBM中首个“有诚意的(bonafide)”致癌成瘾的基因融合体,其鉴别在该疾病中长久以来是过时的。
DNA和氨基酸操纵方法及其纯化
除非另外指明,本发明各方面的实施可以采用细胞生物学、细胞培养、分子生物学、转基因生物学、微生物学、重组DNA和免疫学的常规技术,这些在本领域技术内。此类技术在文献中有充分解
融合蛋白及其方法专利购买费用说明
![]()
Q:办理专利转让的流程及所需资料
A:专利权人变更需要办理著录项目变更手续,有代理机构的,变更手续应当由代理机构办理。
1:专利变更应当使用专利局统一制作的“著录项目变更申报书”提出。
2:按规定缴纳著录项目变更手续费。
3:同时提交相关证明文件原件。
4:专利权转移的,变更后的专利权人委托新专利代理机构的,应当提交变更后的全体专利申请人签字或者盖章的委托书。
Q:专利著录项目变更费用如何缴交
A:(1)直接到国家知识产权局受理大厅收费窗口缴纳,(2)通过代办处缴纳,(3)通过邮局或者银行汇款,更多缴纳方式
Q:专利转让变更,多久能出结果
A:著录项目变更请求书递交后,一般1-2个月左右就会收到通知,国家知识产权局会下达《转让手续合格通知书》。
动态评分
0.0