IPC分类号 : C07F15/00,C07F19/00,C08F10/00,C08F110/02,C08F4/80,C08F4/70
专利摘要
本发明提供了一种苯胺蒽醌后过渡金属配合物及其制备方法和应用,包括以下步骤,首先将氯蒽醌与取代苯胺溶解在溶剂中,在一定温度和催化作用下反应,生成苯胺蒽醌类配体;然后将苯胺蒽醌类配体溶解于有机溶剂,在适当温度条件下,加入拔氢试剂反应,拔掉氨基氢形成配体盐化合物;然后加入金属前驱体,反应;即得到苯胺蒽醌后过渡金属配合物。本发明所提供的苯胺蒽醌后过渡金属配合物可以用于烯类单体的均聚或共聚,本发明所提供的催化体系用于烯类聚合,通过选择不同助催化剂,既能获得高聚物又能获得低聚物。
说明书
技术领域
本发明属于烯烃催化技术领域,涉及一种苯胺蒽醌后过渡金属配合物及其制备方法与应用,特别是涉及催化乙烯和/或环烯烃、极性/功能单体均聚或共聚中应用的苯胺蒽醌后过渡金属配合物和催化剂组合物及其制备方法和应用方法。
背景技术
聚烯烃催化剂是烯烃聚合工业生产工艺的核心和关键,其种类众多,目前工业化的催化剂主要有Ziegler-Natta催化剂体系(DE Pat889229(1953);IT Pat545332(1956);IT Pat536899(1956);Chem.Rev.,2000,100,1169.)、Phillips催化剂体系(Belg.Pat.530617(1955);Chem.Rev.,1996,96,3327.)和茂金属催化剂体系(Kaminsky.W.,Berlin:Springer,1999.)。
近些年,后过渡金属烯烃聚合催化剂得到了长足发展。后过渡金属催化剂对于烯烃高聚的首次突破是1995年Brookhart等人报道的α-二亚胺基镍、钯催化剂(Brookhart.M.,J.Am.Chem.Soc.,1995,117,6414.),这系列催化剂的开发也极大地推动了后过渡金属烯烃聚合催化剂的发展。Grubbs等在Science上报道了一类中性水杨醛亚胺合镍(II)催化剂(Grubbs.R.H.,Science,2000,287,460.),该类催化剂在温和条件下就能够得到高分子量、低支链化的聚乙烯,更重要的是能够催化乙烯与含有极性官能团的烯烃共聚得到共聚物。
酮-亚胺类镍系催化剂也表现出优良的催化性能而被广泛研究。Brookhart等人报道了系列酮-亚胺类镍催化剂(Brookhart,M.,Organometallics.,2001,20,3217;Organometallics.,2003,22,3533;Organometallics.,2003,22,250.),该系列催化剂即使在没有助催化剂的情况下仍有一定的催化活性,获得带有短支链的聚乙烯,但并没有对极性单体的聚合性能进行研究。Shiono等人报道了苯胺基萘醌镍催化剂(Macromol.Rapid Commun.,2006,27,1418.),在B(C6F5)3存在条件下表现出很高的乙烯活性,获得带有长支链的聚乙烯,但该催化剂在没有助催化剂存在的情况下聚合活性低,且也并未见研究其对极性单体的聚合能力。Kim等报道了一类酮亚胺配体镍催化剂在改性甲基铝氧烷的活化下(Kim,I.J.Organomet.Chem.,2009,694,1254.),可以高选择性的生成丁烯,但活性并不算太高,且文章报道其只能生成微量高聚物。目前,为了达到较高的聚合活性,后过渡金属催化剂大多数情况下仍然需要大量的烷基铝氧烷或昂贵的硼化合物等助催化剂;而且,利用同一种配合物既可以得到高聚物又可以得到高选择性的齐聚物的催化体系也是非常稀少的。
发明内容
本发明的目的是提供一种苯胺蒽醌后过渡金属配合物及其制备方法与应用,特别是提供催化乙烯和/或环烯烃、极性/功能单体均聚或共聚中应用的苯胺蒽醌后过渡金属配合物和催化剂组合物及其制备方法和应用方法,本发明所提供的催化体系用于烯烃聚合,通过选择不同助催化剂,既能获得高聚物又能获得低聚物。
本发明的苯胺蒽醌后过渡金属配合物的制备方法,步骤为:
(1)将氯蒽醌与取代苯胺溶解在溶剂中,在一定温度和催化作用下反应,生成苯胺蒽醌类配体;
(2)将所述苯胺蒽醌类配体溶解于有机溶剂,在适当温度条件下:
a)加入拔氢试剂反应,拔掉氨基氢形成配体盐化合物;
b)然后加入金属前驱体,反应;
即得到所述苯胺蒽醌后过渡金属配合物。
作为优选的技术方案:
如上所述的苯胺蒽醌后过渡金属配合物的制备方法,步骤(1)中,所述溶剂为正庚烷、甲苯、氯苯、1,4-二氧六烷、辛烷、4-甲基-2-戊酮或乙二胺;所述一定温度为90~130℃,催化作用下反应的时间为12~36h;
所述催化作用的体系包括主催化剂、助催化剂和碱,所述主催化剂为双(二亚芐基丙酮)钯或三(二亚苄基丙酮)二钯或乙酸钯,所述助催化剂为联芳基膦或大位阻膦基二茂铁,所述碱为NaOtBu、K3PO4、Cs2CO3或K2CO3;
其中大位阻膦基二茂铁优选为1,1'-双(二苯基膦)二茂铁。
如上所述的苯胺蒽醌后过渡金属配合物的制备方法,步骤(2)中,所述有机溶剂为甲苯、四氢呋喃、二氯甲烷、乙醚、正己烷、氯苯或者1,4-二氧六烷;
所述适当温度条件是指0~60℃;
所述拔氢试剂为氢化钠、氢化钾、正丁基锂、叔丁醇钾或二(三甲基硅基)氨基钠;所述拔氢试剂与所述苯胺蒽醌类配体的摩尔比为1~2.2:1;加入拔氢试剂反应是指苯胺蒽醌配体与所述拔氢试剂在0~60℃下反应1~10h,将苯胺蒽醌配体上的氨基氢拔除,形成配体盐化合物;
所述金属前驱体为反式-氯-(苯基)双(三苯基磷)镍(Ⅱ)、反式-氯-(甲基)双(三甲基磷)镍(Ⅱ)、氯化烯丙基镍(II)二聚物、氯(环辛二烯)甲基钯或氯化烯丙基钯(II)二聚物;
所述金属前驱体与所述苯胺蒽醌类配体的摩尔比为1:0.5~1;加入金属前驱体后的反应是指在0~60℃下,苯胺蒽醌配体盐化合物与金属前驱体配位反应5~20h,形成本发明所提供的苯胺蒽醌金属配合物;
所述金属前驱体的金属为钯时,再添加吡啶或二甲基亚砜,反应1~6h,所添加的吡啶或二甲基亚砜与所述苯胺蒽醌类配体的摩尔比为1~5:1;
步骤(1)生成苯胺蒽醌类配体后,通过有机溶剂重结晶或者是通过有机溶剂萃取进行提纯处理;重结晶或萃取提纯的有机溶剂为甲苯、二氯甲烷、四氢呋喃、乙醚、正己烷、正庚烷、氯苯、甲醇或乙醇。
如上所述的苯胺蒽醌后过渡金属配合物的制备方法,所述氯蒽醌为1-氯蒽醌、1,5-二氯蒽醌、1-氯蒽醌的衍生物或1,5-二氯蒽醌的衍生物;结构通式为:
所述取代苯胺的结构式为:
其中,R1、R2、R3、R4和R5彼此独立地选自氢、烷基、烷基的取代物、烷氧基、烷硫基、卤素、硝基、芳基或芳基取代物,或者进一步,R1和R5,R4和R5,R3和R4,R2和R3形成碳或含有杂原子的环结构;所述环结构上独立的带有氢、烷基、烷基的取代物、烷氧基、烷硫基、卤素、硝基、芳基或芳基取代物中的一种或几种;
所述氯蒽醌与所述取代苯胺的摩尔比为1:0.8~3;
所述主催化剂为所述氯蒽醌质量的2~8%;
所述主催化剂与助催化剂的摩尔比为1:1.2~2;
所述碱与所述氯蒽醌的摩尔比为1~3:1;
所述1-氯蒽醌的衍生物为1-氯-8-甲基蒽醌、1-氯-7-甲基蒽醌、1-氯-5,8-二甲基蒽醌或4-氯-1-羟基-6-硝基蒽醌;
所述1,5-二氯蒽醌的衍生物为1,5-二氯-4-甲基蒽醌、1,5-二氯-4,8-二甲氧基蒽醌或1,5-二氯-4-甲基蒽醌。
所述苯胺蒽醌类配体的结构通式式为:
本发明的制备方法制得的苯胺蒽醌后过渡金属配合物,具有以下结构通式:
其中,R1~R5彼此独立地选自氢、烷基、烷基的取代物、烷氧基、烷硫基、卤素、硝基、芳基或芳基取代物,或者进一步,R1和R5,R4和R5,R3和R4,R2和R3形成碳或含有杂原子的环结构;
所述环结构上独立的带有氢、烷基、烷基的取代物、烷氧基、烷硫基、卤素、硝基、芳基或芳基取代物中的一种或几种;
R6为甲基、苯基、苄基或者无取代基;
R7~R13彼此独立地选自氢、烷基、烷基的取代物、烷氧基、烷硫基、硝基、羟基、羧基、芳基或芳基取代物中的一种或几种,或者进一步地,R7和R8,R8和R9,R9和R10,R11和R12,R12和R13独立形成碳或含有杂原子的环结构;
所述环结构独立的带有氢、烷基、烷基的取代物、烷氧基、烷硫基、硝基、羟基、羧基、芳基或芳基取代物中的一种或几种;
M为镍或钯;
L为三甲基膦、三苯基膦、吡啶、二甲基亚砜或烯丙基。
本发明还提供了一种苯胺蒽醌后过渡金属配合物制备的催化剂组合物,所述催化剂组合物由所述苯胺蒽醌后过渡金属配合物和助催化剂组成;所述助催化剂选自铝氧烷、烷基铝化合物、氯化烷基铝化合物、三氯化铝、硼化合物或双-(1,5-环辛二烯)镍中的一种以上。
如上所述的一种催化剂组合物,所述铝氧烷具体为甲基铝氧烷(MAO)、叔丁基铝改性的甲基铝氧烷(MMAO)或者干燥的叔丁基铝改性的甲基铝氧烷(DMMAO);所述烷基铝化合物具体为三甲基铝、三乙基铝、三异丁基铝、三正己基铝或三正辛基铝;所述的氯化烷基铝化合物具体为氯化二乙基铝或者二氯化乙基铝;硼化合物具体为三(五氟苯基)硼烷;所述苯胺蒽醌后过渡金属配合物与铝的摩尔比为1:30~5000;
所述苯胺蒽醌后过渡金属配合物与三(五氟苯基)硼烷或双-(1,5-环辛二烯)镍的摩尔比为1:1~10。
本发明还提供了所述催化剂组合物在催化烯烃单体的均聚或共聚中的应用。
本发明更进一步提供了上述过渡金属配合物和其与上述催化剂组合物在催化乙烯和环烯烃的均聚,以及共聚中的应用。
如上所述的应用,在惰性气体保护下,苯胺蒽醌后过渡金属配合物或催化剂组合物先溶解于溶剂中,然后加入烯烃单体,在-50~120℃,0.1~5MPa下反应聚合1~1440min,制得烯烃均聚物或烯烃共聚物;
所述溶剂为甲苯、氯苯、正己烷或正庚烷;
所述烯烃单体为乙烯、环烯烃或极性/功能单体;
所述环烯烃为降冰片烯、5-甲基-2-降冰片烯、5-乙基-2-降冰片烯、5-丁基-2-降冰片烯、5-己基-2-降冰片烯、5-癸基-2-降冰片烯、5-乙烯基-2-降冰片烯、5-丙烯基-2-降冰片烯、5-环己基-2-降冰片烯、5-环戊基-2-降冰片烯、双环戊二烯或甲基双环戊二烯;
所述极性/功能单体5-降冰片烯-2-羧酸甲酯、5-降冰片烯-2-甲醛、乙酸5-己烯基酯、降冰片烯二酸酐、丙烯酸甲酯、乙酸烯丙酯、乙烯基乙醚、烯丙基乙醚、乙酸乙烯酯溴丙烯或氯丙烯;
所述极性/功能单体与苯胺蒽醌后过渡金属配合物或催化剂组合物的摩尔比为10~50000:1;
所述烯烃聚合物包括烯烃高聚物和乙烯低聚物,所述烯烃高聚物的分子量为2000~500000g·mol-1,分子量分布指数(Mw/Mn)为1.4~3.0,熔点(Tm)为50~130℃;所述乙烯低聚物主要为丁烯和己烯。
有益效果:
本发明所设计的配合物中有孤立的氧原子,当不同助催化剂与氧原子相作用时,形成不同结构的两性离子配合物,有效控制中心金属的路易斯酸性,从而能够有效地对烯烃聚合产物的分子量及链结构进行调控。本发明提供的镍系催化剂可以在无助催化剂条件下表现出较高的催化活性,也可以在不同助催化剂条件下合成出乙烯高聚物或高选择性合成乙烯低聚物,并且对环烯烃也具有很高的聚合活性,能够得到高分子量的环烯烃均聚物和环烯烃/乙烯共聚物,该催化体系亦可用于乙烯或环烯烃与极性单体的共聚,且具有较高分子量、较高活性和较高的插入率。
附图说明:
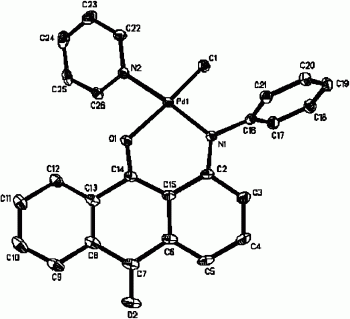
图1为实施例1的苯胺蒽醌类过渡金属配合物晶体结构图;
图2为实施例2的苯胺蒽醌类过渡金属配合物晶体结构图;
图3为实施例4的苯胺蒽醌类过渡金属配合物晶体结构图;
图4为实施例6的苯胺蒽醌类过渡金属配合物晶体结构图。
其中,C为碳原子,N为氮原子,O为氧原子,P为磷原子,Ni为镍原子,Pd为钯原子。
具体实施方式
下面结合具体实施方式,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。此外应理解,在阅读了本发明讲授的内容之后,本领域技术人员可对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。
下述实施例中苯胺蒽醌后过渡金属配合物的合成路线图:
实施例1
一种苯胺蒽醌类过渡金属配合物的制备方法,包括以下步骤:
(1)将摩尔比为1:1.5的1-氯蒽醌与苯胺溶解于甲苯中,然后加入催化作用体系,催化作用体系为双(二亚芐基丙酮)钯、大位阻膦基二茂铁和Cs2CO3,其中,双(二亚芐基丙酮)钯为1-氯蒽醌的2%,双(二亚芐基丙酮)钯与大位阻膦基二茂铁的摩尔比为1:1.2,Cs2CO3和1-氯蒽醌的摩尔比为1:1,在催化作用下,在90℃氮气条件下回流36h,冷却至室温,将溶剂甲苯真空抽干保留固体,将剩余的固体溶于二氯甲烷,用水洗涤5次,分液漏斗分离有机相,加入过量无水硫酸镁干燥,过滤保留滤液,真空浓缩二氯甲烷溶剂,然后加入正己烷,析出大量红色固体。减压过滤得到1-(苯胺基)蒽醌配体,再用正己烷20mL洗涤三次,真空干燥既得红色产物,产率95%,1H NMR(CDCl3,400MHz):11.38(s,1H,-NH),8.27-8.34(m,2H,Ar-H),7.71-7.82(m,3H,Ar-H),7.51(m,2H,Ar-H),7.42(m,2H,NH-Ar-H),7.34(dd,2H,NH-Ar-H),7.22(m,1H,NH-Ar-H)。
(2)将提纯后的1-(苯胺基)蒽醌配体溶解于四氢呋喃中,在60℃下:
a)加入氢化钾反应,反应温度为60℃,反应时间为1h,氢化钾与1-(苯胺基)蒽醌配体的摩尔比为1.5:1,拔掉氨基氢形成配体盐化合物;
b)然后加入氯(环辛二烯)甲基钯,氯(环辛二烯)甲基钯与1-(苯胺基)蒽醌配体的摩尔比为1:1,氮气保护下在30℃下,反应5h,再向反应体系加入吡啶,其中吡啶与1-(苯胺基)蒽醌配体的摩尔比为1:1,继续反应3h。反应得到蓝色目标配合物,1H NMR(CDCl3,400MHz):8.894(m,2H,Py-H),7.96(t,1H,Py-H),7.73(t,2H,Py-H),-0.02(s,3H,Pd-CH3),即得到苯胺蒽醌类过渡金属配合物,其对应的晶体结构示意图见图1。
制得的苯胺蒽醌类过渡金属配合物,具有以下结构式:
其中,苯胺蒽醌类过渡金属配合物结构中(R1-R5为氢,R6为甲基,R7-R13为氢、M为钯、L为吡啶)。
实施例2
一种苯胺蒽醌类过渡金属配合物的制备方法,包括以下步骤:
(1)将摩尔比为1:1.8的1-氯蒽醌与2,6-二异丙基苯胺溶解于1,4-二氧六烷中,然后加入催化作用体系,催化作用体系为双(二亚芐基丙酮)钯、大位阻膦基二茂铁和Cs2CO3,其中,双(二亚芐基丙酮)钯为1-氯蒽醌的4%,双(二亚芐基丙酮)钯与大位阻膦二茂铁的摩尔比为1:1.5,Cs2CO3和1-氯蒽醌的摩尔比为1.5:1,在催化作用下,110℃氮气条件下回流36h,冷却至室温,将溶剂1,4-二氧六烷真空抽干保留固体,将剩余的固体溶于二氯甲烷,用水洗涤5次,分液漏斗分离有机相,加入过量无水硫酸镁干燥,过滤保留滤液,真空抽干二氯甲烷溶剂,然后加入过量正己烷,有黄色固体析出,减压过滤掉固体,保留滤液。滤液适当浓缩,目标产物经多次低温重结晶得到,为红色晶体,产率53%。1H NMR(CDCl3,400MHz):10.95(s,1H,-NH),8.28-8.37(dd,2H,Ar-H),7.74-7.83(m,2H,Ar-H),7.64(d,1H,Ar-H),7.39(m,2H,NH-Ar-H),7.29(s,1H,Ar-H),7.27(s,1H,Ar-H),6.61(d,1H,NH-Ar-H),3.09(m,2H,-CH),1.11-1.20(dd,12H,-CH3)。
(2)将提纯后的1-(2,6-二异丙基苯胺基)蒽醌配体溶解于四氢呋喃中,在20℃下:
a)加入氢化钾反应,反应温度为20℃,反应时间为3h,氢化钾与1-(2,6-二异丙基苯胺基)蒽醌配体的摩尔比为1.1:1,拔掉氨基氢形成配体盐化合物;
(3)b)然后加入氯(环辛二烯)甲基钯,氯(环辛二烯)甲基钯与1-(2,6-二异丙基苯胺基)蒽醌配体的摩尔比为1:1,氮气保护下在0℃下,反应8h,再向反应体系加入吡啶,其中吡啶与1-(2,6-二异丙基苯胺基)蒽醌配体的摩尔比为3:1,继续反应3h,即得到蓝色的苯胺蒽醌类过渡金属配合物,1H NMR(CDCl3,400MHz):7.26-8.15(m,36H,Ar-H),6.13-7.09(m,16H,Ar-H),3.59(m,4H,-CH),0.95-1.07(dd,24H,-CH3),其晶体结构示意图见图2。
制得的苯胺蒽醌类过渡金属配合物,具有以下结构式:
其中,苯胺蒽醌类过渡金属配合物结构中(R1和R2为异丙基,R3-R5为氢,R6为甲基,R7-R13为氢、M为钯、L为吡啶)。
实施例3
一种苯胺蒽醌类过渡金属配合物的制备方法,包括以下步骤:
(1)将摩尔比为1:0.8的1-氯蒽醌与2,6-二甲氧基苯胺溶解于1,4-二氧六烷中,然后加入催化作用体系,催化作用体系为双(二亚芐基丙酮)钯、大位阻膦基二茂铁和膦磷基二茂铁的摩尔比为1:2,Cs2CO3和1-氯蒽醌的摩尔比为2:1,在催化作用下,130℃氮气条件下回流12h,冷却至室温,将溶剂1,4-二氧六烷真空抽干保留固体,将剩余的固体溶于二氯甲烷,用水洗涤5次,分液漏斗分离有机相,加入过量无水硫酸镁干燥,过滤保留滤液,真空浓缩二氯甲烷溶剂,然后加入正己烷,析出大量红色固体。减压过滤得到固体,用正20mL己烷洗涤一次,再用20mL乙醚洗涤两次,真空干燥既得红色产物,产率91%。1H NMR(CDCl3,400MHz):10.83(s,1H,-NH),8.26-8.35(dd,2H,Ar-H),7.67-7.79(m,3H,Ar-H),7.42(t,1H,Ar-H),7.23(d,1H,Ar-H),6.27(d,1H,NH-Ar-H),6.69(d,2H,NH-Ar-H),3.82(s,6H,-CH3)。
(2)将提纯后的1-(2,6-二甲氧基苯胺基)蒽醌配体溶解于四氢呋喃中,在0℃下:
a)加入氢化钾反应,反应温度为0℃,反应时间为10h,氢化钾与1-(2,6-二甲氧基苯胺基)蒽醌配体的摩尔比为1.3:1,拔掉氨基氢形成配体盐化合物;
b)然后加入氯(环辛二烯)甲基钯,氯(环辛二烯)甲基钯与1-(2,6-二甲氧基苯胺基)蒽醌配体的摩尔比为为1:1,氮气保护下在30℃下,反应10h,再向反应体系加入吡啶,其中吡啶与1-(2,6-二甲氧基苯胺基)蒽醌配体的摩尔比为5:1,继续反应3h,即得到蓝色的苯胺蒽醌类过渡金属配合物,1H NMR(CD2Cl2,400MHz):8.81(m,2H,Py-H),8.17(m,1H,Ar-H),8.03(m,1H,Ar-H),7.89(t,1H,Py-H),7.63(m,2H,Py-H),7.46(m,2H,Ar-H),7.37(dd,1H,Ar-H),7.12(t,1H,Ar-H),6.95-6.99(m,1H,Ar-H),6.72(d,2H,Ar-H),6.66(d,1H,Ar-H),3.83(s,6H,-CH3),-0.16(s,3H,Pd-CH3)。
制得的苯胺蒽醌类过渡金属配合物,具有以下结构式:
其中,苯胺蒽醌类过渡金属配合物结构中(R1和R2为甲氧基,R3-R5为氢,R6为甲基,R7-R13为氢、M为钯、L为吡啶)。
实施例4
一种苯胺蒽醌类过渡金属配合物的制备方法,包括以下步骤:
(1)将摩尔比为1:1.8的1-氯蒽醌与2,6-二异丙基苯胺溶解于1,4-二氧六烷中,然后加入催化作用体系,催化作用体系为双(二亚芐基丙酮)钯、大位膦基二茂铁和Cs2CO3,其中,双(二亚芐基丙酮)钯为1-氯蒽醌的4%,大位阻膦基二茂铁的摩尔比为1:1.5,Cs2CO3和1-氯蒽醌的摩尔比为1.5:1,在催化作用下,110℃氮气条件下回流24h,冷却至室温,将溶剂1,4-二氧六烷真空抽干保留固体,将剩余的固体溶于二氯甲烷,用水洗涤5次,分液漏斗分离有机相,加入过量无水硫酸镁干燥,过滤保留滤液,真空抽干二氯甲烷溶剂,然后加入过量正己烷,有黄色固体析出,减压过滤掉固体,保留滤液。滤液适当浓缩,目标产物经多次低温重结晶得到,为红色晶体,产率53%。1H NMR(CDCl3,400MHz):10.95(s,1H,-NH),8.28-8.37(dd,2H,Ar-H),7.74-7.83(m,2H,Ar-H),7.64(d,1H,Ar-H),7.39(m,2H,NH-Ar-H),7.29(s,1H,Ar-H),7.27(s,1H,Ar-H),6.61(d,1H,NH-Ar-H),3.09(m,2H,-CH),1.11-1.20(dd,12H,-CH3)。
(2)将提纯后的1-(2,6-二异丙基苯胺基)蒽醌配体溶解于四氢呋喃中,在20℃下:
a)加入氢化钾反应,反应温度为20℃,反应时间为3h,氢化钾与1-(2,6-二异丙基苯胺基)蒽醌配体的摩尔比为1:1,拔掉氨基氢形成配体盐化合物;
b)然后加入反式-氯-(苯基)双(三苯基磷)镍(Ⅱ),反式-氯-(苯基)双(三苯基磷)镍(Ⅱ)与1-(2,6-二异丙基苯胺基)的摩尔比为1:1.5,氮气保护下在30℃下,反应12h,即得到褐色的苯胺蒽醌类过渡金属配合物,1H NMR(CDCl3,400MHz):8.12(d,1H,Ar-H),7.24-7.48(m,17H,Ar-H),6.94-7.04(m,3H,Ar-H),6.88(d,2H,Ar-H),6.61(d,1H,Ar-H),6.48(d,2H,Ar-H),6.40(d,1H,Ar-H),6.28(t,1H,Ar-H),6.11(t,2H,Ar-H),3.57(m,2H,-CH),0.94-1.04(dd,12H,CH3),其对应的晶体结构示意图见图3。
制得的苯胺蒽醌类过渡金属配合物,具有以下结构式:
其中,苯胺蒽醌类过渡金属配合物结构中(R1和R2为异丙基,R3-R5为氢,R6为苯基,R7-R13为氢,M为镍,L为三苯基膦)。
实施例5
一种苯胺蒽醌类过渡金属配合物的制备方法,包括以下步骤:
(1)将摩尔比为1:1的1-氯蒽醌与2,6-二甲氧基苯胺溶解于1,4-二氧六烷中,然后加入催化作用体系,催化作用体系为双(二亚芐基丙酮)钯、大位阻膦基二茂铁和Cs2CO3,其中,双(二亚芐基丙酮)钯为1-氯蒽醌的6%,双(二亚芐基丙酮)钯与大位阻膦基二茂铁的摩尔比为1:2,Cs2CO3和1-氯蒽醌的摩尔比为2:1,在催化作用下,130℃氮气条件下回流12h,冷却至室温,将溶剂1,4-二氧六烷真空抽干保留固体,将剩余的固体溶于二氯甲烷,用水洗涤5次,分液漏斗分离有机相,加入过量无水硫酸镁干燥,过滤保留滤液,真空浓缩二氯甲烷溶剂,然后加入正己烷,析出大量红色固体。减压过滤得到固体,用正20mL己烷洗涤一次,再用20mL乙醚洗涤两次,真空干燥既得红色产物,产率91%。1H NMR(CDCl3,400MHz):10.83(s,1H,-NH),8.26-8.35(dd,2H,Ar-H),7.67-7.79(m,3H,Ar-H),7.42(t,1H,Ar-H),7.23(d,1H,Ar-H),6.27(d,1H,NH-Ar-H),6.69(d,2H,NH-Ar-H),3.82(s,6H,-CH3)。
(2)将提纯后的1-(2,6-二甲氧基苯胺基)蒽醌配体溶解于四氢呋喃中,在0℃下:
a)加入氢化钾反应,反应温度为0℃,反应时间为10h,氢化钾与1-(2,6-二甲氧基苯胺基)蒽醌配体的摩尔比为1.3:1,拔掉氨基氢形成配体盐化合物;
b)然后加入反式-氯-(苯基)双(三苯基磷)镍(Ⅱ),反式-氯-(苯基)双(三苯基磷)镍(Ⅱ)与1-(2,6-二甲氧基苯胺基)蒽醌配体的摩尔比为1:0.9,氮气保护下在30℃下,反应20h,即得到褐色1-(2,6-二甲氧基苯胺基)蒽醌配体过渡金属配合物。1H NMR(CDCl3,400MHz):8.09(d,1H,Ar-H),7.26-7.59(m,17H,Ar-H),6.91-7.05(m,3H,Ar-H),6.80(d,2H,Ar-H),6.59(d,1H,Ar-H),6.46(d,2H,Ar-H),6.38(d,1H,Ar-H),6.21(t,1H,Ar-H),6.09(t,2H,Ar-H),3.67(m,2H,O-CH3)。
制得的苯胺蒽醌类过渡金属配合物,具有以下结构式:
其中,苯胺蒽醌类过渡金属配合物结构中(R1和R2为甲氧基,R3-R5为氢,R6为苯基,R7-R13为氢,M为镍,L为三苯基膦)。
实施例6
一种苯胺蒽醌类过渡金属配合物的制备方法,包括以下步骤:
(1)将摩尔比为1:3的1,5–二氯蒽醌与2,6-二异丙基苯胺溶解于1,4-二氧六烷中,然后加入催化作用体系,催化作用体系为双(二亚芐基丙酮)钯、大位阻膦基二茂铁和Cs2CO3,其中,双(二亚芐基丙酮)钯为1,5–二氯蒽醌的8%,双(二亚芐基丙酮)钯与大位阻膦基二茂铁的摩尔比为1:1.5,Cs2CO3和1,5–二氯蒽醌的摩尔比为3:1,在催化作用下,110℃氮气条件下回流30h,冷却至室温,将溶剂1,4-二氧六烷真空抽干保留固体,将剩余的固体溶于二氯甲烷,用水洗涤5次,分液漏斗分离有机相,加入过量无水硫酸镁干燥,过滤保留滤液,真空浓缩二氯甲烷溶剂,然后加入正己烷,析出大量红色固体。减压过滤得到固体,用正20mL己烷洗涤一次,再用20mL乙醚洗涤两次,真空干燥既得红色产物,产率91%。1H NMR(CDCl3,400MHz):10.97(s,2H,-NH),7.66(d,2H,Ar-H),7.39(m,2H,Ar-H),7.28(d,4H,NH-Ar-H),6.53(d,2H,NH-Ar-H),3.10(m,4H,-CH),1.11-1.19(dd,24H,-CH3)。
(2)将提纯后的1,5-双(2,6-二异丙基苯胺基)蒽醌配体溶解于四氢呋喃中,在20℃下:
a)加入氢化钾反应,反应温度为50℃,反应时间为5h,氢化钾与1,5-双(2,6-二异丙基苯胺基)蒽醌配体的摩尔比为2.2:1,拔掉氨基氢形成配体盐化合物;
b)然后加入反式-氯-(苯基)双(三苯基磷)镍(Ⅱ),反式-氯-(苯基)双(三苯基磷)镍(Ⅱ)与1-(2,6-二异丙基苯胺基)蒽醌配体的摩尔比为1:0.5,氮气保护下在60℃下,反应15h,即得到褐色的苯胺蒽醌类过渡金属配合物,1H NMR(CDCl3,400MHz):7.26-8.15(m,36H,Ar-H),6.13-7.09(m,16H,Ar-H),3.59(m,4H,-CH),0.95-1.07(dd,24H,-CH3),其对应的晶体结构示意图见图4。
制得的苯胺蒽醌类过渡金属配合物,具有以下结构式:
其中,苯胺蒽醌类过渡金属配合物结构中(R1和R2为异丙基,R3-R5为氢,R6为苯基,R7-R13为氢、M为镍、L为三苯基膦)。
实施例7
苯胺蒽醌后过渡金属配合物在催化烯烃单体的应用:高压乙烯聚合使用带有机械搅拌和温度控制装置的100mL的高压釜,将高压釜抽真空并加热到100℃,加热时间持续1h,然后将聚合釜冷却至预先设置聚合温度(40℃),期间用氮气换气3次,然后依次加入甲苯和苯胺蒽醌后过渡金属配合物甲苯溶液(采用实施例1中制得的产品),其中,苯胺蒽醌后过渡金属配合物的浓度为0.33mmol/L,然后将高压釜封闭,通入乙烯,并保持乙烯压力恒定(2.0MPa),在聚合反应时间达到预先设置的反应时间(60min)后,将反应釜泄压至常压,将反应溶液倒入500mL烧杯中,加入盐酸乙醇溶液终止,洗涤过滤后真空烘箱60℃干燥至衡重,根据聚合物的产量计算聚合活性为0.12×105g·mol-1·h-1,所得聚合物数均分子量Mn=5.66×103g·mol-1,Mw/Mn=1.72。
实施例8
苯胺蒽醌后过渡金属配合物在催化烯烃单体的应用:高压乙烯聚合使用带有机械搅拌和温度控制装置的100mL的高压釜,将高压釜抽真空并加热到100℃,加热时间持续1h,然后将聚合釜冷却至预先设置聚合温度(40℃),期间用氮气换气5次。然后依次加入甲苯和苯胺蒽醌后过渡金属配合物(采用实施例2中制得的产品),其中,苯胺蒽醌后过渡金属配合物的浓度为0.33mmol/L,然后将高压釜封闭,通入乙烯,并保持乙烯压力恒定(1.5MPa),在聚合反应时间达到预先设置的反应时间(60min)后,将反应釜泄压至常压,将反应溶液倒入500mL烧杯中,加入盐酸乙醇溶液终止,洗涤过滤后真空烘箱60℃干燥至衡重,根据聚合物的产量计算聚合活性为0.39×105g·mol-1·h-1,所得聚合物数均分子量Mn=6.65×103g·mol-1,Mw/Mn=1.68。
实施例9
苯胺蒽醌后过渡金属配合物在催化烯烃单体的应用:高压乙烯聚合使用带有机械搅拌和温度控制装置的100mL的高压釜,将高压釜抽真空并加热到100℃,加热时间持续1h,然后将聚合釜冷却至预先设置聚合温度(20℃),期间用氮气换气4次。然后依次加入甲苯和苯胺蒽醌后过渡金属配合物(采用实施例4中制得的产品),其中,苯胺蒽醌后过渡金属配合物的浓度为0.33mmol/L,然后将高压釜封闭,通入乙烯,并保持乙烯压力恒定(3.0MPa),在聚合反应时间达到预先设置的反应时间(30min)后,将反应釜泄压至常压,将反应溶液倒入500mL烧杯中,加入盐酸乙醇溶液终止,洗涤过滤后真空烘箱60℃干燥至衡重,根据聚合物的产量计算聚合活性为0.2×105g·mol-1·h-1,所得聚合物数均分子量Mn=4.03×104g·mol-1,Mw/Mn=1.64,Tm=124℃,支化度为10C/1000C。
实施例10
苯胺蒽醌后过渡金属配合物在催化烯烃单体的应用:高压乙烯聚合使用带有机械搅拌和温度控制装置的100mL的高压釜,将高压釜抽真空并加热到100℃,加热时间持续1h,然后将聚合釜冷却至预先设置聚合温度(40℃),期间用氮气换气5次。然后依次加入甲苯和苯胺蒽醌后过渡金属配合物(采用实施例4中制得的产品),其中,苯胺蒽醌后过渡金属配合物的浓度为0.33mmol/L,然后将高压釜封闭,通入乙烯,并保持乙烯压力恒定(3.0MPa),在聚合反应时间达到预先设置的反应时间(60min)后,将反应釜泄压至常压,将反应溶液倒入500mL烧杯中,加入盐酸乙醇溶液终止,洗涤过滤后真空烘箱60℃干燥至衡重,根据聚合物的产量计算聚合活性为1.01×105g·mol-1·h-1,所得聚合物数均分子量Mn=3.27×104g·mol-1,Mw/Mn=1.69,Tm=114℃,支化度为27C/1000C。
实施例11
苯胺蒽醌后过渡金属配合物在催化烯烃单体的应用:高压乙烯聚合使用带有机械搅拌和温度控制装置的100mL的高压釜,将高压釜抽真空并加热到100℃,加热时间持续1h,然后将聚合釜冷却至预先设置聚合温度(60℃),期间用氮气换气5次。然后依次加入甲苯和苯胺蒽醌后过渡金属配合物(采用实施例4中制得的产品),其中,苯胺蒽醌后过渡金属配合物的浓度为0.33mmol/L,然后将高压釜封闭,通入乙烯,并保持乙烯压力恒定(3.0MPa),在聚合反应时间达到预先设置的反应时间(30min)后,将反应釜泄压至常压,将反应溶液倒入500mL烧杯中,加入盐酸乙醇溶液终止,洗涤过滤后真空烘箱60℃干燥至衡重,根据聚合物的产量计算聚合活性为8.24×105g·mol-1·h-1,所得聚合物数均分子量Mn=7.81×103g·mol-1,Mw/Mn=1.67,Tm=93℃,支化度为49C/1000C。
实施例12
苯胺蒽醌后过渡金属配合物在催化烯烃单体的应用:高压乙烯聚合使用带有机械搅拌和温度控制装置的100mL的高压釜,将高压釜抽真空并加热到100℃,加热时间持续1h,然后将聚合釜冷却至预先设置聚合温度(40℃),期间用氮气换气3~5次。然后依次加入甲苯、苯胺蒽醌后过渡金属配合物(采用实施例4中制得的产品)和Ni(COD)2甲苯溶液,其中,苯胺蒽醌后过渡金属配合物的浓度为0.33mmol/L,Ni(COD)2甲苯溶液的浓度为0.8mol/L,然后将高压釜封闭,通入乙烯,并保持乙烯压力恒定(1.5MPa),在聚合反应时间达到预先设置的反应时间(30min)后,将反应釜泄压至常压,将反应溶液倒入500mL烧杯中,加入盐酸乙醇溶液终止,洗涤过滤后真空烘箱60℃干燥至衡重,根据聚合物的产量计算聚合活性为3.14×105g·mol-1·h-1,所得聚合物数均分子量Mn=2.80×104g·mol-1,Mw/Mn=1.77,Tm=113℃。
实施例13
苯胺蒽醌后过渡金属配合物在催化烯烃单体的应用:高压乙烯聚合使用带有机械搅拌和温度控制装置的100mL的高压釜,将高压釜抽真空并加热到100℃,加热时间持续1h,然后将聚合釜冷却至预先设置聚合温度(60℃),期间用氮气换气4次。然后依次加入甲苯、苯胺蒽醌后过渡金属配合物(采用实施例4中制得的产品)和Ni(COD)2甲苯溶液,其中,苯胺蒽醌后过渡金属配合物的浓度为0.33mmol/L,Ni(COD)2甲苯溶液的浓度为0.8mol/L,然后将高压釜封闭,通入乙烯,并保持乙烯压力恒定(1.5MPa),在聚合反应时间达到预先设置的反应时间(30min)后,将反应釜泄压至常压,将反应溶液倒入500mL烧杯中,加入盐酸乙醇溶液终止,洗涤过滤后真空烘箱60℃干燥至衡重。得到聚合物3.97g,根据聚合物的产量计算聚合活性为7.94×105g·mol-1·h-1,所得聚合物数均分子量Mn=7.64×103g·mol-1,Mw/Mn=1.60,Tm=89℃,支化度为58C/1000C。
实施例14
苯胺蒽醌后过渡金属配合物在催化烯烃单体的应用:高压乙烯聚合使用带有机械搅拌和温度控制装置的100mL的高压釜,将高压釜抽真空并加热到100℃,加热时间持续1h,然后将聚合釜冷却至预先设置聚合温度(60℃),期间用氮气换气3~5次。然后依次加入甲苯、苯胺蒽醌后过渡金属配合物(采用实施例4中制得的产品)和Ni(COD)2甲苯溶液,其中,苯胺蒽醌后过渡金属配合物的浓度为0.33mmol/L,Ni(COD)2甲苯溶液的浓度为0.8mol/L,然后将高压釜封闭,通入乙烯,并保持乙烯压力恒定(3.0MPa),在聚合反应时间达到预先设置的反应时间(10min)后,将反应釜泄压至常压,将反应溶液倒入500mL烧杯中,加入盐酸乙醇溶液终止,洗涤过滤后真空烘箱60℃干燥至衡重。得到聚合物4.66g,根据聚合物的产量计算聚合活性为2.80×106g·mol-1·h-1,所得聚合物数均分子量Mn=9.51×103g·mol-1,Mw/Mn=1.64,Tm=95℃。
实施例15
苯胺蒽醌后过渡金属配合物在催化烯烃单体的应用:高压乙烯聚合使用带有机械搅拌和温度控制装置的100mL的高压釜,将高压釜抽真空并加热到100℃,加热时间持续1h,然后将聚合釜冷却至预先设置聚合温度(60℃),期间用氮气换气3~5次。然后依次加入加入甲苯和苯胺蒽醌后过渡金属配合物(采用实施例6中制得的产品),其中,苯胺蒽醌后过渡金属配合物的浓度为0.083mmol/L(采用实施例10中制得的产品),然后将高压釜封闭,通入乙烯,并保持乙烯压力恒定(3.0MPa),在聚合反应时间达到预先设置的反应时间(60min)后,将反应釜泄压至常压,将反应溶液倒入500mL烧杯中,加入盐酸乙醇溶液终止,洗涤过滤后真空烘箱60℃干燥至衡重,根据聚合物的产量计算聚合活性为5.28×105g·mol-1·h-1,所得聚合物数均分子量Mn=8.68×103g·mol-1,Mw/Mn=1.71,Tm=93℃。
实施例16
苯胺蒽醌后过渡金属配合物在催化烯烃单体的应用:高压乙烯聚合使用带有机械搅拌和温度控制装置的100mL的高压釜,将高压釜抽真空并加热到100℃,加热时间持续1h,然后将聚合釜冷却至预先设置聚合温度(40℃),期间用氮气换气3~5次。然后依次加入甲苯、苯胺蒽醌后过渡金属配合物(采用实施例4中制得的产品)和DMMAO的甲苯溶液,其中,苯胺蒽醌后过渡金属配合物的浓度为0.33mmol/L,DMMAO甲苯溶液的浓度为0.17mol/L,然后将高压釜封闭,通入乙烯,并保持乙烯压力恒定(1.5MPa),在聚合反应时间达到预先设置的反应时间(10min)后,将反应釜泄压至常压终止反应。根据气象色谱-质谱联用仪分析丁烯和己烯选择性为67.5%,聚合活性为1.37×106g·mol-1·h-1。
实施例17
苯胺蒽醌后过渡金属配合物在催化烯烃单体的应用:高压乙烯聚合使用带有机械搅拌和温度控制装置的100mL的高压釜,将高压釜抽真空并加热到100℃,加热时间持续1h,然后将聚合釜冷却至预先设置聚合温度(40℃),期间用氮气换气3~5次。然后依次加入甲苯、苯胺蒽醌后过渡金属配合物(采用实施例4中制得的产品)和Et2AlCl的(2mmol/mL正己烷溶液),其中,苯胺蒽醌后过渡金属配合物的浓度为0.33mmol/L,Et2AlCl正己烷溶液的浓度为10mmol/L,然后将高压釜封闭,通入乙烯,并保持乙烯压力恒定(1.5MPa),在聚合反应时间达到预先设置的反应时间(10min)后,将反应釜泄压至常压终止反应。根据气象色谱-质谱联用仪分析2-丁烯选择性为75%,根据氢核磁谱计算聚合活性为6.9×106g·mol-1·h-1。
实施例18
苯胺蒽醌后过渡金属配合物在催化烯烃单体的应用:高压乙烯聚合使用带有机械搅拌和温度控制装置的100mL的高压釜,将高压釜抽真空并加热到100℃,加热时间持续1h,然后将聚合釜冷却至预先设置聚合温度(40℃),期间用氮气换气5次。然后依次加入甲苯、苯胺蒽醌后过渡金属配合物(采用实施例4中制得的产品)和Et2AlCl的(1.6mmol/mL正己烷溶液),其中,苯胺蒽醌后过渡金属配合物的浓度为0.33mmol/L,EtAlCl2正己烷溶液的浓度为10mmol/L,然后将高压釜封闭,通入乙烯,并保持乙烯压力恒定(1.5MPa),在聚合反应时间达到预先设置的反应时间(10min)后,将反应釜泄压至常压终止反应。根据气象色谱-质谱联用仪分析2-丁烯和3-己烯选择性为85.3%,根据氢核磁谱计算聚合活性为1.37×107g·mol-1·h-1。
对比例1
根据文献Journal of Organometallic Chemistry 694(2009)1254–1258.报道,在MAO作为助催化剂的条件下,聚合活性随温度升高呈下降趋势,在30℃达到最高活性。具体步骤为在氮气氛围下,反应釜内加入40mL甲苯,MAO(Al/Ni=200)助催化剂和2.5μmol酮烯胺类中性镍催化剂,通入乙烯,30℃反应30min得到乙烯齐聚物,聚合活性为2.81×106g·mol-1·h-1,对比例1与实施例18对比,实施例18中Al/Ni比仅有30,助催化剂用量更少,但乙烯齐聚物的活性高达为1.37×107g·mol-1·h-1,比对比例高出一个数量级。
实施例19
苯胺蒽醌后过渡金属配合物在催化烯烃单体的应用:常压降冰片烯聚合使用50mL单口带有磁力搅拌和温度控制的圆底烧瓶。将烧瓶抽真空持续30min,然后将温度调至预先设置聚合温度(20℃),期间用氮气换气4次,然后依次加入甲苯、苯胺蒽醌后过渡金属配合物(采用实施例5中制得的产品)、降冰片烯(7mmol/mL甲苯溶液)和三(五氟苯基)硼烷的甲苯溶液,其中,苯胺蒽醌后过渡金属配合物的浓度为0.1mmol/L,降冰片烯的浓度为1.05mol/L,三(五氟苯基)硼烷的甲苯溶液的浓度为0.25mmol/L,然后在聚合反应时间达到预先设置的反应时间(5min)后,将反应溶液倒入500mL烧杯中,加入盐酸乙醇溶液终止,洗涤过滤后真空烘箱60℃干燥至衡重,根据聚合物的产量计算聚合产率为78%,所得聚合物数均分子量Mn=2.43×104g·mol-1,Mw/Mn=2.50。
实施例20
苯胺蒽醌后过渡金属配合物在催化烯烃单体的应用:高压乙烯-降冰片烯共聚使用带有机械搅拌和温度控制装置的100mL的高压釜,将高压釜抽真空并加热到100℃,加热时间持续1h,然后将聚合釜冷却至预先设置聚合温度(10℃),期间用氮气换气3次,然后依次加入甲苯、苯胺蒽醌后过渡金属配合物(采用实施例4中制得的产品)、降冰片烯(7mmol/mL甲苯溶液)和MMAO(2.43mmol/mL甲苯溶液),其中,苯胺蒽醌后过渡金属配合物的浓度为0.33mmol/L,降冰片烯的浓度为1.167mol/L,MMAO溶液的浓度为0.167mol/L,然后将高压釜封闭,通入乙烯,并保持乙烯压力恒定(1.5MPa),在聚合反应时间达到预先设置的反应时间(10min)后,将反应釜泄压至常压,将反应溶液倒入500mL烧杯中,加入盐酸乙醇溶液终止,洗涤过滤后真空烘箱60℃干燥至衡重。得到聚合物0.29g,根据聚合物的产量计算聚合活性为1.74×105g·mol-1·h-1,所得聚合物数均分子量Mn=7.54×104g·mol-1,Mw/Mn=1.59,玻璃化转变温度Tg=171℃。
对比例2
根据文献Polym.Chem.,2015,6,2669–2676.报道,乙烯-降冰片烯共聚,为结晶性共聚物。反应釜内加入48mL甲苯,2mLCH2Cl2溶解10μmol催化剂,10.6mmol降冰片烯,室温、0.9MPa、反应2h得到乙烯-降冰片烯共聚物,最高活性为1.75×105g·mol-1·h-1,但插入率小于0.5%;对比例2与实施例20对比,实施例20中的共聚活性为1.74×105g·mol-1·h-1,聚合物为非晶性共聚物,且玻璃化转变温度高,插入率高于50%,虽然对比例2中活性与实施例20聚合活性相对持平,但插入率却小于0.5%,比实施例20低很多。
对比例3
根据文献Polym.Chem.,2015,6,2669–2676.报道,乙烯-降冰片烯共聚,为结晶性共聚物。当反应釜内加入48mL甲苯,2mLCH2Cl2溶解10μmol催化剂,10.6mmol降冰片烯,50℃、0.9MPa,反应2h得到乙烯-降冰片烯共聚物,得到的共聚物中降冰片烯插入率为达到最高10.1%,但活性下降到了0.5×105g·mol-1·h-1。对比例3与实施例20对比,实施例20中的共聚活性为1.74×105g·mol-1·h-1,聚合物为非晶性共聚物,且玻璃化转变温度高,插入率高于50%,对比例3插入率达到10.1%时,活性降低了很多,比实施例20低了一个数量级,可见实施例20既具有较高的聚合活性又具有较高的插入率。
实施例21
苯胺蒽醌后过渡金属配合物在催化烯烃单体的应用:极性降冰片烯单体(5-降冰片烯-2-甲醛)均聚使用50mL单口带有磁力搅拌和温度控制的圆底烧瓶。将烧瓶抽真空持续30min,然后将温度调至预先设置聚合温度(30℃),期间用氮气换气3~5次。然后依次加入甲苯、MMAO(2.43mmol/mL甲苯溶液)、5-降冰片烯-2-甲醛溶液(采用实施例3中制得的产品)和苯胺蒽醌后过渡金属配合物的甲苯溶液,其中,苯胺蒽醌后过渡金属配合物的浓度为0.5mmol/L,5-降冰片烯-2-甲醛的浓度为1.67mol/L,MMAO溶液的浓度为1mol/L,然后在聚合反应时间达到预先设置的反应时间(30min)后,将反应溶液倒入500mL烧杯中,加入盐酸乙醇溶液终止,洗涤过滤后真空烘箱60℃干燥至衡重。得到聚合物1.79g,根据聚合物的产量计算聚合产率为87.9%。
实施例22
苯胺蒽醌后过渡金属配合物在催化烯烃单体的应用:高压乙烯-乙酸5-己烯基酯共聚使用带有机械搅拌和温度控制装置的100mL的高压釜,将高压釜抽真空并加热到100℃,加热时间持续1h,然后将聚合釜冷却至预先设置聚合温度(40℃),期间用氮气换气3次。然后依次加入甲苯、苯胺蒽醌后过渡金属配合物(采用实施例4中制得的产品)、乙酸5-己烯基酯的溶液和DMMAO(Al/Ni=500),其中,苯胺蒽醌后过渡金属配合物的浓度为0.33mmol/L,乙酸5-己烯基酯的浓度为0.62mol/L,dMMAO溶液的浓度为0.25mol/L,然后将高压釜封闭,通入乙烯,并保持乙烯压力恒定(1.0MPa),在聚合反应时间达到预先设置的反应时间(60min)后,将反应釜泄压至常压,将反应溶液倒入500mL烧杯中,加入盐酸乙醇溶液终止,洗涤过滤后真空烘箱60℃干燥至衡重,根据聚合物的产量计算聚合活性为1.17×105g·mol-1·h-1,所得聚合物数均分子量Mn=9.05×103g·mol-1,Mw/Mn=1.87,Tm=95℃,通过氢核磁计算乙酸5-己烯基酯插入率为0.45%。
对比例4
根据文献J.AM.CHEM.SOC.2008,130,17636–17637.报道,在20μmol催化剂、dMMAO为助催化剂、25℃条件下,聚合活性为0.556~0.78×105g·mol-1·h-1,聚合活性随着乙酸5-己烯基酯共单体投料量的摩尔比增加而明显下降。具体步骤为在氮气氛围下,将250mL甲苯加入反应瓶,保持温度为25℃,通入乙烯,10min后依次加入乙酸5-己烯基酯(共单体投料量为配合物的262.5倍)、DMMAO(5mmol)助催化剂、20μmol催化剂、反应10min,盐酸乙醇溶液终止反应得到聚合物,聚合活性仅有0.11×105g·mol-1·h-1,对比例4与实施例22对比,实施例22中共单体含量为配合物的1242倍,但活性是文献报道的共单体投料量为配合物的262.5倍时的10倍有余。
实施例23
苯胺蒽醌后过渡金属配合物在催化烯烃单体的应用:高压乙烯-5-降冰片烯-2-羧酸甲酯共聚使用带有机械搅拌和温度控制装置的100mL的高压釜,将高压釜抽真空并加热到100℃,加热时间持续1h,然后将聚合釜冷却至预先设置聚合温度(40℃),期间用氮气换气3~5次。然后依次加入甲苯、苯胺蒽醌后过渡金属配合物(采用实施例4中制得的产品)、5-降冰片烯-2-羧酸甲酯的溶液和MMAO(2.43mmol/mL甲苯溶液),其中,苯胺蒽醌后过渡金属配合物的浓度为0.33mmol/L,5-降冰片烯-2-羧酸甲酯的浓度为1.715mol/L,MMAO溶液的浓度为0.25mol/L,然后将高压釜封闭,通入乙烯,并保持乙烯压力恒定(1.0MPa),在聚合反应时间达到预先设置的反应时间(60min)后,将反应釜泄压至常压,将反应溶液倒入500mL烧杯中,加入盐酸乙醇溶液终止,洗涤过滤后真空烘箱60℃干燥至衡重,根据聚合物的产量计算聚合活性为0.57×105g·mol-1·h-1,所得聚合物数均分子量Mn=1.09×104g·mol-1,Mw/Mn=1.86,Tm=71℃,通过氢核磁计算5-降冰片烯-2-羧酸甲酯插入率为1.22%。
苯胺蒽醌后过渡金属配合物及其制备方法与应用专利购买费用说明
![]()
Q:办理专利转让的流程及所需资料
A:专利权人变更需要办理著录项目变更手续,有代理机构的,变更手续应当由代理机构办理。
1:专利变更应当使用专利局统一制作的“著录项目变更申报书”提出。
2:按规定缴纳著录项目变更手续费。
3:同时提交相关证明文件原件。
4:专利权转移的,变更后的专利权人委托新专利代理机构的,应当提交变更后的全体专利申请人签字或者盖章的委托书。
Q:专利著录项目变更费用如何缴交
A:(1)直接到国家知识产权局受理大厅收费窗口缴纳,(2)通过代办处缴纳,(3)通过邮局或者银行汇款,更多缴纳方式
Q:专利转让变更,多久能出结果
A:著录项目变更请求书递交后,一般1-2个月左右就会收到通知,国家知识产权局会下达《转让手续合格通知书》。
动态评分
0.0