IPC分类号 : C07D519/00,C09K11/06,G01N21/64,C07F5/00
专利摘要
本发明公开用于检测黄嘌呤的荧光探针及其制备方法和应用。取二乙三胺五乙酸、乙酸酐和吡啶,搅拌回流,冷却,减压抽滤,洗涤,干燥;将得到的二乙三胺五乙酸二酐与三乙胺、二甲基甲酰胺、腺嘌呤和/或胞嘧啶搅拌回流,冷却,旋蒸,洗涤,干燥,将得到的中间产物与Tb(NO3)3·6H2O于60℃加热搅拌2h,得到目标产物。将TbШ‑dtpa‑2A,TbШ‑dtpa‑2C和TbШ‑dtpa‑AC分别作为探针结合荧光方法检测黄嘌呤。本发明方法简单新颖,成本低,效率高,且可应用在实际尿样当中。
权利要求
1.用于检测黄嘌呤的荧光探针,其特征在于,制备方法包括如下步骤:
1)将二乙三胺五乙酸、乙酸酐和吡啶混合均匀,在65℃下搅拌回流24h,冷却至室温,减压抽滤,依次用乙酸酐和无水乙醚洗涤,60℃下干燥,得二乙三胺五乙酸二酐;
2)将二乙三胺五乙酸二酐、三乙胺、无水DMF、腺嘌呤和/或胞嘧啶混合均匀,在100℃下搅拌回流24-48h,冷却至室温,旋转蒸发,依次用乙腈和无水乙醚洗涤,减压抽滤,于50℃干燥,得中间产物;
3)取步骤2)获得的中间产物和Tb(NO
2.如权利要求1所述的用于检测黄嘌呤的荧光探针,其特征在于,步骤1)中,按摩尔比,二乙三胺五乙酸:乙酸酐:吡啶=1:4:6。
3.如权利要求1所述的用于检测黄嘌呤的荧光探针,其特征在于,步骤2)中,按摩尔比,二乙三胺五乙酸二酐:三乙胺:腺嘌呤=1:3:2;二乙三胺五乙酸二酐:三乙胺:胞嘧啶=1:3:2;二乙三胺五乙酸二酐:三乙胺:腺嘌呤:胞嘧啶=1:3:1:1。
4.如权利要求1所述的用于检测黄嘌呤的荧光探针,其特征在于,步骤3)中,按摩尔比,中间产物:Tb(NO
5.权利要求1-4任一项所述的用于检测黄嘌呤的荧光探针在定性和定量检测黄嘌呤中的应用。
6.如权利要求5所述的应用,其特征在于,用于检测黄嘌呤的荧光探针在定性和定量检测尿液中黄嘌呤的应用。
7.如权利要求6所述的应用,其特征在于,用于检测黄嘌呤的荧光探针定性检测尿液中黄嘌呤,方法如下:取尿液,加入上述用于检测黄嘌呤的荧光探针的水溶液,充分混合,进行荧光检测,观察荧光光谱的变化。
8.如权利要求6所述的应用,其特征在于,用于检测黄嘌呤的荧光探针定量检测尿液中黄嘌呤,方法如下:取50μL浓度是5.0×10
说明书
技术领域
本发明属于分析化学领域,尤其涉及一种新型荧光探针的合成及其在真实尿液中检测黄嘌呤的应用。
背景技术
黄嘌呤(Xanthine)是一种广泛分布于人和其他生物体的器官和体液中的嘌呤碱,其正常的生理浓度在血清中为0.5~2.5μmol/L,在尿液中为40~160μmol/L。同时,黄嘌呤也是嘌呤代谢的产物,在黄嘌呤氧化酶的作用下转化为尿酸,最终随尿液排出体外。当体内缺乏黄嘌呤氧化酶时,黄嘌呤不能被转换而是在体内积累。导致血液和尿液中黄嘌呤浓度急剧上升,最终发展成黄嘌呤尿症。患有黄嘌呤尿症的病人可能会出现例如疲劳性肌肉疼痛,肌肉痛性痉挛或肌痉挛性尿频等症状。
茶和咖啡中含有大量由黄嘌呤衍生而来的温和的兴奋剂,如咖啡因和茶碱。然而,咖啡中的咖啡因可能诱发冠心病,这会增加高血压患者的血压和心率。此外,食品工业对肉类的新鲜程度要求很高。鱼死亡后,体内的ATP被降解为黄嘌呤,其含量随着储存时间的增加而增加。因此,鱼肉中黄嘌呤的含量也可用于评估鱼肉的新鲜程度。总而言之,黄嘌呤的检测无论是在食品领域还是在医疗领域都非常重要。
通常,用于检测黄嘌呤的方法包括比色法,电化学法,高效液相色谱法和毛细管柱气相色谱法。然而,这些方法复杂,耗时且灵敏度低。而且,在这些方法中,预处理步骤复杂并且仪器设备昂贵。众所周知,荧光探针检测方法因其设备简单,操作简便,分析速度快等优点,被广泛应用于许多领域。尤其是荧光探针法通常灵敏度高,选择性好以及检测限低。因此,开发一种能快速且准确的检测黄嘌呤的荧光探针是非常必要的。
发明内容
本发明的目的之一是设计合成可用于有效检测黄嘌呤的新型荧光探针。
本发明的目的之二是提供一种操作简单,成本低,敏感快速,且选择性好的检测黄嘌呤的方法。
本发明采用的技术方案是:用于检测黄嘌呤的荧光探针,制备方法包括如下步骤:
1)将二乙三胺五乙酸、乙酸酐和吡啶混合均匀,在65℃下搅拌回流24h,冷却至室温,减压抽滤,依次用乙酸酐和无水乙醚洗涤,60℃下干燥,得二乙三胺五乙酸二酐(dtpaa)。优选的,按摩尔比,二乙三胺五乙酸:乙酸酐:吡啶=1:4:6。
2)将二乙三胺五乙酸二酐、三乙胺、无水DMF、腺嘌呤和/或胞嘧啶混合均匀,在100℃下搅拌回流24-48h,冷却至室温,旋转蒸发,依次用乙腈和无水乙醚洗涤,减压抽滤,于50℃干燥,得中间产物。优选的,按摩尔比,二乙三胺五乙酸二酐:三乙胺:腺嘌呤=1:3:2;二乙三胺五乙酸二酐:三乙胺:胞嘧啶=1:3:2;二乙三胺五乙酸二酐:三乙胺:腺嘌呤:胞嘧啶=1:3:1:1。
3)取步骤2)获得的中间产物和Tb(NO3)3·6H2O,加去离子水溶解,于60℃搅拌加热2-3h,冷却,得到用于检测黄嘌呤的荧光探针。优选的,按摩尔比,中间产物:Tb(NO3)3·6H2O=1:1。
上述的用于检测黄嘌呤的荧光探针在定性和定量检测黄嘌呤中的应用。
优选的,用于检测黄嘌呤的荧光探针在定性和定量检测尿液中黄嘌呤的应用。方法如下:
定性检测尿液中黄嘌呤的方法:取尿液,加入上述用于检测黄嘌呤的荧光探针的水溶液,充分混合,进行荧光检测,观察荧光光谱的变化。
定量检测尿液中黄嘌呤的方法:取50μL浓度是5.0×10
本发明的有益效果是:
1.本发明针对被检测物黄嘌呤的结构特点,利用碱基互补配对原则对dtpa进行修饰,设计合成了三种新型的荧光探针。
2.通过本发明的方法,三种探针都可以对黄嘌呤进行灵敏且特异性检测。与其它检测黄嘌呤的方法相比,具有简单,快速,成本低,选择性好,不受外界电磁场影响等优点。
附图说明
图1是荧光探针Tb
图2a是dtpa的傅里叶变换红外光谱(FT-IR)图。
图2b是腺嘌呤(adenine)的傅里叶变换红外光谱(FT-IR)图。
图2c是胞嘧啶(cytosine)的傅里叶变换红外光谱(FT-IR)图。
图2d是dtpa-2A的傅里叶变换红外光谱(FT-IR)图。
图2e是dtpa-2C的傅里叶变换红外光谱(FT-IR)图。
图2f是dtpa-AC的傅里叶变换红外光谱(FT-IR)图。
图3a是Tb
图3b是Tb
图3c是Tb
图4a-1是荧光探针Tb
图4a-2是荧光探针Tb
图4b-1是荧光探针Tb
图4b-2是荧光探针Tb
图4c-1是荧光探针Tb
图4c-2是荧光探针Tb
图5a是荧光探针Tb
图5b是荧光探针Tb
图5c是荧光探针Tb
图6a是荧光探针Tb
图6b是荧光探针Tb
图6c是荧光探针Tb
具体实施方式
实施例1
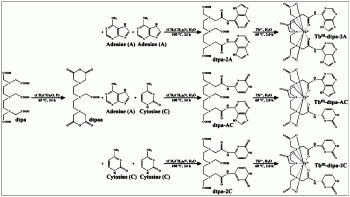
二乙三胺五乙酸二酐(dtpaa)的制备:称取7.8670g(0.02mol)二乙三胺五乙酸(dtpa),乙酸酐16.0mL(0.08mol),吡啶10.0mL(0.12mol)置于三颈圆底烧瓶中,在65℃下缓慢搅拌加热,冷凝回流24h。停止加热和搅拌,冷却至室温后将产物减压抽滤,依次用乙酸酐和无水乙醚分别洗涤三次(3×10mL),并减压抽滤,将产物于干燥箱中60℃干燥,即得二乙三胺五乙酸二酐(dtpaa)。
(一)用于检测黄嘌呤的荧光探针——铽-二乙三胺五乙酸-双(腺嘌呤)(Tb
1、二乙三胺五乙酸-双(腺嘌呤)(dtpa-2A)的制备:取二乙三胺五乙酸二酐(dtpaa)1.9635g(5.5mmol),2.334mL的三乙胺(16.5mmol),无水DMF(50mL),腺嘌呤(A)1.4864g(11mmol),于三颈圆底烧瓶中。恒温100℃条件下,快速搅拌,冷凝回流24h。反应完全后静置,冷却到室温后,旋转蒸发除去溶剂,得乳白色固体物质,减压抽滤,依次用乙腈和无水乙醚分别洗涤三次(3×10mL)。于50℃条件下干燥,即得二乙三胺五乙酸-双(腺嘌呤)(dtpa-2A)。
2、Tb
(二)用于检测黄嘌呤的荧光探针——铽-二乙三胺五乙酸-双(胞嘧啶)(Tb
1、二乙三胺五乙酸-双(胞嘧啶)(dtpa-2C)的制备:取二乙三胺五乙酸二酐(dtpaa)1.9635g(5.5mmol),2.334mL的三乙胺(16.5mmol),无水DMF(50mL),胞嘧啶(C)1.2210g(11mmol),于三颈圆底烧瓶中。恒温100℃条件下,快速搅拌,冷凝回流24h。反应完全后静置,冷却到室温后,旋转蒸发除去溶剂,得浅黄色固体物质,减压抽滤,依次用乙腈和无水乙醚分别洗涤三次(3×10mL)。于50℃条件下干燥,即得二乙三胺五乙酸-双(胞嘧啶)(dtpa-2C)。
2、Tb
(三)用于检测黄嘌呤的荧光探针——铽-腺嘌呤-二乙三胺五乙酸-胞嘧啶(Tb
1、腺嘌呤-二乙三胺五乙酸-胞嘧啶(dtpa-AC)的制备:取二乙三胺五乙酸二酐(dtpaa)1.9635g(5.5mmol),2.334mL的三乙胺(16.5mmol),无水DMF(50mL),腺嘌呤(A)0.7432g(5.5mmol),于三颈圆底烧瓶中。恒温100℃条件下,快速搅拌,冷凝回流24h。向上述反应液中再加入胞嘧啶0.6105g(5.5mmol),继续在恒温100℃条件下快速搅拌,冷凝回流24h。反应完全后静置,冷却到室温后,旋转蒸发除去溶剂,得乳白色固体物质,减压抽滤,依次用乙腈和无水乙醚分别洗涤三次(3×10mL)。于50℃条件下干燥,即得腺嘌呤-二乙三胺五乙酸-胞嘧啶(dtpa-AC)。
2、Tb
(四)检测
1、dtpa、腺嘌呤、胞嘧啶、dtpa-2A、dtpa-2C和dtpa-AC的FT-IR图如图2a,2b,2c,2d,2e,2f所示。与dtpa,腺嘌呤和胞嘧啶的红外光谱相比,dtpa-2A,dtpa-2C和dtpa-AC的红外光谱中相应吸收峰的位置显示出明显的变化。尤其是dtpa-2A,dtpa-2C和dtpa-AC的红外光谱中酰胺键的C=O吸收峰分别出现在1638cm
实施例2用于检测黄嘌呤的荧光探针在检测黄嘌呤中的应用
取一定量的黄嘌呤用去离子水配置成浓度为5.0×10
分别取实施例1制备的Tb
(一)荧光探针的紫外吸收光谱
1、方法
取9支比色管分为Tb
Tb
Tb
Tb
2、检测
dtpa-2A,dtpa-2C,dtpa-AC,Tb
从图3a中可以看出,Tb
从图3b可以看出,dtpa-2C分别在221nm和270nm处具有两个吸收峰,但吸光度均较弱。当与Tb
从图3c可以看出,dtpa-AC和Tb
(二)荧光探针对黄嘌呤检测的荧光光谱
方法:取9支10mL比色管分为Tb
从图4a-1中可以看出,在280nm波长光的激发下,Tb
从图4b-1中可以看出,在330nm波长光的激发下,Tb
从图4c-1中可以看出,在340nm波长光的激发下,Tb
(三)不同共存物质与黄嘌呤混合对荧光探针Tb
方法:取15支比色管分为Tb
从图5a中可以看出,在280nm波长光的激发下,Tb
表1
从图5b中可以看出,在330nm波长光的激发下,Tb
表2
从图5c中可以看出,在340nm波长光的激发下,Tb
表3
上述实验结果说明,本发明的Tb
(四)荧光探针Tb
方法:取18支10mL比色管分为Tb
从图6a中可以看出,在280nm波长光的激发下,纯尿液在390nm处发出相对强的荧光。当向尿液中加入黄嘌呤(最终浓度为150μmol/L)时,尿液的荧光强度显著降低。这表明当尿液中含有大量黄嘌呤时,尿液的荧光强度可能会明显降低。但是,这种方法用于判断尿液中是否产生大量黄嘌呤是不准确的。当将Tb
表4
从图6b中可以看出,在330nm波长的光激发下,纯尿液在372nm处发射出非常弱的荧光。当把黄嘌呤加入到尿液中时(最终浓度为150μmol/L),尿液的荧光强度略微增加。将Tb
表5
从图6c中可以看出,在340nm波长光的激发下,纯尿液发射出微弱的荧光。向尿液中加入黄嘌呤(最终浓度为150μmol/L)后,尿液的荧光强度略有增加。将Tb
表6
上述实验结果说明,本发明的Tb
用于检测黄嘌呤的荧光探针及其制备方法和应用专利购买费用说明
![]()
Q:办理专利转让的流程及所需资料
A:专利权人变更需要办理著录项目变更手续,有代理机构的,变更手续应当由代理机构办理。
1:专利变更应当使用专利局统一制作的“著录项目变更申报书”提出。
2:按规定缴纳著录项目变更手续费。
3:同时提交相关证明文件原件。
4:专利权转移的,变更后的专利权人委托新专利代理机构的,应当提交变更后的全体专利申请人签字或者盖章的委托书。
Q:专利著录项目变更费用如何缴交
A:(1)直接到国家知识产权局受理大厅收费窗口缴纳,(2)通过代办处缴纳,(3)通过邮局或者银行汇款,更多缴纳方式
Q:专利转让变更,多久能出结果
A:著录项目变更请求书递交后,一般1-2个月左右就会收到通知,国家知识产权局会下达《转让手续合格通知书》。
动态评分
0.0