专利摘要
本发明公开了一种化学发光成像技术检测单核苷酸多态性的方法,是通过以下步骤实现的:(1)连接酶扩增:准确加入G12C突变型k-ras基因与探针1、探针2、10×连接酶Ampligase反应缓冲液和TE缓冲液于离心管中,进行扩增;(2)将链霉亲和素磁性微球用HEPES缓冲溶液洗两次,加入上述离心管中,室温振荡孵育,磁分离后,弃去上清液,用HEPES缓冲液清洗;(3)上述离心管分别加入HEPES缓冲溶液和氯化血红素,室温振荡反应,得到磁性微球-DNA复合物;(4)将磁性微球-DNA复合物用HEPES缓冲溶液清洗,磁分离后,各加入鲁米诺、H2O2于全白96孔板中,采用美国UVP公司的化学发光成像分析仪测定其化学发光图像及发光强度;实现了对单核苷酸多态性的高灵敏、高选择性检测。
权利要求
1.一种化学发光成像技术检测单核苷酸多态性的方法,其特征在于,是通过以下步骤实现的:
(1)连接酶扩增:准确加入含有待测基因的DNA样品与1μM的探针1、探针2各2μl、1μl10×连接酶Ampligase反应缓冲液和2μl TE缓冲液于离心管中,将上述离心管放入基因扩增仪,于95℃反应3min后,75℃下加入1μl连接酶Ampligase,酶活为5U于各个离心管中,设定基因扩增仪程序,使其在95℃1min和50℃1min循环反应30圈;反应结束后,产物于4℃继续反应10min,其中探针1的序列为5'-GTGGCGTAGGCAAGAGT-3',5'端磷酸化,3'端生物素修饰,如SEQ ID NO.1所示,探针2的序列为5'-GGGTAGGGCGGGTTGGGGTGGTAGTTGGAGCTT-3',如SEQ ID NO.2所示;
(2)将链霉亲和素磁性微球用HEPES缓冲溶液洗两次,各取20μl加入上述离心管中,室温振荡孵育30min,磁分离后,弃去上清液,用HEPES缓冲液清洗三次;
(3)上述离心管分别加入10μl HEPES缓冲溶液和10μl5×10-7M的氯化血红素,室温振荡反应20min,得到磁性微球-DNA复合物;
(4)将所得到的磁性微球-DNA复合物用HEPES缓冲溶液清洗两次,磁分离后,各加入0.02M鲁米诺、0.2M H2O2各20μl于全白96孔板中,采用化学发光成像分析仪测定其化学发光图像及发光强度,来检测单核苷酸多态性;当发光强度大于30000时,待测样品即为突变型;当发光强度小于30000时,待测样品即为野生型。
2.如权利要求1所述的一种化学发光成像技术检测单核苷酸多态性的方法,其特征在于,含有待测基因的DNA样品的浓度为0,2nM,4nM,6nM,8nM和10nM。
3.如权利要求1所述的一种化学发光成像技术检测单核苷酸多态性的方法,其特征在于,HEPES缓冲溶液的pH为7.4。
说明书
技术领域
本发明涉及一种检测单核苷酸多态性的方法,尤其涉及一种化学发光成像技术检测单核苷酸多态性的方法。
背景技术
单核苷酸多态性(single nucleotide polymorphism,SNP)是指在基因组水平上由单个核苷酸(即单个碱基)的变异所引起的核酸序列多态性,包括单个碱基的转换、颠换、缺失或插入。单核苷酸多态性在人类基因组中广泛存在,人类的许多遗传性疾病都是由单核苷酸多态性所引起。例如,k-ras原癌基因分为突变型和野生型,其与肿瘤的生成、增殖、迁移、扩散及血管生成有关,在白血病、肺癌、直肠癌和胰腺癌中均很常见。因此,实现对单核苷酸多态性的早期、准确、灵敏、快速检测,对人类相关疾病发病机理的研究、早期治疗、药物响应等具有重要意义。
连接酶扩增反应(ligase amplification reaction,LAR)是引入热稳定连接酶而建立的一项完善的DNA体外扩增和检测技术。连接酶扩增反应体系中两条引物完全与靶标序列互补,经过退火过程与靶标杂交后,引物之间有一个缺口,在热稳定连接酶的作用下,缺口封闭形成一条完整的互补链。高温变性后,所形成的双链解旋,在退火过程中释放的靶标又可与引物杂交,生成新的连接产物。因此,每经过一个变性-退火-连接反应过程,靶标均可作为模板引发连接反应,从而实现靶标的扩增,实现较高的灵敏度。此外,与传统的聚合酶链反应相比,由于连接酶扩增反应中引物与模板的特异结合以及连接酶的特异性作用,因此不易形成假阳性的连接产物,特异性强,在检测点突变等方面具有独特的优点。
近年来,化学发光成像技术发展迅速,己被应用于样品中目标分析物局部定位成像分析,特定目标分子的空间分布、宏观或微观样品的化学及生物化学过程的评估等。与传统的显色分析及荧光成像技术相比,化学发光成像分析最大的优点是由化学发光反应提供能量,无需外加光源,仪器设备简单,背景干扰小,具有较高的信噪比。化学发光成像技术可用于微孔板、微阵列、及微型化分析装置中多组分样品或同一样品中多种被测物的高通量检测。因此,化学发光成像技术已成为一种灵敏、高效、通用的分析手段。
发明内容
针对上述现有技术,本发明提供了一种化学发光成像技术检测单核苷酸多态性的方法,将连接酶扩增反应与化学发光成像技术相结合,采用链霉亲和素磁性微球捕获扩增产物,通过磁性分离有效降低背景值,实现G12C突变型k-ras基因的快速、灵敏、特异性检测。
本发明是通过以下技术方案实现的:
一种化学发光成像技术检测单核苷酸多态性的方法,是通过以下步骤实现的:
(1)连接酶扩增:准确加入含有待检测基因的DNA样品与1μM的探针1、探针2各2μl、1μl10×连接酶Ampligase反应缓冲液和2μl TE缓冲液于离心管中,将上述离心管放入基因扩增仪,于95℃反应3min后,75℃下加入1μl连接酶Ampligase,酶活为5U于各个离心管中,设定基因扩增仪程序,使其在95℃1min和50℃1min循环反应30圈;反应结束后,产物于4℃继续反应10min,其中探针1的序列为5'-GTGGCGTAGGCAAGAGT-3',5'端磷酸化,3'端生物素修饰,如SEQ ID NO.1所示,探针2的序列为5'-GGGTAGGGCGGGTTGGGGTGGTAGTTGGAGCTT-3',如SEQ ID NO.2所示;
(2)将链霉亲和素磁性微球用HEPES缓冲溶液洗两次,各取20μl加入上述离心管中,室温振荡孵育30min,磁分离后,弃去上清液,用HEPES缓冲液清洗三次;
(3)上述离心管分别加入10μl HEPES缓冲溶液和10μl5×10-7M的氯化血红素,室温振荡反应20min,得到磁性微球-DNA复合物;
(4)将所得到的磁性微球-DNA复合物用HEPES缓冲溶液清洗两次,磁分离后,各加入0.02M鲁米诺、0.2M H2O2各20μl于全白96孔板中,采用美国UVP公司的化学发光成像分析仪测定其化学发光图像及发光强度;当发光强度大于30000时,待测样品即为突变型;当发光强度小于30000时,待测样品即为野生型。
含有待检测基因的DNA标准样品的浓度为0,2nM,4nM,6nM,8nM和10nM。
HEPES缓冲溶液的pH为7.4。
本发明的有益效果为,
1.本方法基于连接酶扩增反应对目标DNA进行扩增,采用化学发光成像技术实现了对单核苷酸多态性的高灵敏、高选择性检测。
2.当存在单碱基突变基因时,基于连接酶扩增反应中引物与模板的特异结合以及热稳定性连接酶Ampligase的特异性作用,引发连接酶扩增反应,与传统的聚合酶链式反应相比,极大地降低假阳性产物的生成,提高检测的选择性。
3.利用链霉亲和素磁性微球捕获扩增产物,有效分离未结合的氯化血红素,降低背景值,进一步提高检测的灵敏度。通过在链霉亲和素磁性微球表面形成辣根过氧化物DNA模拟酶催化鲁米诺-H2O2化学发光反应体系,采用化学发光成像分析技术检测,实现对单核苷酸多态性的高灵敏、高选择性分析。
4.根据目标基因设计探针1和探针2的序列,采用本发明可实现单核苷酸多态性的定性与定量检测,具有快速、简便、准确、灵敏度高、选择性好等优点。
附图说明
图1为基于连接酶扩增反应化学成像技术检测G12C突变型k-ras基因示意图;
图2为系列浓度G12C突变型k-ras基因的化学发光成像图及其工作曲线;
图3为本发明实施例选择性实验的化学发光强度图;
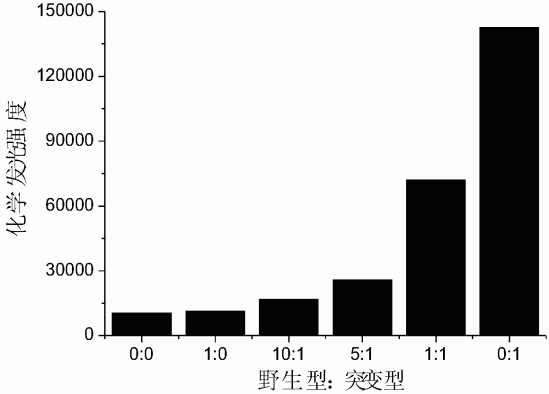
图4为不同比例野生型与突变型k-ras基因的化学发光强度图。
具体实施方式
下面结合实施例对本发明作进一步的说明。
主要试剂
人工合成寡聚核苷酸(上海生工生物工程有限公司)序列如表1所示:
表1实验中用到的DNA序列
其中,探针1、探针2的序列对应于G12C突变型k-ras基因的检测。
实验中所用到的试剂:
连接酶Ampligase( 公司);鲁米诺(luminol,上海阿拉丁化学试剂公司);30%的H2O2溶液(分析级);链霉亲和素磁性微球(1μm,10mg/ml,郑州英诺生物科技有限公司);氢氧化钠(烟台市三合化学试剂有限公司);氯化血红素(hemin,上海阿拉丁化学试剂有限公司);二甲基亚砜(DMSO,天津市广成化学试剂有限公司);全白96孔板(美国Costar公司),实验中所用水均为二次去离子水。
HEPES缓冲溶液的组成:取0.5958g HEPES、0.1491g KCl、1.1688g NaCl、1ml DMSO定容于100ml容量瓶中,定容后加入50μl tritonx-100。用NaOH固体调pH至7.4。
TE缓冲溶液的组成为:10mM Tris-HCl(pH=8.0),1mM EDTA,12.5mM MgCl2,用NaOH固体调pH至8.0。
实验中所用的DNA溶液均由TE缓冲溶液(pH=8.0)配制而成。
仪器装置
化学发光成像分析仪(美国UVP公司);基因扩增仪TC-25/H(杭州博日科技有限公司);THZ-82A气浴恒温振荡器;电子天平(MTELLER TOLEDO仪器(上海)有限公司);PHS-25型pH计(上海精科雷磁);磁性分离架(天津倍思乐色谱技术开发中心)。
实验中所用的所有玻璃仪器均在新配制的HCl-HNO3(1:3)溶液中浸泡,并用二次去离子水洗涤干净,室温晾干后使用。
一种化学发光成像技术检测单核苷酸多态性的方法,是通过以下步骤实现的:
(1)连接酶扩增:准确加入浓度为0,2nM,4nM,6nM,8nM和10nM的G12C突变型k-ras基因与1μM的探针1、探针2各2μl、1μl10×连接酶Ampligase反应缓冲液、2μl TE缓冲液于离心管中,将上述离心管放入基因扩增仪,于95℃反应3min后,75℃下加入1μl连接酶Ampligase(5U)于各个离心管中,设定基因扩增仪程序,使其在95℃1min和50℃1min循环反应30圈;反应结束后,产物于4℃继续反应10min,其中探针1的序列为5'-GTGGCGTAGGCAAGAGT-3',5'端磷酸化,3'端生物素修饰,如SEQ ID NO.1所示,探针2的序列为5'-GGGTAGGGCGGGTTGGGGTGGTAGTTGGAGCTT-3',如SEQ ID NO.2所示,G12C突变型k-ras基因的序列为5'-ACTCTTGCCTACGCCACAAGCTCCAACTACCAC-3',如SEQ ID NO.3所示;
(2)将链霉亲和素磁性微球用HEPES缓冲溶液洗两次,各取20μl加入上述离心管中,室温振荡孵育30min,磁分离后,弃去上清液,用HEPES缓冲液清洗三次;
(3)上述离心管分别加入10μl HEPES缓冲溶液和10μl5×10-7M的氯化血红素,室温振荡反应20min,得到磁性微球-DNA复合物;
(4)将所得到的磁性微球-DNA复合物用HEPES缓冲溶液清洗两次,磁分离后,各加入0.02M鲁米诺、0.2M H2O2各20μl于全白96孔板中,采用美国UVP公司的化学发光成像分析仪测定其化学发光图像及发光强度。
G12C突变型k-ras基因的浓度为0,2nM,4nM,6nM,8nM和10nM。
结果与讨论
如图1所示,若靶标为G12C突变型k-ras基因,设计探针1和探针与其序列互补。经过一个变性(95℃)-退火-连接(50℃)过程,探针1和探针2在热稳定性连接酶Ampligase的作用下连接成长链产物。在下一个循环中,靶标又可作为模板使探针1、探针2连接。经过反复的变性-退火-连接,G12C突变型k-ras基因可产生大量的连接产物,以上即为连接酶扩增反应过程。
由于探针1的3'端生物素修饰,因此通过生物素-链霉亲和素的特异性结合作用,采用链霉亲和素磁性微球捕获连接酶扩增反应产物。连接产物中的G-四分体序列可与氯化血红素结合,形成具有催化活性的辣根过氧化物DNA模拟酶。此时在鲁米诺和H2O2存在时,可引发辣根过氧化物DNA模拟酶催化的鲁米诺-H2O2化学发光反应,采用化学发光成像分析技术,实现对G12C突变型k-ras基因的高灵敏、高选择性检测。该化学发光体系中,鲁米诺为发光试剂,H2O2为氧化剂,辣根过氧化物DNA模拟酶为催化剂。
若靶标为野生型k-ras基因,探针杂交后形成缺口,在缺口附近核苷酸的空间结构发生变化,探针不能通过热稳定性连接酶Ampligase连接,因而无法将G-四分体序列捕获到链霉亲和素磁性微球表面,进而无法催化鲁米诺-H2O2化学发光反应。
本工作采用链霉亲和素磁性微球一方面可提取连接酶扩增反应产物,简化实验操作,将反应体系与检测体系分开;另一方面,由于氯化血红素自身也可催化鲁米诺-H2O2化学发光反应体系,产生发光信号。采用链霉亲和素磁性微球,可通过磁性分离除去未与G-四分体结合的氯化血红素,有效较低背景值,从而提高检测的灵敏度。
灵敏度实验
为了研究本方法对单核苷酸多态性检测的灵敏度,对不同浓度G12C突变型k-ras基因进行定量检测。结果如图2所示,随着G12C突变型k-ras基因浓度的增加,化学发光成像的发光强度逐渐增强。当靶浓度在0~10nM范围时,相对化学发光强度与G12C突变型k-ras基因浓度呈现出良好的线性关系,线性回归方程表示为ΔI=13513.9C–6010.7(ΔI为相对化学发光强度,C为G12C突变型k-ras基因浓度,nM。n=6,R=0.9961)。
选择性实验
分别将空白、随机DNA、野生型k-ras基因和G12C突变型k-ras基因(浓度均为4nM)作为本实施例中的靶标,按照本实施例的实验步骤,采用美国UVP公司的化学发光成像分析仪测定各样品的化学发光图像及发光强度,其中野生型k-ras基因的序列为5'-ACTCTTGCCTACGCCACCAGCTCCAACTACCAC-3',如SEQ ID NO.4所示,随机DNA的序列为5'-CGAATTCAGGTAACATAGCGCTAATGATGCAAC-3',如SEQ ID NO.5所示。
为研究本方法的选择性,分别对4nM的G12C突变型k-ras基因、野生型k-ras基因和随机DNA进行检测。结果如图3所示,当检测野生型k-ras基因和随机DNA时,在连接酶Ampligase的作用下,探针1和探针2之间无法连接,因而无法将G-四分体序列引入到链霉亲和素磁性微球表面,进而无法催化鲁米诺-H2O2化学发光反应。因此,随机DNA和野生型k-ras基因的化学发光强度与空白样品相当,而G12C突变型k-ras基因发光强度很强。因此本方法具有良好的选择性。
混合样品实验
分别将野生型k-ras基因和G12C突变型k-ras基因比例为0:0(即空白)、1:0、10:1、5:1、1:1和0:1的混合液(浓度为10nM)作为本实施例中的靶标,按照本实施例的实验步骤,采用美国UVP公司的化学发光成像分析仪测定各样品的化学发光图像及发光强度。
对不同比例混合的野生型k-ras基因和G12C突变型k-ras基因(0:0、1:0、10:1、5:1、1:1、0:1)进行检测。结果如图4所示,随着G12C突变型k-ras基因在混合样品中所占比例的增大,化学发光强度明显增强,且各比例之间差别较大。因此,本方法可用于复杂样品中单核苷酸多态性的检测。
本方法基于连接酶扩增反应,采用化学发光成像技术实现了对单核苷酸多态性的高灵敏、高选择性检测。当存在单碱基突变基因时,在热稳定性连接酶Ampligase的作用下,引发连接酶扩增反应,提高检测的选择性和灵敏度。利用链霉亲和素磁性微球捕获扩增产物,有效分离未结合的氯化血红素,降低背景值,进一步提高检测的灵敏度。通过在链霉亲和素磁性微球表面形成辣根过氧化物DNA模拟酶催化鲁米诺-H2O2化学发光反应体系,采用化学发光成像分析技术检测,实现对单核苷酸多态性的高灵敏、高选择性分析。
上述虽然结合附图对本发明的具体实施方式进行了描述,但并非对本发明保护范围的限制,所属领域技术人员应该明白,在本发明的技术方案的基础上,本领域技术人员不需要付出创造性劳动即可做出的各种修改或变形仍在本发明的保护范围以内。
一种化学发光成像技术检测单核苷酸多态性的方法专利购买费用说明
![]()
Q:办理专利转让的流程及所需资料
A:专利权人变更需要办理著录项目变更手续,有代理机构的,变更手续应当由代理机构办理。
1:专利变更应当使用专利局统一制作的“著录项目变更申报书”提出。
2:按规定缴纳著录项目变更手续费。
3:同时提交相关证明文件原件。
4:专利权转移的,变更后的专利权人委托新专利代理机构的,应当提交变更后的全体专利申请人签字或者盖章的委托书。
Q:专利著录项目变更费用如何缴交
A:(1)直接到国家知识产权局受理大厅收费窗口缴纳,(2)通过代办处缴纳,(3)通过邮局或者银行汇款,更多缴纳方式
Q:专利转让变更,多久能出结果
A:著录项目变更请求书递交后,一般1-2个月左右就会收到通知,国家知识产权局会下达《转让手续合格通知书》。
动态评分
0.0