专利摘要
本发明公开了一种三七转录因子基因PnMYB1及其应用,PnMYB1基因具有SEQIDNO:1所述的碱基序列,编码MYB类转录因子;本发明采用功能基因组学和代谢工程相关技术证明三七PnMYB1转录因子具有调控三七皂苷生物合成的功能;将本发明所述的三七PnMYB1转录因子基因构建到植物表达载体上并转入三七愈伤组织中使其过量表达,增强了三七皂苷合成途径中关键酶基因和三七中PnbHLH1转录因子表达量,提高了三七总皂苷和部分单体皂苷的含量。
权利要求
1.一种三七转录因子基因PnMYB1,其特征在于:其核苷酸序列如SEQ ID NO︰1所述。
2.权利要求1所述的三七转录因子基因PnMYB1在提高三七皂苷合成代谢途径中关键酶基因表达量、转录因子PnbHLH1表达量、增加三七愈伤组织中总皂苷与单体皂苷含量的应用。
说明书
技术领域
本发明涉及分子生物学以及基因工程领域,尤其是一种三七转录因子基因PnMYB1及其应用。
背景技术
三七Panaxnotoginseng (Burk.) F. H. Chen为五加科人参属多年生草本植物,又名金不换、血参、人参三七、田七等,是我国特有的名贵中药材。三七在中国己有悠久的使用历史,在《本草纲目拾遗》、《跌损妙方》和《医门秘旨》中都有记载,被公认具有止血散瘀、消肿止痛、滋补强壮等功效。三七主要化学成分包括皂苷、类黄酮、多糖、甾醇和挥发油等,其中最主要的有效果成分为三七皂苷(saponins of Panax notoginseng , PNS)。三七皂苷主要为四环三萜类皂苷,包括人参皂苷Rb1、Rg1、Rh1、Rd和Re等70余种,其具有扩张冠状动脉和外周血管、增加脑血流量的作用;还有抑制血小板凝聚、降低血液粘稠度、抑制血栓形成的功效;同时,兼具阵血脂、抗疲劳、耐缺氧,提高和增强巨噬细胞功能等作用。近年,三七的市场需求旺盛,但三七为多年生植物,对生境要求苛刻,产量难提高。强烈的供需矛盾使得利用生物工程技术和基因调控的方法来生产三七皂苷逐渐成为研究热点。
茉莉酸甲酯(MeJA)为植物重要次级代谢信号分子,在植物抗逆自我保护过程中扮演重要角色,能够引起细胞次生代谢物的合成。越来越多的研究表明,控制重要萜类次生代谢物合成的转录因子大多能被茉莉酸甲酯诱导表达。转录因子是指能够特异性作用基因5’端上游启动子顺式作用元件的蛋白质,又称反式作用因子。其能通过调控RNA聚合酶与DNA模板的结合来激活或抑制某些基因转录。转录调控是植物次生代谢的重要环节,往往直接决定着代谢产物的合成。在植物中转录因子表达量的变化对其调控基因的表达量具有较大影响。因此,转录因子被作为改造植物代谢途径的有效工具,具有“多点调控”的优势,次生代谢途径中多个功能相关的酶基因常被同一转录因子正调控或负调控。例如在长春花中过表达转录因子ORCA3能够使D4H、STR、CPR和TDC等多个基因协同表达,显著提高长春花碱的含量。由于转录因子具“多点调控”的优点,通过生物工程技术和基因工程技术对转录因子进行基因修饰显然比多基因操作更容易改良目标次生代谢途径。
MYB类转录因子在高等植物中广泛存在,为植物中最大的转录因子家族之一。MYB类转录因子的DNA结合结构域较保守,其由四个不完全的序列重复(R,分为R、R2、R3)组成,根据重复片段R的个数可将其分为四类:MYB-single(1R-MYB & MYB-related),R2R3-MYB,3R-MYB,4R-MYB。MYB-single主要参与植物细胞的形态发育和节律控制。R2R3-MYB为植物中含量最多的一类MYB转录因子,主要参与植物初生次生代谢的调控、生长发育以及对逆境刺激的响应等。3R-MYB主要参与调控细胞周期,4R-MYB功能报道较少尚不明确。
MYB转录因子广泛参与植物苯丙烷、花青素、生物碱等次生代谢产物的生物合成,对萜类的调控报道较少,近年有报道,在云杉中超表达PtMYB14能够显著提高萜类的产量。长春花中超表达MYB类转录因子基因CrBPF1能够提高长春花中吲哚和萜类生物合成途径中相关酶基因的转录水平,调控吲哚生物碱和萜类的生物合成。说明仍然有少量参与萜类次生代谢的MYB转录因子存在。
随着对植物次生代谢网络的深入解析和调控机制的阐明,特别是调节特定次生代谢物合成的转录因子的分离和鉴定,基于转录因子的基因工程将为开发利用植物次生代谢物提供更加有效的手段。本发明以体外培养的三七愈伤组织为研究对象,克隆PnMYB1转录因子基因,并对该转录因子进行分析和功能鉴定,明确PnMYB1转录因子在三七皂苷生物合成过程中的地位和作用,为获得高效、稳定的三七皂苷合成调控技术和同源或异源高效表达系统的建立提供理论参考和依据。
发明内容
本发明的目的是从三七中克隆获得可调控三七皂苷生物合成的转录因子基因PnMYB1以及明确该转录因子的应用,即在提高三七皂苷生物合成代谢途径中关键酶基因、转录因子基因PnbHLH1表达量和增加三七愈伤组织中总皂苷与部分重要单体皂苷含量的应用。
本发明利用酵母单杂交法和cDNA末端快速扩增技术从三七中克隆到一个与MeJA诱导相关的MYB类转录因子基因并对其编码蛋白进行功能鉴定。发明人将其命名为PnMYB1,其中所述的cDNA片段如序列表SEQ ID NO: 1所示。对该基因进行序列分析,表明PnMYB1全长cDNA为1014bp,PnMYB1编码区是序列表SEQ ID NO: 1中第64-786位所示的核苷酸序列,具有723bp的开放阅读框(Open reading frame,ORF),63bp的5’非翻译区(untranslated region,UTR)和228bp的3’UTR,编码含有240个氨基酸的蛋白质,氨基酸序列如SEQ ID NO: 2所示。通过农杆菌介导法将本发明的PnMYB1转录因子基因插入到植物表达载体pCAMBIA2300S多克隆位点所构建的重组载体转入到三七愈伤组织中,可提高三七皂苷合成途径中关键酶基因的表达量,使三七皂苷的含量增加。
上述转录因子基因可以应用于正调控三七皂苷的生物合成,具体操作如下:
(1)基因的获得:利用酵母单杂交方法筛选出三七中与MeJA诱导相关的MYB类转录因子,再利用cDNA末端快速扩增技术(3’RACE)获得PnMYB1的全长cDNA,设计特异性引物扩增PnMYB1的ORF框,然后将其连接到pGEM-T载体上,经测序验证获得具有目的基因的克隆;
(2)植物表达载体构建与遗传转化:用限制性内切酶BamHⅠ和EcoR I酶切pGEM-T-PnMYB1质粒,胶回收获得目的基因片段;用相同的限制性内切酶消化植物表达载体pCAMBIA2300S,胶回收载体大片段;将胶回收的目的基因片段与pCAMBIA2300S载体大片段连接,构建植物超表达载体pCAMBIA2300S-PnMYB1;利用液氮冻融法将pCAMBIA2300S-PnMYB1质粒转入农杆菌菌株EHA105中。通过农杆菌介导的遗传转化法,将PnMYB1导入三七愈伤组织中使其过表达。通过抗生素筛选、基因组DNA PCR和qRT-PCR筛选阳性转基因细胞系;
(3)转基因细胞系总皂苷含量检测:提取三七非转基因和转基因细胞系中总皂苷,分析非转基因和转基因细胞系间总皂苷含量的差异,筛选出三七总皂苷含量得已提高的阳性转基因细胞系;
(4)转基因细胞系部分重要单体皂苷含量检测:制备三七非转基因和总皂苷含量得到提高的转基因细胞系的皂苷溶液,利用HPLC法对非转基因和转基因细胞系中的重要部分单体皂苷含量进行测定,分析非转基因和转基因细胞系间单体皂苷含量的差异,最后筛选出单体皂苷含量得到提高的阳性转基因细胞系。
本发明为提高三七中皂苷的含量提供了一种新方法,利用生物工程技术和基因调控的方法可更高效率合成三七皂苷,克服了人工栽培周期长、化学合成机理和路线不够清晰等缺点;将转录因子PnMYB1基因导入三七细胞中表达,使三七皂苷生物合成途径关键酶基因的表达量提高,增加了三七皂苷的产量,为大规模产业化生产三七皂苷提供了理论参考和科学依据。
附图说明
图1为本发明中三七总RNA电泳图谱;
图2为本发明中纯化mRNA电泳图谱,其中M为DL2000 DNA Marker,1为纯化的mRNA;
图3为本发明中酵母单杂交表达文库中片段扩增结果,其中M为DL2000 DNA Marker , l-16为不同的酵母菌落PCR产物;
图4 为本发明中PnMYB1全长cDNA扩增结果,其中M为DL2000 DNA Marker,1 为PnMYB1全长cDNA扩增产物;
图5为本发明中qRT-PCR结果分析图,表示三七皂苷合成途径中受PnMYB1调控的FPS 、HMGR、DS和PnbHLH1基因在野生型和转基因细胞系中的表达水平,其中WT为野生型细胞系,T1、T2和T3为转基因细胞系;
图6为本发明中三七总皂苷含量测定结果,其中WT为野生型细胞系,T1、T2和T3为转基因细胞系;
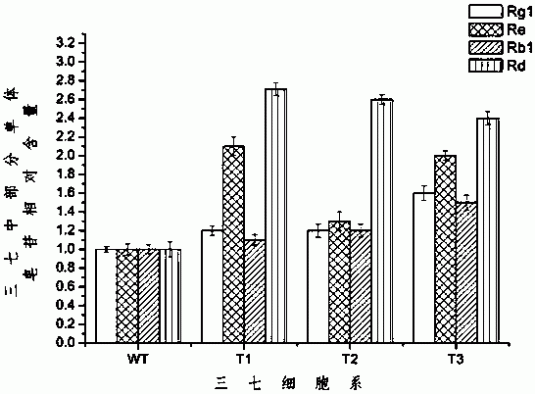
图7为本发明中部分重要单体皂苷含量测定结果,其中WT为野生型细胞系,T1、T2和T3为转基因细胞系。
具体实施方式
下面结合附图和具体实施例对本发明进一步阐释,应理解,这些实施例仅以用于说明本发明而不用于限制本发明的范围。下列事实例中未注明具体的实验方法,均可以按照常规方法进行。如Sambrook等分子克隆:实验手册(New York: Cold Spring Harbor Labortary Press, 1989)中所述条件,或按照制造生产厂商的使用说明。
实施例1:PnMYB1全长基因的克隆以及序列分析
采用改良的异硫氰酸胍法提取经茉莉酸甲酯处理3-6 h的三七细胞总RNA(图1),并参照NucleoTeap mRNA(MACHERGY-NAGEL) 试剂盒说明书进行mRNA的分离(图2);取1μg mRNA按照Matchmaker™ Gold Yeast One-Hybrid Library Screening System构建cDNA文库,并利用Trimmer-2 cDNA normalization kit试剂盒对文库进行均一化。
设计添加酶切位点XhoⅠ和Hind Ⅲ的诱饵序列---3个重复的JERE序列,通过退火将该序列合成为双链。用XhoⅠ和Hind Ⅲ对pAbAi载体和JERE诱饵序列进行双酶切,胶回收目的片段,将回收的JERE诱饵片段与线性pAbAi 载体片段4℃过夜连接,然后转化大肠杆菌感受态,挑取单克隆进行菌液PCR检测并对阳性单克隆进行测序;引物根据插入片段进行设计,上游引物为: 5’-GTTCCTTATATGTAGCTTTCGACAT-3’,下游引物为:5’- CTCCTTTCAAAGAAGGCGGTC-3’。利用同源法将重组质粒pJERE-AbAi导入到Y1Hgold酵母感受态细胞中,再将均一化的三七细胞cDNA转入该酵母感受态细胞中,将转化细胞涂布到含AbA抗性的SD/-Leu酵母培养基上,30℃培养3-5天。待酵母长出后,进行酵母菌落PCR验证(图3),挑选插入片段大于500bp的克隆进行测序。
对测序结果分析知,经酵母单杂交筛选获得了与茉莉酸甲酯诱导相关的MYB类转录因子基因部分3’ 端片断。通过使用cDNA末端快速扩增技术(5’ RACE) 得到了PnMYB1基因的5’ 末端片段,其引物为5’-GTCTGTTCGCCCCGGAAGCCTCCCAGC-3’。再根据PnMYB1基因的5’和3’ 末端序列设计引物,用于扩增PnMYB1基因的cDNA全长,上游引物: 5’-AGGAAGTAGATAGCTTTTTAGTCTT-3’;下游引物: 5’–CCGGCACATTAAAAGGAACT-3’。PCR反应条件:94℃, 5 min; 94℃, 30s; 51℃, 30 s; 72℃, 60s; 32个循环; 72℃, 10 min。将PCR产物用1%的琼脂糖凝胶分离(图4),胶回收目的片段并连接到pGEM-T载体上,转化大肠杆菌感受态,挑取单克隆摇菌,菌液PCR检测后送测序。
最终获得的PnMYB1全长cDNA大小为1014 bp,将其序列全长放入NCBI中比对,与白梨中的MYB类转录因子TT2(登录号:XM_009363410.1)相似度最高,高达86%。通过NCBI ORF finder (http://www.ncbi.nlm.nih.gov/gorf/gorf.html) 分析发现其包含一个723 bp的ORF(见序列表)。PnMYB1编码蛋白的分子量约为27.3KD,等电点为8.99,不稳定系数为67.52,预测PnMYB1编码的蛋白质不稳定。生物信息学预测PnMYB1不包含跨膜区,不含信号肽,具有2个MYB类转录因子特征保守结构域,表明所获得的转录因子PnMYB1很可能是MYB类转录因子。通过在线工具iPSORT预测PnMYB1可能定位于细胞核。
实施例2:植物表达载体构建
根据PnMYB1基因ORF框的5’和3’末端序列设计引物并添加酶切位点,上游引物:5’-GGATCCATGGGGAGGAGCCCTTGCTGTGC-3’;下游引物:5’-GAATTCTCAAGACAGCCAATCTCCTCCGGAC-3’。用于扩增PnMYB1基因的ORF。PCR反应条件:94℃, 5 min; 94℃, 30 s; 63.5℃,30s; 72℃,50s , 32个循环;72℃, 10 min。将PCR产物用1%的琼脂糖凝胶分离、胶回收并连接到pGEM-T载体上,转化大肠杆菌感受态,挑单克隆摇菌,菌液PCR检测后送测序。
采用SanPrep柱式质粒DNA抽提试剂盒(上海生工)提取测序正确的大肠杆菌质粒pGEM-T- PnMYB1以及植物表达载体pCAMBIA2300S 的质粒,取1μL用于琼脂糖凝胶电泳检测所提取质粒的完整性和浓度。用限制性核酸内切酶BamH I(TaKaRa)和EcoR I(TaKaRa)分别对质粒pGEM-T- PnMYB1和pCAMBIA2300S进行双酶切(100μL体系),反应体系和操作过程为:取18μL pGEM-T- PnMYB1或pCAMBIA2300S质粒,依次加入10μL 10X M buffer,5μL BamH I, 5μL EcoR I, 62μL ddH2O,混匀后瞬时离心,37℃反应7小时。使用SanPrep柱式DNA胶回收试剂盒(上海生工)回收PnMYB1片段和pCAMBIA2300S载体大片段,取1μL回收产物琼脂糖凝胶电泳检测。
利用T4 DNA Ligase (TaKaRa)将回收的PnMYB1片段和pCAMBIA2300S载体大片段16℃水浴过夜连接。将连接产物热激转化大肠杆菌Trans1-T1,挑取单克隆摇菌,用扩增PnMYB1的特异性引物进行菌液PCR检测,筛得PnMYB1与pCAMBIA2300S成功连接的阳性单克隆。
试剂盒提取上述阳性单克隆中重组质粒pCAMBIA2300S-PnMYB1,琼脂糖凝胶电泳检测质粒大小与完整性,然后采用液氮冻融法将重组质粒pCAMBIA2300S-PnMYB1转入农杆菌EHA105感受态细胞中。操作步骤:取3μg pCAMBIA2300S-PnMYB1质粒加入含有200μL EHA105感受态细胞的离心管中,轻轻混匀后冰浴30 min,液氮速冻5 min,然后迅速置于37℃水浴5 min,之后立即冰浴 2 min,加入600μL LB液体培养基,200rpm,28℃振荡培养4h。将活化后的农杆菌涂于含有50 mg/L卡那霉素(Kanamycin,Kana)的LB固体培养基上,28℃倒置培养。挑取单菌落摇菌,用扩增PnMYB1的特异引物进行菌液PCR检测,筛得阳性单克隆,加入甘油后置于-80℃保存备用。
实施例3: 农杆菌介导的三七遗传转化
将保存的含有重组质粒pCAMBIA2300S-PnMYB1的农杆菌EHA105以1%的接种量接种于5 mL含有50 mg/L Kana和25 mg/L 利福平的LB液体培养基中,28℃培养至浑浊。取1 mL浑浊菌液涂布于含50 mg/L Kana和25 mg/L 利福平的LB固体培养基上, 28℃培养48h。从LB固体培养基上刮取适量农杆菌于含40 mg/L 乙酰丁香酮的MGL液体培养基中,200rpm,28℃振荡培养至OD600为0.6时停止摇菌,用于浸染。
将生长状态良好的三七愈伤组织接种于含40 mg/L乙酰丁香酮的MS固体培养基,预培养3天。将预培养3天的三七愈伤组织完全浸泡于OD600为0.6的上述农杆菌菌液中进行振荡培养。浸染完毕后抽滤除去菌液,且用无菌滤纸吸去愈伤组织表面菌液,再将愈伤组织接种于含40 mg/L 乙酰丁香酮的MS固体培养基,暗培养3天。用无菌水对共培养3天的三七愈伤组织进行洗涤,后再转接于含400 mg/L头孢霉素(cefotaxime sodium salt,Cef)的MS固体培养基上进行除菌培养,于25℃暗培养15天,防止农杆菌过度生长。最后将愈伤组织转接到筛选培养基(MS培养基含50mg/L Kana),每45天继代一次。经过6次筛选,最终分离出具有Kana抗性且增值速度快的纯细胞系,用于后续检测。
实施例4:PnMYB1基因超表达对三七皂苷合成途径关键酶基因FPS 、HMGR、DS和三七转录因子基因PnbHLH1表达量的影响
选取生长25天左右且状态良好的转基因三七细胞系和非转基因三七细胞系,分别提取总RNA,然后按照GoTaq 2-Step RT-qPCR System 试剂盒说明书合成cDNA。
以该cDNA为模板,根据三七GAPDH基因(登录号:KF815711.1)、法尼基焦磷酸合成酶(Farnesyl diphosphate synthase, FPS)基因(登录号:DQ059550.1)、3-羟基-3-甲基戊二酰辅酶A还原酶(3-hydroxy-3-methylglutaryl-CoA reducetase , HMGR)基因(登录号:KJ578757.1) 、达玛烯二醇合酶(Dammarenediol-II synthase,DS)基因(登录号:KC953035.1)以及三七转录因子基因PnbHLH1序列和GoTaq 2-Step RT-qPCR System试剂盒说明书要求设计荧光定量PCR引物。引物序列为GAPDHF: 5’-CTACCAACTGTCTTGCTCCCCT-3’ , GAPDHR: 5’-TGATGCAGCTCTTCCACCTCTC-3’; FPSF: 5’-CGGATGCTGGACTATAATGTG-3’ , FPSR: 5’-ATTTACGGCAATCATACCAACC-3’; HMGRF: 5’-GGCAGGACCCAGCACAAAATA-3’ , HMGRR: 5’-ACACCCAGAAGGTTCAAGCAA-3’; DSF: 5’-TATGAGTGGGAAGGGTG-3’ ,DSR: 5’-TGGCGATAATTGCTTGAGTA-3’; PnbHLH1F:5’ –CAAACTCGGAAGAAGTCCACGG-3’, PnbHLH1R: 5’-GGCTCATTAACAGGATTGCCACA-3’ 。反应体系和操作过程:在PCR管中加入20ng cDNA、25μL GoTaq qPCR Master Mix (2 X) 和0.5μL qPCR Primers (GAPDHF/GAPDHR, FPSF/FPSR,HMGRF/HMGRR , DSF/DSR,PnbHLH1F/ PnbHLH1R,10 μM),用Nuclease-Free Water补齐至50μL;将反应体系混匀后瞬时离心,随后将其置于荧光定量PCR仪中进行反应,采用两步法进行荧光定量PCR,反应参数如下:热启动95℃,2 min; 变性95℃,15 s;远火/延伸60℃,1 min,共40个循环。每个样品对应的每个基因重复检测3次。
qRT-PCR结果显示,过表达PnMYB1基因的三七细胞系中FPS 、HMGR、DS和PnbHLH1基因的表达量都比野生型种的高(图5),说明PnMYB1作为转录因子,能够促进三七皂苷生物合成代谢途径中基因FPS 、HMGR、DS和PnbHLH1的表达。WT表示对照组野生型细胞系,T1、T2和T3分别表示实验组不同的转基因细胞系。
实施例5: PnMYB1基因超表达对三七总皂苷合成量的影响
选取生长35天左右的转基因细胞系和野生型细胞系于50℃烘至恒重,研磨成粉,分别称取0.5 g于100 mL三角瓶中,加入50 mL甲醇溶液浸泡过夜,常温超声波处理1 h。过滤并收集滤液,将滤液于50℃挥干,用甲醇溶解剩余物,定容至25 mL,得粗提液。吸取粗提液5mL于50 mL烧杯中水浴蒸干,后用4倍体积的蒸馏水分次充分溶解,过滤,滤液全部转移至预处理好的HPD100大孔树脂柱内,先用2个柱体积的蒸馏水缓慢洗去糖类等水溶性杂质。Molish反应(α-萘酚与浓硫酸显色反应)检测糖类杂质是否除净,若结果为阳性,继续用蒸馏水洗至阴性,然后用2个柱体积的75%乙醇溶液将总皂苷缓慢洗脱,收集洗脱液,50℃水浴蒸干,剩余物用甲醇溶液溶解并定容至25mL。
精确吸取150μL此样品至带塞的10 mL试管中(每个样品设3个重复),50℃水浴挥干溶剂,加入新配制的5%香草醛-冰醋酸溶液0.2 mL,高氯酸0.8 mL,盖上塞子,混匀后60℃水浴15 min,立即冰上冷却,后加入5 mL冰醋酸,混匀室温静止10 min,用紫外分光光度计在554 nm波长处测定吸光度,根据标准曲线计算PNS含量。结果显示,超表达PnMYB1基因的三七细胞中总皂苷含量高于野生型细胞中总皂苷含量(图6),结合qRT-PCR结果,表明PnMYB1转录因子对三七皂苷生物合成具有正调控作用,有助于三七皂苷产量的提高,WT表示对照组野生型细胞系,T1、T2和T3分别表示实验组不同的转基因细胞系。
实施例6: 超表达PnMYB1基因对三七单体皂苷合成的影响
用HPLC法测定三七细胞系中部分重要单体皂苷(Rb1、Rg1、Rd和Re)的含量。高效液相色谱条件为:色谱柱Waters symmertry C18 (4.6 × 250mm,5μm),使用乙腈(A)/水(B)为流动相进行线性梯度洗脱(v/v),流速设定为1.0 mL/min,检测柱温35℃,检测波长为203 nm。
精确称取适量单体皂苷Rb1、Rg1、Rd和Re标准品,加入1 mL甲醇溶液,制成单体皂苷标准品混合溶液。分别吸取4μL、6μL、8μL、10μL、15μL、20μL、25μL和30μL的单体皂苷标准品混合溶液注入高效液相色谱仪,根据上述色谱条件进行测定。以进样量(μg)为横坐标(x),色谱峰的面积为纵坐标(y),绘制得到单体皂苷Rb1、Rg1、Rd和Re的标准曲线,并求得它们的线性回归方程。
分别称取0.1 g非转基因和总皂苷含量得到提高的转基因三七细胞粉末于50 mL三角瓶中,分别加入10 mL 70%甲醇溶液,浸泡过夜后超声处理90 min(60w,超声4 s,间隙2 s)。收集滤液于50℃烘箱中过夜烘干。加10 mL蒸馏水溶解烘干后的残余物,之后用等体积水饱和正丁醇萃取3次,将所有萃取液于50℃过夜烘干。用适量100%甲醇溶解烘干后的残余物,定容至5 mL,0.45μm滤膜过滤,利用高效液相色谱测定皂苷溶液中部分重要单体皂苷含量。结果显示,非转基因与转基因三七细胞系均检测到了Rb1、Rg1、Rd和Re这四种单体皂苷,转基因细胞系与非转基因野生型细胞系相比,这四种单体皂苷含量均出现不同幅度增加(图7),WT表示对照组野生型细胞系,T1、T2和T3分别表示实验组不同的转基因细胞系。
序列表(SEQ ID)
<110>昆明理工大学
<120>一种三七转录因子基因PnMYB1及其应用
<160>19
<170>PatentIn version 3.5
<210>1
<211>1014
<212>DNA
<213>Panax notoginseng
<220>
<221>mRNA
<222>(1)..(1014)
<220>
<221>5'UTR
<222>(1)..(63)
<220>
<221>CDS
<222>(64)..(786)
<220>
<221>3'UTR
<222>(787)..(1014)
<400>1
aggaagtaga tagcttttta gtcttgataa ggaacagaag gttacacagc aggtagttac60
caaatgggga ggagcccttg ctgtgcaaag gtagggctaa acaaaggtgc atggacttct 120
gttgaggaca agattctcag agactacatt aagctccatg gtgaaggcag atggagaagc 180
ctccccaaaa gagcaggttt aaagagatgt gggaagagtt gcaggcttag atggttgaat 240
tatctgagac cagacatcaa gagaggcaac atctcccctg atgaagaaga actcatcatc 300
cgccttcaca agctcttggg aaatagatgg tctctaatag ctgggaggct tccggggcga 360
acagacaatg aaataaagaa ctactggaat acaaccttga gaaaaaaggt tcatgacaat 420
cactcctcct ctgcttcagc tccagctcca gctcctccca agaaagactg gcagcagcag 480
cagcatttgg ttcggagcag atcggcgcat gagtgggata ataaaattga tgattccagt 540
tcaaaggcag aagaaaaata tgtagcaaaa gaatgtatta gtccagctgc attggatttg 600
gtgcatccgg atgtggaatt ttgcttaacg gagcttttaa actcggtttt ctggggttta 660
tttgagaacc ctctgcagcc ggaggctaat tggaatgtcg gtgattttgt tcaaccaaat 720
gtggcttcca ctcatcatta ttttgctaat aatatttctg agtccggagg agattggctg 780
tcttgatgtt caaattacta gtagtattta tgtagctacc tacctacccc aaaaataata 840
cactccgctc tggcttcttg tgacaaaaaa aaaaaaaaaa aaaaaaaaaa aaccttttgc 900
cgcccccccc cccctcaaaa agggtggggc cttataaccg gatatcatca gagccgagtg 960
gcaatagaac tcaaaaaatc cgaaaaaacc cccgagttcc ttttaatgtg ccgg1014
<210>2
<211>240
<212>PRT
<213>Panax notoginseng
<400>2
Met Gly Arg Ser Pro Cys Cys Ala Lys Val Gly Leu Asn Lys Gly Ala
1 5 1015
Trp Thr Ser Val Glu Asp Lys Ile Leu Arg Asp Tyr Ile Lys Leu His
202530
Gly Glu Gly Arg Trp Arg Ser Leu Pro Lys Arg Ala Gly Leu Lys Arg
354045
Cys Gly Lys Ser Cys Arg Leu Arg Trp Leu Asn Tyr Leu Arg Pro Asp
505560
Ile Lys Arg Gly Asn Ile Ser Pro Asp Glu Glu Glu Leu Ile Ile Arg
65707580
Leu His Lys Leu Leu Gly Asn Arg Trp Ser Leu Ile Ala Gly Arg Leu
859095
Pro Gly Arg Thr Asp Asn Glu Ile Lys Asn Tyr Trp Asn Thr Thr Leu
100 105 110
Arg Lys Lys Val His Asp Asn His Ser Ser Ser Ala Ser Ala Pro Ala
115 120 125
Pro Ala Pro Pro Lys Lys Asp Trp Gln Gln Gln Gln His Leu Val Arg
130 135 140
Ser Arg Ser Ala His Glu Trp Asp Asn Lys Ile Asp Asp Ser Ser Ser
145 150 155 160
Lys Ala Glu Glu Lys Tyr Val Ala Lys Glu Cys Ile Ser Pro Ala Ala
165 170 175
Leu Asp Leu Val His Pro Asp Val Glu Phe Cys Leu Thr Glu Leu Leu
180 185 190
Asn Ser Val Phe Trp Gly Leu Phe Glu Asn Pro Leu Gln Pro Glu Ala
195 200 205
Asn Trp Asn Val Gly Asp Phe Val Gln Pro Asn Val Ala Ser Thr His
210 215 220
His Tyr Phe Ala Asn Asn Ile Ser Glu Ser Gly Gly Asp Trp Leu Ser
225 230 235 240
<210>3
<211>25
<212>DNA
<213>人工序列
<400>3
gttccttata tgtagctttc gacat25
<210>4
<211>21
<212>DNA
<213>人工序列
<400>4
ctcctttcaa agaaggcggt c21
<210>5
<211>27
<212>DNA
<213>人工序列
<400>5
gtctgttcgc cccggaagcc tcccagc27
<210>6
<211>25
<212>DNA
<213>人工序列
<400>6
aggaagtaga tagcttttta gtctt25
<210>7
<211>20
<212>DNA
<213>人工序列
<400>7
ccggcacatt aaaaggaact20
<210>8
<211>29
<212>DNA
<213>人工序列
<400>8
ggatccatgg ggaggagccc ttgctgtgc29
<210>9
<211>31
<212>DNA
<213>人工序列
<400>9
gaattctcaa gacagccaat ctcctccgga c 31
<210>10
<211>22
<212>DNA
<213>人工序列
<400>10
ctaccaactg tcttgctccc ct 22
<210>11
<211>22
<212>DNA
<213>人工序列
<400>11
tgatgcagct cttccacctc tc 22
<210>12
<211>21
<212>DNA
<213>人工序列
<400>12
cggatgctgg actataatgt g21
<210>13
<211>22
<212>DNA
<213>人工序列
<400>13
atttacggca atcataccaa cc 22
<210>14
<211>21
<212>DNA
<213>人工序列
<400>14
ggcaggaccc agcacaaaat a21
<210>15
<211>21
<212>DNA
<213>人工序列
<400>15
acacccagaa ggttcaagca a21
<210>16
<211>18
<212>DNA
<213>人工序列
<400>16
tatgagtggg aagggtgc18
<210>17
<211>20
<212>DNA
<213>人工序列
<400>17
tggcgataat tgcttgagta20
<210>18
<211>22
<212>DNA
<213>人工序列
<400>18
caaactcgga agaagtccac gg 22
<210>19
<211>23
<212>DNA
<213>人工序列
<400>19
ggctcattaa caggattgcc aca23
一种三七转录因子基因PnMYB1及其应用专利购买费用说明
![]()
Q:办理专利转让的流程及所需资料
A:专利权人变更需要办理著录项目变更手续,有代理机构的,变更手续应当由代理机构办理。
1:专利变更应当使用专利局统一制作的“著录项目变更申报书”提出。
2:按规定缴纳著录项目变更手续费。
3:同时提交相关证明文件原件。
4:专利权转移的,变更后的专利权人委托新专利代理机构的,应当提交变更后的全体专利申请人签字或者盖章的委托书。
Q:专利著录项目变更费用如何缴交
A:(1)直接到国家知识产权局受理大厅收费窗口缴纳,(2)通过代办处缴纳,(3)通过邮局或者银行汇款,更多缴纳方式
Q:专利转让变更,多久能出结果
A:著录项目变更请求书递交后,一般1-2个月左右就会收到通知,国家知识产权局会下达《转让手续合格通知书》。
动态评分
0.0