IPC分类号 : C07D209/40,C30B29/54
专利摘要
2-(3-氨基-2-氧代吲哚烷-3-基)-3-羟基-1,4-萘醌衍生物及其制备方法,属于化合物合成技术领域。它由如式(Ⅰ)所示的靛红衍生物、如式(Ⅱ)所示的2-羟基-1,4-萘醌和如式(Ⅲ)所示的氨源溶于溶剂中,在回流状态下充分搅拌反应,TLC跟踪至原料反应完全,冷却、抽滤、烘干,即得到目标产物。本发明的制备方法中,反应条件温和、操作简单、后处理方便、收率高,收率最高达到98%以上,得到的产物熔程短,相应的化合物结构经IR、1HNMR、13CNMR及ESI-MS认证,部分目标产物能培养出单晶。
权利要求
1.2-(3-氨基-2-氧代吲哚烷-3-基)-3-羟基-1,4-萘醌衍生物,其特征在于其结构式如式(Ⅳ)所示,
(Ⅳ)
其中,R1为一取代或二取代的取代基,取代基为氢、氟、氯、溴、碘、甲基、甲氧基或三氟甲基,R2为氢或苄基。
2.2-(3-氨基-2-氧代吲哚烷-3-基)-3-羟基-1,4-萘醌衍生物的制备方法,其特征在于将如式(Ⅰ)所示的靛红衍生物、如式(Ⅱ)所示的2-羟基-1,4-萘醌和如式(Ⅲ)所示的氨源溶于溶剂中,在回流状态下充分搅拌反应,TLC跟踪至原料反应完全,冷却、抽滤、烘干,即得到目标产物,其反应方程式为:
其中,式(Ⅰ)中的R1、R2分别与式(Ⅳ)中的R1、R2相同。
3.根据权利要求2所述的2-(3-氨基-2-氧代吲哚烷-3-基)-3-羟基-1,4-萘醌衍生物的制备方法,其特征在于所述的氨源为醋酸铵或氨水,优选为醋酸铵。
4.根据权利要求2所述的2-(3-氨基-2-氧代吲哚烷-3-基)-3-羟基-1,4-萘醌衍生物的制备方法,其特征在于所述的溶剂为水、甲醇、乙醇、异丙醇、二氯甲烷、乙腈或四氢呋喃,优选为乙醇。
5.根据权利要求2所述的2-(3-氨基-2-氧代吲哚烷-3-基)-3-羟基-1,4-萘醌衍生物的制备方法,其特征在于反应时,还加入催化剂。
6.根据权利要求3所述的2-(3-氨基-2-氧代吲哚烷-3-基)-3-羟基-1,4-萘醌衍生物的制备方法,其特征在于催化剂为酸性催化剂或碱性催化剂。
7.根据权利要求6所述的2-(3-氨基-2-氧代吲哚烷-3-基)-3-羟基-1,4-萘醌衍生物的制备方法,其特征在于所述的酸性催化剂为对甲苯磺酸、盐酸、醋酸、氯化铝或氯化镁。
8.根据权利要求6所述的2-(3-氨基-2-氧代吲哚烷-3-基)-3-羟基-1,4-萘醌衍生物的制备方法,其特征在于所述的碱性催化剂为碳酸铯或氨水。
9.根据权利要求2所述的2-(3-氨基-2-氧代吲哚烷-3-基)-3-羟基-1,4-萘醌衍生物的制备方法,其特征在于所述的靛红衍生物、2-羟基-1,4-萘醌和氨源的投料摩尔比为1:1:1~2,优选摩尔比为1:1:1.5。
10.2-(3-氨基-2-氧代吲哚烷-3-基)-3-羟基-1,4-萘醌单晶的培养方法:将化合物(Ⅳ)加入到乙腈溶剂中,然后加入盐酸,抽滤,得到固体,再将其溶于甲醇中,滴加2-5滴四氢呋喃,置于室温下挥发,得到其单晶。
说明书
技术领域
本发明属于化合物合成技术领域,具体涉及一种2-(3-氨基-2-氧代吲哚烷-3-基)-3-羟基-1,4-萘醌衍生物及其制备方法。
背景技术
多组分反应是指三个或更多的化合物以一锅煮的反应方式形成一个包含所有组分主要结构片段的新化合物的过程(Multicomponent Reactions,MCRs)。与传统反应相比,多组分反应更符合原子经济性的原则,而且操作简便,后处理相对方便,在产生分子结构的复杂性和多样性上具有很大的优势。因此,多组分反应在新药设计与合成、组合化学和天然产物合成中具有十分广泛的应用。
3-氨基-2-氧代吲哚结构存在于许多具有生物活性的天然产物和药物中间体中。它具有很多生物活性,例如抗真菌(Eur. J. Med. Chem. 2010, 45, 6120)、抗疟(Science 2010, 329, 1175)、抗结核杆菌(Bioorg. Med. Chem. Lett. 2008, 18, 2342)、抗氧化(Eur. J. Med. Chem. 2010, 45, 1068)、抗结核(Eur. J. Med. Chem. 2010, 45, 5653)、抗肿瘤(E. J. Med. Chem. 2010, 53, 8319)等功效。1,4-萘醌结构同样也是重要的骨架,也具有许多诸如抗细菌(Eur. J. Med. Chem. 2010, 45, 2321)、抗癌(Anti-cancer agents in medicinal chemistry 2006, 6, 489)、抗炎(Annals of tropical medicine and parasitology 1978, 72, 523)、抗血小板(Arch. Pharm. 2000, 333, 87)、抗癣(Chem. Res. Toxicol. 2004, 17, 55)、抗自由基氧化(Pharmacology 2004, 70, 195.)、抗病毒(Bioorg. Med. Chem. 2012, 20, 1740)等功效。
2-(3-氨基-2-氧代吲哚烷-3-基)-3-羟基-1,4-萘醌衍生物,它们均同时含有3-氨基-2-氧代吲哚和1,4-萘醌结构,是具有重要应用价值和生物活性的一类新化合物,但目前尚未见相关报道。
发明内容
本发明的目的在于提供一种反应条件温和、操作简单、后处理方便、收率高的2-(3-氨基-2-氧代吲哚烷-3-基)-3-羟基-1,4-萘醌衍生物的制备方法。
所述的2-(3-氨基-2-氧代吲哚烷-3-基)-3-羟基-1,4-萘醌衍生物,其特征在于其结构式如式(Ⅳ)所示,
(Ⅳ)
其中,R1为一取代或二取代的取代基,取代基为氢、氟、氯、溴、碘、甲基、甲氧基或三氟甲基,R2为氢或苄基。
所述的2-(3-氨基-2-氧代吲哚烷-3-基)-3-羟基-1,4-萘醌衍生物的制备方法,其特征在于将如式(Ⅰ)所示的靛红衍生物、如式(Ⅱ)所示的2-羟基-1,4-萘醌和如式(Ⅲ)所示的氨源溶于溶剂中,在回流状态下充分搅拌反应,TLC跟踪至原料反应完全,冷却、抽滤、烘干,即得到目标产物,其反应方程式为:
其中,式(Ⅰ)中的R1、R2分别与式(Ⅳ)中的R1、R2相同。
所述的2-(3-氨基-2-氧代吲哚烷-3-基)-3-羟基-1,4-萘醌衍生物的制备方法,其特征在于所述的氨源为醋酸铵或氨水,优选为醋酸铵。
所述的2-(3-氨基-2-氧代吲哚烷-3-基)-3-羟基-1,4-萘醌衍生物的制备方法,其特征在于所述的溶剂为水、甲醇、乙醇、异丙醇、二氯甲烷、乙腈或四氢呋喃,优选为乙醇。
所述的2-(3-氨基-2-氧代吲哚烷-3-基)-3-羟基-1,4-萘醌衍生物的制备方法,其特征在于反应时,还加入催化剂。
所述的2-(3-氨基-2-氧代吲哚烷-3-基)-3-羟基-1,4-萘醌衍生物的制备方法,其特征在于催化剂为酸性催化剂或碱性催化剂。
所述的2-(3-氨基-2-氧代吲哚烷-3-基)-3-羟基-1,4-萘醌衍生物的制备方法,其特征在于所述的酸性催化剂为对甲苯磺酸、盐酸、醋酸、氯化铝或氯化镁。
所述的2-(3-氨基-2-氧代吲哚烷-3-基)-3-羟基-1,4-萘醌衍生物的制备方法,其特征在于所述的碱性催化剂为碳酸铯或氨水。
所述的2-(3-氨基-2-氧代吲哚烷-3-基)-3-羟基-1,4-萘醌衍生物的制备方法,其特征在于所述的靛红衍生物、2-羟基-1,4-萘醌和氨源的投料摩尔比为1:1:1~2,优选摩尔比为1:1:1.5。
所述的2-(3-氨基-2-氧代吲哚烷-3-基)-3-羟基-1,4-萘醌单晶的培养方法:将化合物(Ⅳ)加入到乙腈溶剂中,然后加入盐酸,抽滤,得到固体,再将其溶于甲醇中,滴加2-5滴四氢呋喃,置于室温下挥发,得到其单晶。
本发明的有益效果如下:
本发明的制备方法中,反应条件温和、操作简单、后处理方便、收率高,收率最高达到98%以上,得到的产物熔程短,相应的化合物结构经IR、1H NMR、13C NMR及ESI-MS认证,部分目标产物能培养出单晶。
附图说明
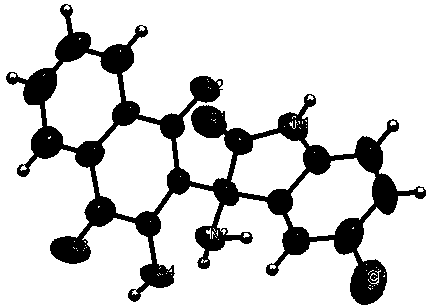
图1为本发明实施例5的目标化合物的单晶结构图。
具体实施方式
结合以下具体实施,对本发明作进一步的详细说明,本发明的保护内容不局限于以下实施例。在不背离发明构思的精神和范围下,本领域技术人员能够想到的变化和优点都被包括本发明中,并且以所附的权利要求书保护范围。实施本发明的过程、条件、试剂、实验方法等,除以下专门提及的内容外,均为本领域的普遍知识和公知常识,本发明没有特别限制内容。
实施例1:(Ⅳ-1)2-(3-氨基-2-氧代吲哚烷-3-基)-3-羟基-1,4-萘醌的制备
将靛红(147mg,1mmol)、2-羟基-1,4-萘醌(174 m g,1mmol)、醋酸铵(116 mg,1.5mmol)加入到乙醇(5ml)中,加热回流,TLC跟踪,2h后反应结束,冷却,抽滤,洗涤,干燥,得到橙色固体产物(Ⅳ-1)2-(3-氨基-2-氧代吲哚烷-3-基)-3-羟基-1,4-萘醌(314 mg,98%),m.p. 266-268℃。
1H NMR (500 MHz, DMSO–d6) δ 10.64 (s, 1H), 9.30 (s, 3H), 7.83 (d, J = 7.5 Hz, 2H), 7.71 (t, J = 7.1 Hz, 1H), 7.59 (td, J = 7.5, 1.2 Hz, 1H), 7.42 (d, J = 7.4 Hz, 1H), 7.25 (td, J = 7.7, 1.1 Hz, 1H), 6.91 (t, J = 7.6 Hz, 1H), 6.87 (d, J = 7.8 Hz, 1H); 13C NMR (126 MHz, DMSO–d6) δ 184.0, 174.6, 142.7, 133.9, 131.0, 130.9, 129.8, 129.1, 125.4, 125.1, 124.6, 121.7, 109.6, 61.3;
ESI-MS (m/z): 321.0 [M+H]+。
上述实施例中,氨源用氨水代替醋酸铵,溶剂用水、甲醇、异丙醇、二氯甲烷、乙腈或四氢呋喃代替乙醇,反应时加入对甲苯磺酸、盐酸、醋酸、氯化铝、氯化镁、碳酸铯或氨水等催化剂,均能得到上述技术效果。
实施例2:(Ⅳ-1)2-(3-氨基-2-氧代吲哚烷-3-基)-3-羟基-1,4-萘醌的制备
同实施例1的操作,加入冰醋酸(0.01ml,0.2mmol),回流2 h后,可得到橙色固体产物(Ⅳ-1)2-(3-氨基-2-氧代吲哚烷-3-基)-3-羟基-1,4-萘醌(299 mg,93%)。
实施例3:(Ⅳ-1)2-(3-氨基-2-氧代吲哚烷-3-基)-3-羟基-1,4-萘醌的制备
同实施例1的操作,加入碳酸铯(65mg,0.2mmol),回流2 h后,可得到橙色固体产物(Ⅳ-1)2-(3-氨基-2-氧代吲哚烷-3-基)-3-羟基-1,4-萘醌(250 mg,78%)。
实施例4:(Ⅳ-1)2-(3-氨基-2-氧代吲哚烷-3-基)-3-羟基-1,4-萘醌的制备
同实施例1的操作,将醋酸铵(116mg,1.5mmol)改为醋酸铵(100 mg,1.3mmol),回流2 h后,可得到橙色固体产物(Ⅳ-1)2-(3-氨基-2-氧代吲哚烷-3-基)-3-羟基-1,4-萘醌(273mg,85%)。
实施例5:(Ⅳ-1)2-(3-氨基-2-氧代吲哚烷-3-基)-3-羟基-1,4-萘醌的制备
同实施例1的操作,将乙醇(5ml)改为水(5ml),回流2 h后,可得到橙色固体产物(Ⅳ-1)2-(3-氨基-2-氧代吲哚烷-3-基)-3-羟基-1,4-萘醌(225mg,70%)。
实施例6:(Ⅳ-1)2-(3-氨基-2-氧代吲哚烷-3-基)-3-羟基-1,4-萘醌的制备
同实施例1的操作,将醋酸铵(116mg,1.5mmol)改为氨水(0.2ml,1.5mmol),回流2.5h后,可得到橙色固体产物(Ⅳ-1)2-(3-氨基-2-氧代吲哚烷-3-基)-3-羟基-1,4-萘醌(273mg,82%)。
实施例7:(Ⅳ-2)2-(3-氨基-4-溴-2-氧代吲哚烷-3-基)-3-羟基-1,4-萘醌的制备
同实施例1的操作,将靛红(147mg,1mmol)改为4-溴靛红(226mg,1mmol),回流3h后,可得到黄色固体产物(Ⅳ-2)2-(3-氨基-4-溴-2-氧代吲哚烷-3-基)-3-羟基-1,4-萘醌(319mg,80%),m.p. 225-226℃。
IR (KBr, cm-1): 3629, 3546, 3467, 3053, 3041, 1776, 1761, 1678, 525;
1H NMR (500 MHz, DMSO–d6) δ 10.95 (s, 1H), 9.90 (s, 3H), 7.85 (d, J = 7.4 Hz, 1H), 7.78 – 7.65 (m, 2H), 7.61 (t, J = 6.6 Hz, 1H), 7.22 (t, J = 7.9 Hz, 1H), 7.15 – 7.04 (m, 1H), 6.92 (d, J = 7.6 Hz, 1H);13C NMR (126 MHz, DMSO–d6) δ 183.6, 178.4, 174.8, 171.8, 145.2, 134.0, 133.3, 131.4, 130.9, 128.2, 125.5, 125.2, 118.5, 109.2, 108.2, 63.4。
ESI-MS (m/z): 398.9 [M+H]+。
实施例8:(Ⅳ-3)2-(3-氨基-4,7-二氯-2-氧代吲哚烷-3-基)-3-羟基-1,4-萘醌的制备
同实施例1的操作,将靛红(147mg,1mmol)改为4,7-二氯靛红(216mg,1mmol),回流4 h后,可得到橙红色固体产物(Ⅳ-3)2-(3-氨基-4,7-二氯-2-氧代吲哚烷-3-基)-3-羟基-1,4-萘醌(300mg,77%),m.p. 233-235℃。
IR (KBr, cm-1): 3631, 3532, 3467, 3058, 3038, 1783, 1747, 1676, 669, 658;
1H NMR (500 MHz, DMSO–d6) δ 11.40 (s, 1H), 9.87 (s, 3H), 7.96 – 7.52 (m, 4H), 7.41 (d, J = 8.7 Hz, 1H), 7.00 (d, J = 8.7 Hz, 1H);13C NMR (126 MHz, DMSO–d6) δ 183.6, 178.4, 174.7, 171.8, 142.5, 134.1, 133.2, 131.6, 131.0, 130.9, 128.6, 127.4, 125.6, 125.3, 123.1, 113.0, 107.9, 63.0。
ESI-MS (m/z): 389.0 [M+H]+。
实施例9:(Ⅳ-4)2-(3-氨基-5-氟-2-氧代吲哚烷-3-基)-3-羟基-1,4-萘醌的制备
同实施例1的操作,将靛红(147mg,1mmol)改为5-氟靛红(165mg,1mmol),回流2 h后,可得到黄色固体产物(Ⅳ-4)2-(3-氨基-5-氟-2-氧代吲哚烷-3-基)-3-羟基-1,4-萘醌(332mg,77%),m.p. 260-262℃。
IR (KBr, cm-1): 3608, 3545, 3448, 3093, 3062, 1718, 1685, 1674, 1437;
1H NMR (500 MHz, DMSO–d6) δ 10.65 (s, 1H), 9.27 (s, 3H), 7.83 (d, J = 7.5 Hz, 2H), 7.71 (t, J = 7.5 Hz, 1H), 7.60 (t, J = 7.5 Hz, 1H), 7.22 (dd, J = 8.1, 2.6 Hz, 1H), 7.10 (td, J = 9.1, 2.6 Hz, 1H), 6.86 (dd, J = 8.5, 4.3 Hz, 1H). 13C NMR (126 MHz, DMSO–d6) δ 184.0, 174.6, 157.7 (d, J = 237.0 Hz), 139.0, 133. 9, 131.1, 130.9, 130.3, 125.4, 125.1, 116.0 (d, J = 23.0 Hz), 112.1 (d, J = 25.0 Hz), 110.4 (d, J = 7.8 Hz), 61.4。
ESI-MS (m/z): 338.9 [M+H]+。
实施例10:(Ⅳ-5)2-(3-氨基-5-氯-2-氧代吲哚烷-3-基)-3-羟基-1,4-萘醌的制备
同实施例1的操作,将靛红(147mg,1mmol)改为5-氯靛红(182mg,1mmol),回流2h后,可得到橙色固体产物(Ⅳ-5)2-(3-氨基-5-氯-2-氧代吲哚烷-3-基)-3-羟基-1,4-萘醌(337mg,95%),m.p. 240-242℃。
IR (KBr, cm-1): 3604, 3569, 3450, 3087, 3016, 1706, 1674, 1616, 613;
1H NMR (500 MHz, DMSO–d6) δ 10.78 (s, 1H), 9.24 (s, 3H), 7.83 (d, J = 7.2 Hz, 2H), 7.71 (t, J = 6.7 Hz, 1H), 7.60 (t, J = 7.2 Hz, 1H), 7.43 (s, 1H), 7.31 (d, J = 7.8 Hz, 1H), 6.89 (d, J = 8.2 Hz, 1H). 13C NMR (126 MHz, DMSO–d6) δ 183.9, 174.3, 141.6, 133.9, 131.0, 130.9, 130.8, 129.5, 125.4, 125.2, 125.1, 124.5, 111.5, 111.0, 99.5, 60.9。
HRMS (ESI) Calcd. for C18H11ClN2O4 ([M+H]+): 355.0486. Found: 355.0488。
实施例11:(Ⅳ-6)2-(3-氨基-5-溴-2-氧代吲哚烷-3-基)-3-羟基-1,4-萘醌的制备
同实施例1的操作,将靛红(147mg,1mmol)改为5-溴靛红(226mg,1mmol),回流2 h后,可得到橙红色固体产物(Ⅳ-6)2-(3-氨基-5-溴-2-氧代吲哚烷-3-基)-3-羟基-1,4-萘醌(359mg,90%),m.p. 228-230℃。
IR (KBr, cm-1): 3629, 3571, 3458, 3068, 3020, 1695, 1651, 1631, 588;
1H NMR (500 MHz, DMSO–d6) δ 10.77 (s, 1H), 9.23 (s, 3H), 7.83 (d, J = 7.4 Hz, 2H), 7.70 (t, J = 7.3 Hz, 1H), 7.63 – 7.51 (m, 2H), 7.42 (dd, J = 8.3, 1.8 Hz, 1H), 6.84 (d, J = 8.3 Hz, 1H). 13C NMR (126 MHz, DMSO–d6) δ 184.0, 174.2, 142.0, 133.9, 132.3, 131.3, 131.1, 130.9, 127.2, 125.5, 125.1, 112.8, 111.6, 61.0。
ESI-MS (m/z): 399.0 [M+H]+。
实施例12:(Ⅳ-7)2-(3-氨基-5-碘-2-氧代吲哚烷-3-基)-3-羟基-1,4-萘醌的制备
同实施例1的操作,将靛红(147mg,1mmol)改为5-碘靛红(273mg,1mmol),回流2h后,可得到橙色固体产物(Ⅳ-7)2-(3-氨基-5-碘-2-氧代吲哚烷-3-基)-3-羟基-1,4-萘醌(388mg,87%),m.p. 197-199℃。
IR (KBr, cm-1): 3606, 3575, 3461, 3030, 3004, 1714, 1672, 1571, 499; 1H NMR (500 MHz, DMSO–d6) δ 10.75 (s, 1H), 9.22 (s, 3H), 7.85 (t, J = 13.5 Hz, 2H), 7.75 – 7.66 (m, 2H), 7.60 (t, J = 8.4 Hz, 2H), 6.73 (d, J = 8.2 Hz, 1H);13C NMR (126 MHz, DMSO–d6) δ 184.0, 174.0, 142.5, 138.1, 133.9, 132.7, 131.6, 131.0, 130.9, 125.4, 125.2, 112.1, 83.8, 60.9。
ESI-MS (m/z): 446.8 [M+H]+。
实施例13:(Ⅳ-8)2-(3-氨基-5-甲基-2-氧代吲哚烷-3-基)-3-羟基-1,4-萘醌的制备
同实施例1的操作,将靛红(147mg,1mmol)改为5-甲基靛红(161mg,1mmol),回流2 h后,可得到橙色固体产物(Ⅳ-8)2-(3-氨基-5-甲基-2-氧代吲哚烷-3-基)-3-羟基-1,4-萘醌(318mg,95%),m.p. 227-229℃。
IR (KBr, cm-1): 3602, 3585, 3469, 3045, 3004, 2630, 1712, 1699, 1639, 1539;
1H NMR (500 MHz, DMSO–d6) δ 10.54 (s, 1H), 9.28 (s, 3H), 7.96 – 7.66 (m, 3H), 7.59 (td, J = 7.5, 1.2 Hz, 1H), 7.24 (s, 1H), 7.05 (dd, J = 7.9, 0.9 Hz, 1H), 6.77 (d, J = 7.9 Hz, 1H), 2.19 (s, 3H). 13C NMR (126 MHz, DMSO–d6) δ 184.1, 174.7, 140.2, 133.9, 131.1, 130.9, 130.6, 130.0, 129.2, 125.4, 125.1, 125.0, 124.0, 109.4, 61.4, 20.5。
ESI-MS (m/z): 334.9 [M+H]+。
实施例14:(Ⅳ-9)2-(3-氨基-5-甲氧基-2-氧代吲哚烷-3-基)-3-羟基-1,4-萘醌的制备
同实施例1的操作,将靛红(147 mg,1mmol)改为5-甲氧基靛红(177mg,1mmol),回流2h后,可得到黄色固体产物(Ⅳ-9)2-(3-氨基-5-甲氧基-2-氧代吲哚烷-3-基)-3-羟基-1,4-萘醌(343mg,95%),m.p. 229-231℃。
IR (KBr, cm-1): 3600, 3537, 3479, 3050, 3024, 2630, 1710, 1691, 1571, 1239;
1H NMR (500 MHz, DMSO–d6) δ 10.47 (s, 1H), 9.25 (s, 3H), 7.83 (d, J = 6.4 Hz, 2H), 7.71 (s, 1H), 7.64 – 7.54 (m, 1H), 7.04 (s, 1H), 6.83 (s, 1H), 6.80 (s, 1H), 3.64 (s, 3H). 13C NMR (126 MHz, DMSO–d6) δ 184.4, 175.0, 155.1, 154.8, 136.2, 134.3, 131.5, 131.1, 130.4, 125.7, 125.5, 125.1, 114.9, 112.6, 111.5, 110.5, 110.2, 61.9, 55.8。
ESI-MS (m/z): 351.0 [M+H]+。
实施例15:(Ⅳ-10)2-(3-氨基-5,7-二甲基-2-氧代吲哚烷-3-基)-3-羟基-1,4-萘醌的制备
同实施例1的操作,将靛红(147mg,1mmol)改为5,7-二甲基靛红(175 mg,1mmol),回流4 h后,可得到橙红色固体产物(Ⅳ-10)2-(3-氨基-5,7-二甲基-2-氧代吲哚烷-3-基)-3-羟基-1,4-萘醌(261mg,75%),m.p. 230-232℃。
IR (KBr, cm-1): 3612, 3527, 3450, 3057, 3033, 2898, 2757,1698, 1630, 1621, 1470, 1454;
1H NMR (500 MHz, DMSO–d6) δ 10.60 (s, 1H), 9.31 (s, 3H), 7.82 (d, J = 7.2 Hz, 2H), 7.70 (s, 1H), 7.59 (t, J = 7.4 Hz, 1H), 7.06 (s, 1H), 6.88 (s, 1H), 2.21 (s, 3H), 2.15 (s, 3H);13C NMR (126 MHz, DMSO–d6) δ 184.9, 175.1, 160.1, 147.1, 138.8, 133.9, 131.8, 131.4, 131.9, 130.9, 130.5, 125.4, 125.2, 122.3, 121.4, 118.6, 117.57, 61.7, 20.5, 16.4。
ESI-MS (m/z): 348.9 [M+H]+。
实施例16:(Ⅳ-11)2-(3-氨基-6-氯-2-氧代吲哚烷-3-基)-3-羟基-1,4-萘醌的制备
同实施例1的操作,将靛红(147mg,1mmol)改为6-氯靛红(182mg,1mmol),回流2 h后,可得到橙色固体产物(Ⅳ-11)2-(3-氨基-6-氯-2-氧代吲哚烷-3-基)-3-羟基-1,4-萘醌(341mg,96%),m.p. 251-253℃。
IR (KBr, cm-1): 3593, 3540, 3477, 3100, 3018, 1731, 1681, 1645, 572;
1H NMR (500 MHz, DMSO–d6) δ 10.80 (s, 1H), 9.28 (s, 3H), 7.83 (d, J = 7.4 Hz, 2H), 7.71 (t, J = 7.3 Hz, 1H), 7.60 (t, J = 7.4 Hz, 1H), 7.40 (d, J = 8.0 Hz, 1H), 6.97 (dd, J = 8.0, 1.7 Hz, 1H), 6.88 (d, J = 1.5 Hz, 1H). 13C NMR (126 MHz, DMSO–d6) δ 184.0, 174.6, 144.2, 134.0, 134.0, 131.1, 130.9, 127.9, 126.1, 125.4, 125.2, 121.4, 109.6, 60.8。
ESI-MS (m/z): 354.9 [M+H]+。
实施例17:(Ⅳ-12)2-(3-氨基-2-氧代-(7-三氟甲基)吲哚烷-3-基)-3-羟基-1,4-萘醌的制备
同实施例1的操作,将靛红(147mg,1mmol)改为7-三氟甲基靛红(175mg,1mmol),回流2 h后,可得到橙色固体产物(Ⅳ-12)2-(3-氨基-2-氧代-(7-三氟甲基)吲哚烷-3-基)-3-羟基-1,4-萘醌(295mg,76%),m.p. 195-197℃。
IR (KBr, cm-1): 3647, 3558, 3483, 3041, 3032, 1695, 1684, 1633, 1454; 1H NMR (500 MHz, DMSO–d6) δ 11.12 (s, 1H), 9.34 (s, 3H), 7.83 (d, J = 7.4 Hz, 2H), 7.70 (dd, J = 14.8, 7.4 Hz, 2H), 7.59 (td, J = 7.5, 1.1 Hz, 1H), 7.53 (d, J = 8.0 Hz, 1H), 7.10 (t, J = 7.7 Hz, 1H);13C NMR (126 MHz, DMSO–d6) δ 184.0, 175.1, 140.1, 134.0, 131.2, 131.0, 130. 9, 128.6, 126.9, 126.2, 125.5, 125.2, 123.61 (q, J = 271.8 Hz), 121.8, 110.5 (q, J = 32.8 Hz), 60.0, 21.0。
ESI-MS (m/z): 389.0 [M+H]+。
实施例18:(Ⅳ-13)2-(3-氨基-1-苄基-2-氧代吲哚烷-3-基)-3-羟基-1,4-萘醌的制备
同实施例1的操作,将靛红(147mg,1mmol)改为(1)-苄基靛红(273mg,1mmol),回流3 h后,可得到橙红色固体产物(Ⅳ-13)2-(3-氨基-1-苄基-2-氧代吲哚烷-3-基)-3-羟基-1,4-萘醌(308mg,75%),m.p. 187-189℃。
IR (KBr, cm-1): 3593, 3560, 3521, 3086, 3066, 3026, 2925, 1714, 1695, 1682;
1H NMR (500 MHz, DMSO–d6) δ 9.44 (s, 3H), 7.85 (d, J = 7.0 Hz, 2H), 7.77 – 7.64 (m, 3H), 7.61 (t, J = 7.2 Hz, 1H), 7.53 (d, J = 7.2 Hz, 1H), 7.39 (t, J = 7.1 Hz, 2H), 7.31 (t, J = 6.8 Hz, 1H), 7.23 (t, J = 7.4 Hz, 1H), 6.98 (t, J = 7.3 Hz, 1H), 6.74 (d, J = 5.5 Hz, 1H);13C NMR (126 MHz, DMSO–d6) δ 184.1, 173.5, 143.3, 136.3, 134.0, 131.2, 130.9, 129.8, 128.5, 127.6, 127.3, 125.5, 125.3, 124.5, 122.5, 109.2, 94.8, 60.9, 43.8。
ESI-MS (m/z): 410.9 [M+H]+。
2-(3-氨基-2-氧代吲哚烷-3-基)-3-羟基-1,4-萘醌衍生物及其制备方法专利购买费用说明
![]()
Q:办理专利转让的流程及所需资料
A:专利权人变更需要办理著录项目变更手续,有代理机构的,变更手续应当由代理机构办理。
1:专利变更应当使用专利局统一制作的“著录项目变更申报书”提出。
2:按规定缴纳著录项目变更手续费。
3:同时提交相关证明文件原件。
4:专利权转移的,变更后的专利权人委托新专利代理机构的,应当提交变更后的全体专利申请人签字或者盖章的委托书。
Q:专利著录项目变更费用如何缴交
A:(1)直接到国家知识产权局受理大厅收费窗口缴纳,(2)通过代办处缴纳,(3)通过邮局或者银行汇款,更多缴纳方式
Q:专利转让变更,多久能出结果
A:著录项目变更请求书递交后,一般1-2个月左右就会收到通知,国家知识产权局会下达《转让手续合格通知书》。
动态评分
0.0