专利摘要
提供结构式所示的升麻素苷‑升麻三萜苷缩合物(CGTG‑40),及其分离纯化方法与其在制药中的用途,特别是在制备抗肺癌的药物中的应用。化合物CGTG‑40对紫杉醇耐药肺癌细胞株A‑549/Taxol的抑制活性IC5024.21±0.61μM。结果表明:化合物CGTG‑40对耐药肺癌细胞株的抑制活性与一线临床药物顺铂的活性相当。
权利要求
1.如下结构式所示的升麻素苷-升麻三萜苷缩合物,
2.药物组合物,其含有权利要求1所述的升麻素苷-升麻三萜苷缩合物作为有效成分,至少还包含一种药学上可接受的载体。
3.权利要求1所述的升麻素苷-升麻三萜苷缩合物在制备抗肿瘤药物中的应用。
4.权利要求1所述的升麻素苷-升麻三萜苷缩合物在制备抗肺癌药物中的应用。
5.权利要求1所述的升麻素苷-升麻三萜苷缩合物的制备方法,取升麻根茎,干燥后粉碎,甲醇加热回流提取三次,减压回收溶剂,得到升麻甲醇提取物浸膏,浸膏用水混悬分散后,以等体积比的乙酸乙酯萃取三次,得到乙酸乙酯总浸膏,继而以等体积的正丁醇萃取三次,得到正丁醇总浸膏,正丁醇总浸膏用适量甲醇溶解后,D-101大孔树脂拌样,装大孔树脂粗划段,以甲醇/水作为流动相,按20%、40%、60%、80%、100%的甲醇/水梯度洗脱,目标化合物主要在80%甲醇/水部分;将80%甲醇/水洗脱部分采用正相硅胶拌样后,装硅胶柱粗分离,以氯仿/甲醇/水9:1:0.1、8:2:0.2、7:3:0.5、6:4:1粗分划段,目标化合物主要富集在8:2:0.2段,将目标组份流份进一步采用反向硅胶RP-18纯化,用适量甲醇溶解后,反向硅胶拌样,装相应反向硅胶柱层析分离,以甲醇/水30%-100%梯度洗脱,得到5个主要部分Fr.1-5,其中70%甲醇/水洗脱下来部分,减压浓缩后得到目标化合物主要富集部分Fr.3,将Fr.3溶解后,正相硅胶拌样,以氯仿/甲醇/水8.5:1.5:0.15等度洗脱,得到化合物的粗品色酮苷-升麻三萜苷缩合物;将得到的粗品,采用半制备液相纯化,得到纯度95%以上的单体纯品。
6.权利要求1所述的升麻素苷-升麻三萜苷缩合物的制备方法,取升麻Cimicifugafoetida L.的干燥根茎,粉碎后用甲醇提取三次,每次4小时;甲醇提取液过滤除去药渣后,减压浓缩至蒸不出甲醇;再加一定量的水稀释之后,水层再用氯仿萃取2-3次,回收氯仿,浓缩得到氯仿提取部位,水相部分再用正丁醇萃取2-3次,回收正丁醇,浓缩得到正丁醇提取部位,正丁醇提取部位用D-101大孔树脂柱层析分离,以甲醇/水作为流动相,按20%(Fr.1)、40%(Fr.2)、60%(Fr.3)、80%(Fr.4)、100%(Fr.5)的甲醇/水梯度洗脱,收集80%甲醇/水流动相洗脱流份,目标化合物即在此部位BuOH-Fr.4;BuOH-Fr.4反复用RP-18和硅胶柱层析分离纯化,得到化合物的粗品升麻素苷-升麻三萜苷缩合物,将粗品采用半制备液相纯化,得到纯度95%以上的单体纯品。
说明书
技术领域
本发明属于药物学领域,具体地,涉及一类从升麻中分离纯化得到的一种升麻素苷- 升麻三萜苷缩合物,及其分离纯化方法及在制药中的用途。
技术背景:
升麻是我国十分常用的著名中药,主要为毛茛科植物三叶升麻Cimicifugaheracleifolia Kom、兴安升麻C.dahurica Maxim、升麻或绿升麻C.foetida L.的干燥根茎。这三种药用植物的根茎,已经作为中药升麻药材,收载入《中华人民共和国药典》 (2015年版)。升麻具有发表透疹,清热解毒,升举阳气的功效;常被用于风热头痛,齿痛,口疮,咽喉肿痛,麻疹不透,阳毒发斑,脱肛,子宫脱垂等病症。升麻Cimicifuga foetida L.主要产于云南、贵州、四川、湖北等地,是大量栽培或野生的常用中药材。
同属植物黑升麻(Cimicifuga racemosa L.),又称蛇根草,在欧美国家也有很长的使用历史。印地安人饮用煎煮的黑升麻药汁解除疲劳,治疗喉痛、关节炎与毒蛇咬伤等症,同时也用于治疗一些妇科疾病,并在1820-1926年被收入到美国药典。英国也将黑升麻载入英国草药典,1749年Linnaeus将黑升麻收入《Materia Medica》,20世纪初成为顺势疗法的主要药物之一。
升麻属植物的化学成分和药理活性研究一直是国内外研究热点。近十年来从其中分离得到三萜及其苷类、苯丙素类、色酮及其他类型化合物200多个。国际上对升麻中化学成分的研究主要集中在其三贴皂苷类成份上,对其药理活性研究则以类雌激素、抗骨质疏松为主。在德国、日本、美国等发达国家都分别开发出了治疗更年期综合症和骨质疏松症的药物。与国际上研究的热点不同,为了拓展升麻三萜化合物研究的新领域,充分利用云南升麻资源,开发其新用途。
发明内容:
本发明的目的在于提供一种从升麻中得到的一种升麻素苷-升麻三萜苷缩合物,及其分离纯化方法及在制药中的用途。
为了实现本发明的上述目的,本发明提供了如下的技术方案:
如下结构式所示的升麻素苷-升麻三萜苷缩合物,
本发明同时提供了一种药物组合物,其含有所述的升麻素苷-升麻三萜苷缩合物作为有效成分,至少还包含一种药学上可接受的载体。
本发明还提供了所述的升麻素苷-升麻三萜苷缩合物在制备抗肿瘤药物中的应用。
以及,所述的升麻素苷-升麻三萜苷缩合物在制备抗肺癌药物中的应用。
此外,本发明提供了所述的升麻素苷-升麻三萜苷缩合物的制备方法,取升麻根茎,干燥后粉碎,甲醇加热回流提取三次,减压回收溶剂,得到升麻甲醇提取物浸膏,浸膏用水混悬分散后,以等体积比的乙酸乙酯萃取三次,得到乙酸乙酯总浸膏,继而以等体积的正丁醇萃取三次,得到正丁醇总浸膏,正丁醇总浸膏用适量甲醇溶解后,D-101大孔树脂拌样,装大孔树脂粗划段,以甲醇/水作为流动相,按20%、40%、60%、80%、100%的甲醇/ 水梯度洗脱,目标化合物主要在80%甲醇/水部分;将80%甲醇/水洗脱部分采用正相硅胶拌样后,装硅胶柱粗分离,以氯仿/甲醇/水9:1:0.1、8:2:0.2、7:3:0.5、6:4:1粗分划段,目标化合物主要富集在8:2:0.2段,将目标组份流份进一步采用反向硅胶RP-18纯化,用适量甲醇溶解后,反向硅胶拌样,装相应反向硅胶柱层析分离,以甲醇/水30%-100%梯度洗脱,得到5个主要部分Fr.1-5,其中70%甲醇/水洗脱下来部分,减压浓缩后得到目标化后主要富集部分Fr.3,将Fr.3溶解后,正相硅胶拌样,以氯仿/甲醇/水8.5:1.5:0.15 等度洗脱,得到化合物的粗品色酮苷-升麻三萜苷缩合物;将得到的粗品,采用半制备液相纯化,得到纯度95%以上的单体纯品。
以及,所述的升麻素苷-升麻三萜苷缩合物的制备方法,取升麻Cimicifugafoetida L. 的干燥根茎,粉碎后用甲醇提取三次,每次4小时;甲醇提取液过滤除去药渣后,减压浓缩至蒸不出甲醇;再加一定量的水稀释之后,水层再用氯仿萃取2-3次,回收氯仿,浓缩得到氯仿提取部位,水相部分再用正丁醇萃取2-3次,回收正丁醇,浓缩得到正丁醇提取部位,正丁醇提取部位用D-101大孔树脂柱层析分离,以甲醇/水作为流动相,按20%(Fr.1)、 40%(Fr.2)、60%(Fr.3)、80%(Fr.4)、100%(Fr.5)的甲醇/水梯度洗脱,收集80%甲醇/水流动相洗脱流份,目标化合物即在此部位BuOH-Fr.4;BuOH-Fr.4反复用RP-18和硅胶柱层析分离纯化,得到化合物的粗品升麻素苷-升麻三萜苷缩合物,将粗品采用半制备液相纯化,得到纯度95%以上的单体纯品。
附图说明
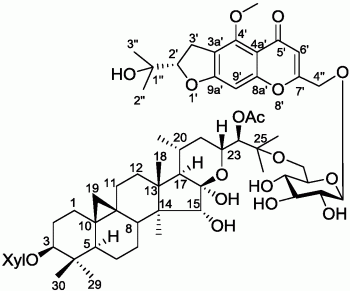
图1为本发明升麻素苷-升麻三萜苷缩合物的结构示意图。
具体实施方式:
下面用本发明的实施例来进一步说明本发明的实质性内容,但并不以此来限定本发明。
实施例1:
本发明从云南省丽江市玉龙县采集的绿升麻(Cimicifuga foetida L.)中分离提纯了一类新型的升麻素苷-升麻三萜苷缩合物,其中化合物CGTG-40,其化学结构鉴定为如图1所示结构。下面是本发明化合物CGTG-40分离制备方法和抗肿瘤药物中的应用例子。
植物特征和样品来源:
绿升麻Cimicifuga foetida L.分布于我国西藏、云南、四川、甘肃、陕西、河南西部和山西等省份。生于海拔1700-3500米间阴湿的山地林缘林中或路旁的草丛中。为多年生草本植物,根状茎粗壮,坚实而稍带木质,外皮黑色,生多数细根。茎单一,常高大,直立,圆柱形,通常在上部少数分枝。叶为一回至三回三出或近羽状复叶,有长柄;小叶卵形、菱形或狭椭圆形,边缘具有粗锯齿。花序为总状花序,通常2-30条集成圆锥状花序。花每年7-8月开放,白色,花瓣状,倒卵状圆形。种子少数,椭圆形至狭椭圆形,黄褐色,通常四周生膜质的鳞翅,背、腹面的横向鳞翅明显或不明显,9-10月成熟。
升麻(Cimicifuga foetida L.)植物样品2012年采自云南省丽江市玉龙县;植物标本由中科院昆明植物研究所裴盛基研究员鉴定。
化合物CGTG-40分离制备方法:
对采集于丽江大具县的升麻根茎,干燥后粉碎,甲醇加热回流提取三次,减压回收溶剂,得到升麻甲醇提取物浸膏。浸膏用水混悬分散后,以等体积比的乙酸乙酯萃取三次,得到乙酸乙酯总浸膏。继而以等体积的正丁醇萃取三次,得到正丁醇总浸膏。正丁醇总浸膏用适量甲醇溶解后,D-101大孔树脂拌样,装大孔树脂粗划段。以甲醇/水作为流动相,按20%、40%、60%、80%、100%的甲醇/水梯度洗脱。目标化合物主要在80%甲醇/水部分。
将80%甲醇/水洗脱部分采用正相硅胶拌样后,装硅胶柱粗分离,以氯仿/甲醇/水9:1:0.1、8:2:0.2、7:3:0.5、6:4:1粗分划段,目标化合物主要富集在8:2:0.2段。将目标组份流份进一步采用反向硅胶RP-18纯化,用适量甲醇溶解后,反向硅胶拌样,装相应反向硅胶柱层析分离,以甲醇/水(30%-100%)梯度洗脱,得到5个主要部分(Fr.1-5)。其中70%甲醇/水洗脱下来部分,减压浓缩后得到目标化后主要富集部分Fr.3。将Fr.3溶解后,正相硅胶拌样,以氯仿/甲醇/水8.5:1.5:0.15等度洗脱,得到化合物的粗品 CGTG-40(升麻素苷-升麻三萜苷缩合物)。
将得到的CGTG-40粗品,采用半制备液相纯化,得到纯度95%以上的CGTG-40单体纯品。
化合物CGTG-40的制备工艺:
从各地野生或栽培的升麻Cimicifuga foetida L.的干燥根茎,粉碎后用甲醇提取三次,每次约4小时;甲醇提取液过滤除去药渣后,减压浓缩至蒸不出甲醇;再加一定量的水稀释之后,水层再用氯仿萃取2-3次,回收氯仿,浓缩得到氯仿提取部位。水相部分再用正丁醇萃取2-3次,回收正丁醇,浓缩得到正丁醇提取部位。正丁醇提取部位用D-101 大孔树脂柱层析分离,以甲醇/水作为流动相,按20%(Fr.1)、40%(Fr.2)、60%(Fr.3)、 80%(Fr.4)、100%(Fr.5)的甲醇/水梯度洗脱。收集80%甲醇/水流动相洗脱流份,目标化合物即在此部位BuOH-Fr.4。
BuOH-Fr.4反复用RP-18和硅胶柱层析分离纯化,得到化合物的粗品CGTG-40(升麻素苷-升麻三萜苷缩合物)。将CGTG-40粗品,采用半制备液相纯化,得到纯度95%以上的CGTG-40单体纯品。
化合物CGTG-40的结构表征:
化合物CGTG-40:C59H86O21;[α]23D+14.7(c 0.20,MeOH)。
其UV、IR、NMR波普数据如下:
紫外光谱:UV(MeOH)λmax(logε)215.0(0.62),240.0(0.44),294.0(0.30);
红外光谱:IR(KBr)νmax3423,2966,2936,1729,1659,1614,1470,1382,1084,1047,562cm
质谱HRESI-MS:1153.5552([M+Na]+),化学式C59H86O21+Na的计算值1153.5554.推定CGTG-40的分子式为:C59H86O21。
氢谱
碳谱
化合物CGTG-40的化学结构如下:
化合物CGTG-40的化学结构为:升麻素-4”-O-β-D-吡喃葡萄糖苷-6
英文命名:
Cimifugin-4”-O-β-D-glycopyranoside-6
其中升麻素(Cimifugin)的化学结构为:(S)-2’,3’-二氢-7’-(羟甲基)-2’-(1”-羟基-1-甲基乙基)-4’-甲氧基-5’H-呋喃并[3’,2’-g][1’]苯并呋喃-5’-酮。 [(S)-2’,3’-Dihydro-7’-(hydroxymethyl)-2’-(1”-hydroxy-1”-methylethyl)-4 ’-methoxy-5’H-furo[3’,2’-g][1’]benzopyran-5’-one。]
为便于使用先使用CGTG-40的代码,指定该化合物复杂结构。
化合物CGTG-40对肿瘤细胞生长抑制作用:
本实验委托中国科学院昆明植物研究所云南省天然药物活性筛选中心完成实验和数据分析处理。
活性筛选模型:
MTS法检测细胞活性原理MTS为一种全新的MTT类似物,全称为3-(4, 5-dimethylthiazol-2-yl)-5(3-carboxymethoxyphenyl)-2-(4-sulfopheny)-2H-tetrazolium,是一种黄颜色的染料。活细胞线粒体中琥珀酸脱氢酶能够代谢还原MTS,生成可溶性的甲臜(Formazan)化合物,甲臜的含量可以用酶标仪在490nm处进行测定。在通常情况下,甲臜生成量与活细胞数成正比,因此可根据光密度OD值推测出活细胞的数目。
实验方法:
1.培养方法:肺癌紫杉醇耐药株A-549/Taxol用含10%胎牛血清加20ng/ml紫杉醇的培养液(RMPI1640)培养,无酚红的胰酶消化传代,其它培养条件与普通细胞株相同。
2.接种细胞:用含10%胎牛血清的培养液(DMEM或者RMPI1640)配成单个细胞悬液,以每孔3000~5000个细胞接种到96孔板,每孔体积100μl,细胞提前12~24小时接种培养。
3.加入待测化合物溶液:化合物用DMSO溶解,化合物以40μM、8μM、1.6μM、0.32μM、0.064μM浓度复筛,每孔终体积200μl,每种处理均设3个复孔。
4.显色:37摄氏度培养48小时后,细胞弃孔内培养液,每孔加MTS溶液20μl和培养液100μl;设3个空白复孔(MTS溶液20μl和培养液100μl的混合液),继续孵育2~4 小时,使反应充分进行后测定光吸收值。
5.比色:选择492nm波长,多功能酶标仪(MULTISKAN FC)读取各孔光吸收值,记录结果,数据处理后以浓度为横坐标,细胞存活率为纵坐标绘制细胞生长曲线,应用两点法(Reed and Muench法)计算化合物的IC50值。
6.阳性对照化合物:每次实验均设顺铂(DDP)和紫杉醇(Taxol)两个阳性化合物,以浓度为横坐标,细胞存活率为纵坐标绘制细胞生长曲线,应用两点法(Reed and Muench法)计算化合物的IC50值。
活性结果:化合物CGTG-40对紫杉醇耐药肺癌细胞株A-549/Taxol的抑制活性IC5024.21±0.61μM。而阳性对照顺铂对紫杉醇耐药肺癌细胞株A-549/Taxol的抑制活性IC5025.80±1.15μM。而紫杉醇对此紫杉醇耐药肺癌细胞株A-549/Taxol的抑制活性 IC50值0.60±0.09μM。结果表明:化合物CGTG-40对耐药肺癌细胞株的抑制活性与一线临床药物顺铂的活性相当。
制剂实施例1:
按制备实施例1的方法制备得到化合物CGTG-40,分别或混合用少量的DMSO溶解后,按常规加注射用水,精滤,灌封灭菌制成注射液。
制剂实施例2:
按制备实施例1的方法先制备得到化合物CGTG-40,分别或混合用少量的DMSO溶解后,将其溶于无菌注射用水中,搅拌使溶解,用无菌抽滤漏斗过滤,再无菌精滤,分装于安瓿中,低温冷冻干燥后无菌熔封得粉针剂。
制剂实施例3:
按制备实施例1的方法先制备得到化合物CGTG-40,分别或混合按其与赋形剂重量比为9:1的比例加入赋形剂,制成粉剂。
制剂实施例4:
按制备实施例1的方法先制备得到化合物CGTG-40,分别或混合按其与赋形剂重量比为5:1的比例加入赋形剂,制粒压片。
制剂实施例5:
按制备实施例1的方法先制备得到化合物CGTG-40,分别或混合按常规口服液制法制成口服液。
制剂实施例6:
按制备实施例1的方法先制得化合物CGTG-40,分别或混合按其与赋形剂重量比为5:1的比例加入赋形剂,制成胶囊。
制剂实施例7:
按制备实施例1的方法先制得化合物CGTG-40,分别或混合按其与赋形剂重量比为3:1的比例加入赋形剂,制成胶囊。
制剂实施例8:
按制备实施例1的方法先制备化合物CGTG-40,按其与赋形剂重量比为5:1的比例加入赋形剂,制成颗粒剂。
一种升麻素苷-升麻三萜苷缩合物及其分离纯化方法及用途专利购买费用说明
![]()
Q:办理专利转让的流程及所需资料
A:专利权人变更需要办理著录项目变更手续,有代理机构的,变更手续应当由代理机构办理。
1:专利变更应当使用专利局统一制作的“著录项目变更申报书”提出。
2:按规定缴纳著录项目变更手续费。
3:同时提交相关证明文件原件。
4:专利权转移的,变更后的专利权人委托新专利代理机构的,应当提交变更后的全体专利申请人签字或者盖章的委托书。
Q:专利著录项目变更费用如何缴交
A:(1)直接到国家知识产权局受理大厅收费窗口缴纳,(2)通过代办处缴纳,(3)通过邮局或者银行汇款,更多缴纳方式
Q:专利转让变更,多久能出结果
A:著录项目变更请求书递交后,一般1-2个月左右就会收到通知,国家知识产权局会下达《转让手续合格通知书》。
动态评分
0.0