IPC分类号 : C08J3/075,C08J3/24,C08L3/10,C08L5/00,C08L89/00,A61K9/06,A61K47/36,A61K47/42
专利摘要
本发明公开了一种双醛多糖纳米颗粒交联胶原水凝胶及其制备方法。首先将多糖进行胆固醇基团疏水改性,然后利用高碘酸钠特异性地将多糖氧化以制备具有双醛结构的两亲性多糖衍生物,之后将其于水溶液中自组装形成具有核壳结构的双醛多糖纳米颗粒;接着将质量分数为3%~6%的双醛多糖纳米颗粒溶液和0.4%~0.9%胶原溶液按体积比为1:(0.5~1.5)混合搅拌均匀,于30~37℃放置24h制备得到双醛多糖纳米颗粒交联胶原水凝胶。本发明的优点是:以绿色无害的双醛多糖纳米颗粒作为交联剂,制备的水凝胶孔径均一,机械性能良好,生物相容性好,其在组织工程支架材料领域具有良好的应用前景。
权利要求
1.一种双醛多糖纳米颗粒交联胶原水凝胶,其特征在于:以I型胶原制得的质量分数为0.4%~0.9%的胶原水溶液和以双醛多糖纳米颗粒制得的质量分数为3%~6%的双醛多糖纳米颗粒水溶液,胶原水溶液和双醛多糖纳米颗粒水溶液按质量比为1:(0.5~1.5)混合搅拌均匀,基于席夫碱化学交联反应活性制备得到胶原水凝胶。
2.根据权利要求1所述的一种双醛多糖纳米颗粒交联胶原水凝胶的制备方法,其特征在于,包括如下步骤:
(1)制备胶原水溶液:将I型胶原溶解于0.25M的醋酸水溶液中制备质量分数为0.4%~0.9%的胶原水溶液,然后使用2M的氢氧化钠溶液冰浴条件下缓慢调节胶原水溶液pH至中性;
(2)制备双醛多糖纳米颗粒溶液:100℃油浴搅拌条件下,将1~5质量份多糖溶解于50质量份熔融咪唑中稳定30min制备得到1%~10%澄清透明的多糖溶液;
向体系中加入胆固醇氯甲酸酯,胆固醇氯甲酸酯与多糖分子脱水单元(AGU)的摩尔比为(0.005~0.05):1;
于90~110℃下搅拌1~3h,反应结束后用过量乙醇沉淀,过滤和洗涤4~6次后于40~70℃下烘干得到两亲性多糖衍生物;
将两亲性多糖衍生物分散于水中得到质量浓度为1%~10%的多糖衍生物溶液,加入高碘酸钠,高碘酸钠与多糖分子脱水单元(AGU)摩尔比为0.1~1.0,于30~45℃下避光反应2~5h,反应结束后透析、冷冻干燥制备得到胆固醇接枝的两亲性双醛多糖衍生物;将两亲性双醛多糖衍生物直接溶于去离子水中自组装得到质量分数为3%~6%的双醛多糖纳米颗粒水溶液;
(3)胶原基水凝胶的制备:取上述质量分数为0.4%~0.9%的胶原水溶液,在冰浴条件下加入质量分数为3%~6%的双醛多糖纳米颗粒水溶液,按质量比为1:(0.5~1.5)混合搅拌均匀,30~37℃放置24h制备得到多糖纳米交联胶原水凝胶。
3.根据权利要求2所述的一种双醛多糖纳米颗粒交联胶原水凝胶的制备方法,其特征在于:所述多糖为淀粉、羟乙基淀粉、海藻酸钠、黄原胶、普鲁兰多糖、葡聚糖、壳聚糖、瓜尔豆胶和卡拉胶的任意一种或几种混合物。
说明书
技术领域
本发明涉及水凝胶技术领域,特别涉及一种孔径均一,机械性能良好,生物相容性好的可用应用于医用敷料、药物释放及组织支架领域的双醛多糖纳米颗粒交联胶原水凝胶,还涉及该水凝胶的制备方法。
背景技术
胶原(Collagen)是动物体内含量最多的蛋白质,约占肌体蛋白质的三分之一,广泛存在于哺乳动物的皮肤、软骨、肌腱、内脏细胞间质和韧带等组织中。胶原因其具有低免疫原性、良好的生物相容性和生物降解性等优良性能,使其在伤口敷料、药物输送载体、组织工程、化妆品等生物材料领域获得到了广泛的应用。目前已发现27种不同结构的胶原,其中I型胶原是已发现的所有类型的胶原中含量最多(约占生物体胶原总量的90%)、分布最广、研究最多和应用最广的一种胶原。
在生理条件下,胶原可以自组装形成胶原纤维,胶原纤维能进一步形成三维网络结构,并束缚住填充在其间的水,使溶液转变为水凝胶。胶原水凝胶高度含水的网络状结构与天然组织的性质相似且能够生物降解。因此,胶原水凝胶在组织工程领域的应用引起了广泛的关注。科研工作者们希望将胶原水凝胶作为细胞外基质的临时替代材料使用,实现体外细胞培养和组织的再生。因此,胶原水凝胶常被作为组织填充物、支架材料、药物载体而广泛应用于组织工程、伤口敷料、药物缓释等生物医药领域。然而,纯胶原水凝胶的应用往往受限于其较差的力学性能、较高的溶胀度和过快的生物降解速率等。化学交联改性能够使胶原水凝胶内部形成致密的空间网络状结构,进而有效改善其上述缺陷。因此,通常采用戊二醛、多酚和氧化多糖作交联剂来固定胶原以克服上述缺点。但是,由于快速的交联反应、静电相互作用和氢键作用等,胶原一旦与交联剂接触就不可避免地发生局部絮凝,影响胶原水凝胶内部均匀的空间网络状结构,进而影响水凝胶的理化性能。基于此,本发明提供一种以新型双醛多糖纳米颗粒作为交联剂,化学交联改性胶原制备得到具有较高力学强度、较低溶胀度、良好生物相容性的胶原水凝胶。
发明内容
本发明针对现有技术的缺陷,提供了一种双醛多糖纳米颗粒交联胶原水凝胶及其制备方法,解决了现有技术中存在的缺陷。
为了实现以上发明目的,本发明采取的技术方案如下:
一种双醛多糖纳米颗粒交联胶原水凝胶,包括:以I型胶原制得的质量分数为0.4%~0.9%的胶原水溶液和以双醛多糖纳米颗粒制得的质量分数为3%~6%的双醛多糖纳米颗粒水溶液,胶原水溶液和双醛多糖纳米颗粒水溶液按质量比为1:(0.5~1.5)混合搅拌均匀,基于席夫碱化学交联反应活性制备得到胶原水凝胶。
本发明还公开了双醛多糖纳米颗粒交联胶原水凝胶的制备方法,包括如下步骤:
(1)制备胶原水溶液:将I型胶原溶解于0.25M的醋酸水溶液中制备质量分数为0.4%~0.9%的胶原水溶液,然后使用2M的氢氧化钠溶液冰浴条件下缓慢调节胶原水溶液pH至中性;
(2)制备双醛多糖纳米颗粒溶液:100℃油浴搅拌条件下,将1~5质量份多糖溶解于50质量份熔融咪唑中稳定30min制备得到1%~10%澄清透明的多糖溶液;向体系中加入胆固醇氯甲酸酯(胆固醇氯甲酸酯与多糖分子脱水单元(AGU)的摩尔比为(0.005~0.05):1),于90~110℃下搅拌1~3h,反应结束后用过量乙醇沉淀,过滤和洗涤4~6次后于40~70℃下烘干得到两亲性多糖衍生物;将两亲性多糖衍生物分散于水中得到质量浓度为1%~10%的多糖衍生物溶液,加入高碘酸钠(高碘酸钠与AGU摩尔比为0.1~1.0),于30~45℃下避光反应2~5h,反应结束后透析、冷冻干燥制备得到胆固醇接枝的两亲性双醛多糖衍生物;将两亲性双醛多糖衍生物直接溶于去离子水中自组装得到质量分数为3%~6%的双醛多糖纳米颗粒水溶液;
(3)胶原基水凝胶的制备:取上述质量分数为0.4%~0.9%的胶原水溶液,在冰浴条件下加入质量分数为3%~6%的双醛多糖纳米颗粒水溶液,按质量比为1:(0.5~1.5)混合搅拌均匀,30~37℃放置24h制备得到多糖纳米交联胶原水凝胶。
作为优选,所述多糖为淀粉、羟乙基淀粉、海藻酸钠、黄原胶、普鲁兰多糖、葡聚糖、壳聚糖、瓜尔豆胶和卡拉胶的任意一种或几种混合物。
与现有技术相比,本发明的优点在于:
(1)通过双醛多糖纳米颗粒交联改性胶原制备胶原水凝胶,不仅可以有效克服交联剂与胶原快速反应和静电相互作用等引起的胶原絮凝,而且能够避免小分子醛交联剂由于游离析出而引起的细胞毒性等问题,满足生物材料领域的应用要求。
(2)本发明提供的双醛多糖纳米颗粒交联胶原水凝胶,双醛多糖纳米颗粒的醛基可以与胶原的氨基发生席夫碱反应以化学交联改性胶原,形成致密的空间网络状结构;更重要的是双醛多糖纳米颗粒可作为纳米粒子填充剂进一步改善胶原水凝胶的力学强度、溶胀度和生物降解性能等。
(3)在分子自组装形成双醛多糖纳米颗粒的过程中可以实现对小分子药物的包裹,进而赋予双醛多糖纳米颗粒交联胶原水凝胶定向给药的功能。
附图说明
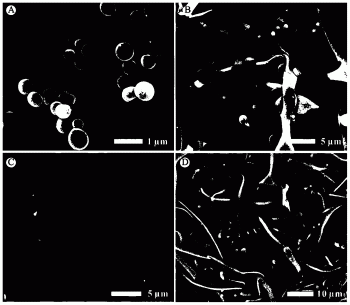
图1为双醛淀粉-胆固醇纳米颗粒的SEM照片:
(A)和(B)为相同胆固醇接枝量(0.01mol/mol AGU)不同氧化程度的照片:(A)氧化度46%,(B)氧化度87%;(C)和(D)为相同氧化度(46%)不同胆固醇接枝量照片:(C)0.005mol/mol AGU,(D)0.02mol/mol AGU;
图2为不同水凝胶冻干后的SEM照片;(A)纯胶原水凝胶(Col),(B)氧化淀粉交联改性胶原水凝胶(OS/Col),(C)双醛淀粉-胆固醇纳米颗粒交联改性胶原水凝胶(OCSNPs/Col);
图3为不同水凝胶样品在压缩模式下的应力-应变曲线图和压缩破坏强度对比图;(A)为应力-应变曲线图(B)压缩破坏强度对比图;
图4为L929细胞在不同水凝胶浸提液中培养24h和72h的细胞存活率示意图;
图5为L929细胞在不同水凝表面培养24h后被钙黄绿素细胞染液染色后的明场显微图和荧光显微图,其中左边为明场显微图,右边为荧光显微图。
具体实施方式
为使本发明的目的、技术方案及优点更加清楚明白,以下列举实施例,对本发明做进一步详细说明。
本发明采用简单方便、绿色高效的方法制备双醛多糖纳米颗粒交联剂。在熔融咪唑中,通过疏水剂胆固醇氯甲酸酯的酰氯基与多糖分子骨架链上的羟基发生酯化反应,制备得到多糖-胆固醇聚合物。熔融咪唑能够快速完全地溶解多糖,提供均匀的反应介质,而均相反应介质是制备纯度较高的多糖酯的重要条件。咪唑在反应体系中除了作为溶剂外,还作为反应介质参与咪唑-胆固醇复合物中间体的形成,该中间体有利于与多糖分子的下一步快速完全反应,极大提升了反应速率。除此之外,咪唑还作为碱性物质用于与反应所得副产物盐酸结合以促进酯化反应的正向进行。这步酯化反应中只占用了多糖分子约百分之一的羟基,因此还留有充足的邻二羟基供后续高碘酸钠氧化反应正常进行。高碘酸钠能够特异性地将多糖-胆固醇聚合物中的邻二羟基氧化成醛基,制备得到双醛多糖-胆固醇聚合物。通过直接溶解法,在完全不引入任何有机溶剂,保证产品绿色安全的前提下实现两亲性聚合物双醛多糖-胆固醇聚合物自组装形成双醛多糖纳米颗粒。胆固醇疏水段之间的分子内或分子间的吸引作用促进了两亲性聚合物的自组装过程。疏水段的胆固醇倾向于聚集在颗粒的核心,而亲水性的双醛多糖链则组成颗粒的外壳,亲水性的外壳对内核起到了保护的作用,增强了双醛多糖纳米颗粒的水溶性。双醛多糖纳米颗粒不仅可以化学交联改性胶原,而且由于其纳米级尺寸和高比表面积的特性能够进一步提高胶原水凝胶的理化性能。此外,在分子自组装形成双醛多糖纳米颗粒的过程中,可以实现对小分子药物的包裹,进而赋予其交联胶原制备的水凝胶定向给药的功能。因此,以双醛多糖纳米颗粒作为交联剂,制备的胶原水凝胶在生物材料等领域的应用具有优势。
本发明以天然生物高分子为原材料,首先在熔融咪唑中将胆固醇化学接枝于多糖分子链上,制备得到多糖-胆固醇聚合物。然后采用高碘酸钠特异性地将多糖氧化以制备得到双醛多糖-胆固醇聚合物。之后利用两亲性聚合物双醛多糖-胆固醇聚合物自组装形成双醛多糖纳米颗粒。通过调节双醛多糖-胆固醇聚合物中胆固醇和醛基的引入量,控制双醛多糖纳米颗粒的粒径。基于双醛多糖纳米颗粒的醛基与胶原分子的氨基间的席夫碱化学交联反应活性,制备得到理化性能优异且生物相容性好的双醛多糖纳米颗粒交联胶原水凝胶。
实施例1
(1)制备胶原水溶液:将胶原蛋白溶解于0.25M的醋酸水溶液中制备质量分数为0.6%的胶原蛋白醋酸水溶液,用2M的氢氧化钠溶液冰浴条件下缓慢调节pH至中性,得到胶原水溶液。
(2)制备双醛淀粉纳米颗粒溶液:100℃油浴搅拌条件下,将5质量份可溶性淀粉溶解于50质量份熔融咪唑中稳定30min制备得到10%澄清透明的淀粉溶液。向体系中加入胆固醇氯甲酸酯(其中,胆固醇氯甲酸酯与淀粉分子脱水单元(AGU)的摩尔比为0.02:1),于100℃下搅拌1h,反应结束用过量乙醇沉淀过滤,洗涤5次后于60℃下烘干得到两亲性淀粉衍生物。将两亲性淀粉衍生物分散于水中得到质量浓度为8%的多糖衍生物溶液,加入高碘酸钠(其中,高碘酸钠与AGU摩尔比为0.5:1),于37℃下避光反应4h,反应结束后透析、冷冻干燥制备得到胆固醇接枝的两亲性双醛淀粉衍生物,将两亲性双醛淀粉衍生物直接溶于去离子水中自组装得到质量分数为4%的双醛淀粉纳米颗粒水溶液。
(3)胶原基水凝胶的制备:取上述调节pH后的质量分数为0.6%的中性胶原溶液,在冰浴条件下加入质量分数为4%的双醛淀粉纳米颗粒水溶液,按质量比为1:1.2混合搅拌均匀,30℃孵化24h得到双醛淀粉纳米交联胶原水凝胶。
实施例2
(1)制备胶原水溶液:将胶原蛋白溶解于0.25M的醋酸水溶液中制备质量分数为0.5%的胶原蛋白醋酸水溶液,用2M的氢氧化钠溶液冰浴条件下缓慢调节pH至中性,得到胶原水溶液。
(2)制备双醛黄原胶纳米颗粒溶液:100℃油浴搅拌条件下,将4质量份可溶性淀粉溶解于50质量份熔融咪唑中稳定30min制备得到8%澄清透明的黄原胶溶液。向体系中加入胆固醇氯甲酸酯(其中,胆固醇氯甲酸酯与黄原胶分子脱水单元(AGU)的摩尔比为0.04:1),于90℃下搅拌2.5h,反应结束用过量乙醇沉淀过滤,洗涤5次后于40℃下烘干得到两亲性黄原胶衍生物。将两亲性黄原胶衍生物超声分散于水中得到质量浓度为6%的黄原胶衍生物溶液,加入高碘酸钠(其中,高碘酸钠与AGU摩尔比为0.4:1),于40℃下避光反应4h,反应结束后透析、冷冻干燥制备得到胆固醇接枝的两亲性双醛黄原胶衍生物,将两亲性双醛黄原胶衍生物用探针式超声仪分散在去离子水中,自组装得到质量分数为4%的双醛黄原胶纳米颗粒水溶液。
(3)胶原基水凝胶的制备:取上述调节pH后的质量分数为0.5%的中性胶原溶液,在冰浴条件下加入质量分数为4%的双醛黄原胶纳米颗粒水溶液,按质量比为1:1混合搅拌均匀,37℃孵化24h得到双醛黄原胶纳米交联胶原水凝胶。
实施例3
(1)制备胶原水溶液:将胶原蛋白溶解于0.25M的醋酸水溶液中制备质量分数为0.6%的胶原蛋白醋酸水溶液,用2M的氢氧化钠溶液冰浴条件下缓慢调节pH至中性,得到胶原水溶液。
(2)制备双醛海藻酸纳米颗粒溶液:100℃油浴搅拌条件下,将3质量份可溶性淀粉溶解于50质量份熔融咪唑中稳定30min制备得到6%澄清透明的海藻酸钠溶液。向体系中加入胆固醇氯甲酸酯(其中,胆固醇氯甲酸酯与海藻酸钠分子脱水单元(AGU)的摩尔比为0.01:1),于100℃下搅拌1.5h,反应结束用过量乙醇沉淀、离心去除上清液,洗涤5次后离心沉淀于40℃下烘干得到两亲性海藻酸钠衍生物。将两亲性海藻酸钠衍生物分散于水/乙醇混合溶液中得到质量浓度为4%的多糖衍生物溶液,加入高碘酸钠(其中,高碘酸钠与AGU摩尔比为1:1),于40℃下避光反应4h,反应结束后透析、冷冻干燥制备得到胆固醇接枝的两亲性双醛海藻酸钠衍生物,将两亲性双醛海藻酸钠衍生物直接溶于去离子水中超声自组装制备得到质量分数为2%的双醛淀粉纳米颗粒水溶液。
(3)胶原基水凝胶的制备:取上述调节pH后的质量分数为0.6%的中性胶原溶液,在冰浴条件下加入质量分数为2%的双醛淀粉纳米颗粒水溶液,按质量比为1:1混合搅拌均匀,37℃孵化24h得到双醛淀粉纳米交联胶原水凝胶。
本发明提供以下实验数据,该数据均是以淀粉作为多糖代表得出的实验结果:
如图1所示,两亲性聚合物双醛多糖-胆固醇聚合物能够在水溶液中自组装形成双醛多糖纳米颗粒,且双醛多糖-胆固醇聚合物的醛基含量和胆固醇接枝量决定双醛多糖纳米颗粒的粒径和形貌。
如图2所示,OCSNPs/Col较OS/Col和Col水凝胶有更多的孔隙结构,且孔径均一性也是三者中最好的。较均匀的孔径分布有利于细胞的一致生长,也利于抵消承受的压力,从而表现出较高的机械强度。
如图3所示,OCSNPs/Col水凝胶的力学强度较OS/Col和Col水凝胶有了很大的改善,其压缩破坏强度可以达到70.8kPa,与OS/Col水凝胶相比提高了近26kPa。
如图4所示,L929细胞在不同水凝胶中培养24h和72h后,细胞存活率均在95%以上,且各组之间没有太大差异,表明两种改性胶原水凝胶在实验浓度范围内基本不具有细胞毒性。
如图5所示,L929细胞与OCSNPs/Col水凝胶共培养24h后,L929细胞在水凝胶表面生长存活情况良好,呈典型的梭形,表明OCSNPs/Col水凝胶具有良好的细胞相容性。
本领域的普通技术人员将会意识到,这里所述的实施例是为了帮助读者理解本发明的实施方法,应被理解为本发明的保护范围并不局限于这样的特别陈述和实施例。本领域的普通技术人员可以根据本发明公开的这些技术启示做出各种不脱离本发明实质的其它各种具体变形和组合,这些变形和组合仍然在本发明的保护范围内。
一种双醛多糖纳米颗粒交联胶原水凝胶及其制备方法专利购买费用说明
![]()
Q:办理专利转让的流程及所需资料
A:专利权人变更需要办理著录项目变更手续,有代理机构的,变更手续应当由代理机构办理。
1:专利变更应当使用专利局统一制作的“著录项目变更申报书”提出。
2:按规定缴纳著录项目变更手续费。
3:同时提交相关证明文件原件。
4:专利权转移的,变更后的专利权人委托新专利代理机构的,应当提交变更后的全体专利申请人签字或者盖章的委托书。
Q:专利著录项目变更费用如何缴交
A:(1)直接到国家知识产权局受理大厅收费窗口缴纳,(2)通过代办处缴纳,(3)通过邮局或者银行汇款,更多缴纳方式
Q:专利转让变更,多久能出结果
A:著录项目变更请求书递交后,一般1-2个月左右就会收到通知,国家知识产权局会下达《转让手续合格通知书》。
动态评分
0.0