专利摘要
本发明公开了漾濞大泡核桃几丁质酶基因JsCHI1及应用,JsCHI1基因的核苷酸序列如SEQIDNO:1所示,编码几丁质酶,本发明通过功能基因组学相关技术研究证实JsCHI1基因具有提高植物抗真菌侵染的功能,将本发明抗真菌JsCHI1基因构建到植物表达载体上并转入烟草中过量表达,转基因烟草植株具有很强的体外抗真菌活性;JsCHI1超表达的转基因烟草对茄腐镰刀菌、尖孢镰刀菌、葡萄座腔菌以及串珠状赤霉菌的生长具有明显的抑制作用。
权利要求
1.一种漾濞大泡核桃几丁质酶基因JsCHI1,其特征在于:其核苷酸序列如SEQ ID NO :1所示。
2.权利要求1所述的漾濞大泡核桃几丁质酶基因JsCHI1在提高烟草对茄腐镰刀菌、尖孢镰刀菌、葡萄座腔菌、串珠状赤霉菌抗性中的应用。
3.根据权利要求2所述的漾濞大泡核桃几丁质酶基因JsCHI1的应用,其特征在于提高烟草的真菌抗性的具体操作如下:
(1)将漾濞大泡核桃几丁质酶基因JsCHI1与植物超表达载体pCAMBIA2300S连接,构建植物超表达载体;
(2)将上述构建的重组载体通过根癌农杆菌介导转入烟草中;
(3)以重组载体T-DNA上具有的卡那霉素抗性基因来筛选转化子,并通过聚合酶链式反应筛选获得阳性转基因植株,接种特定病原真菌,分析转基因烟草蛋白对真菌生长的抑制活性,最后筛选出对真菌抗性明显增强的转基因植株。
说明书
技术领域
本发明涉及分子生物学以及基因工程相关技术研究领域,特别是具有抗真菌活性的漾濞大泡核桃几丁质酶基因JsCHI1及应用。
背景技术
植物病害是农业生产中一个非常棘手的问题。兴起于20世纪初期的经典遗传学使人们能够通过杂交育种成功培育出新的抗病品种,大幅度地提高粮食产量。近年来,随着分子生物学理论和技术的不断发展完善,可通过基因工程这一现代生物技术直接、快速和高效地培育抗病作物品种,是提高植物抗病性的一种新方法。
几丁质酶(chitinase)普遍存在于细菌、真菌、昆虫、植物中,可以水解几丁质中的β-1,4糖苷键产生几丁质单糖-N-乙酰氨基葡萄糖(N-acetyl glucosamine, NAG)。典型的植物几丁质酶氨基酸序列包括一个N端信号区(也称催化区)和一个C端结构域(只存在于液泡几丁质酶中)。部分几丁质酶在N端信号区之后还包含一个到多个几丁质结合结构域(chitin-binding domain, CBD),且在CBD与N端催化区之间存在一个可变连接区。每个结构域都有不同的功能(Xu F, Fan C, He Y. Chitinases in Oryza sativa ssp. japonica and Arabidopsis thaliana. Journal of genetics and genomics. 2007, 34: 138–150.)。
根据等电点的差异,几丁质酶被分为酸性和碱性几丁质酶。根据作用位点的不同,几丁质酶被分为内切几丁质酶和外切几丁质酶。基于蛋白质结构特性的分类则经过多次修正,现如今,根据初级结构特性、底物专一性、催化机制以及对抑制剂的敏感性,几丁质酶被分为七类:Class I~Class VII。Class I几丁质酶结构较为典型,包含一个富含半胱氨酸的N端结构域,可以与几丁质结合,大多定位于液泡并对真菌生长有很强的抑制作用。Class II几丁质酶一般为酸性,并在合成后分泌到胞外。可以水解真菌菌丝中的几丁质并释放出真菌激发因子,作为植物应对真菌侵害的第一步防御反应。Class III几丁质酶同样为胞外水解酶,但其催化区的氨基酸序列与Class I和II几丁质酶不同,具有一个含4个天冬氨酸和谷氨酸残基的特异活性部位。Class III几丁质酶同时具有溶菌酶和几丁质酶活性(Liliane BDA, Sachetto-Martins G, Contarini MG, Sandroni M, Ferreira RDP, de Lima VM, Cordeiro MC, de Oliveira DE, Margis-Pinheiro M. Arabidopsis thaliana class IV chitinase is early induced during the interaction with Xanthomonas campestris. FEBS letters. 1997, 419: 69–75.)。Class IV几丁质酶在几丁质结合区有缺失,合成后分泌到胞外。Class V几丁质酶与其它几丁质酶相比,多一个小的插入结构域。Class VI和VII几丁质酶与其它几丁质酶的相似性较低,且成员较少。
植物几丁质酶基因的表达受多种内外因子的诱导。拟南芥(Arabidopsis thaliana) class V几丁质酶基因,AtCHiC的表达受脱落酸和茉莉酸的诱导(Ohnuma T, Numata T, Osawa T, Mizuhara M, Lampela O, Juffer AH, Skriver K, Fukamizo T. A class V chitinase from Arabidopsis thaliana: gene responses, enzymatic properties, and crystallographic analysis. Planta. 2011, 234: 123–137.)。主要在红花(Crocus sativus)根和球茎中表达的几丁质酶基因SafchiA的表达受真菌激发因子、茉莉酸甲酯、物理伤害以及真菌侵染的诱导(López RC, Gómez-Gómez L. Isolation of a new fungi and wound-induced chitinase class in corms of Crocus sativus. Plant physiology and biochemistry. 2009, 47: 426–434.)。
几丁质是一些真菌细胞壁的主要成分之一,因此植物体内可以催化几丁质水解的几丁质酶在其抵御病原真菌入侵过程中有着重要的作用(Xu F, Fan C, He Y. Chitinases in Oryza sativa ssp. japonica and Arabidopsis thaliana. Journal of genetics and genomics. 2007, 34: 138–150.)。而且病原真菌入侵过程中几丁质酶的表达量及表达时间与植株的抗性强弱呈正相关(Shrestha CL, O?a I, Muthukrishnan S, Mew TW. Chitinase levels in rice cultivars correlate with resistance to the sheath blight pathogen Rhizoctonia solani. European journal of plant pathology. 2008, 120: 69–77.)。从沙棘(Hippophae rhamnoides)感病叶片中提取纯化的几丁质酶可以有效地抑制沙棘干缩病原菌的生长(Sun YL, Hong SK. Effect of chitinase on resistance to fungal pathogens in sea buckthorn, Hippophae rhamnoides, and cloning of Class I and III chitinase genes. Biochemical genetics. 2012, 50: 600–615.)。大多水稻(Oryza sativa)几丁质酶基因被人们用来构建抗真菌的转基因植株。Ignacimuthu和Ceasar通过农杆菌介导法将水稻几丁质酶基因chi11转入穇子(Eleusine coracana),使转基因植株获得对稻瘟病菌(Pyricularia grisea)的强抗性(Ignacimuthu S, Ceasar SA. Development of transgenic finger millet (Eleusine coracana (L.) Gaertn.) resistant to leaf blast disease. Journal of biosciences. 2012, 37: 135–147.)。He等人通过强毒株农杆菌EHA105介导将包含水稻几丁质酶基因的重组质粒Pbi121/ricchi11转入成熟的芋头(Colocasia esculenta)愈伤组织中,并通过进一步诱导获得转基因幼苗。病原菌侵染实验表明,多拷贝和单拷贝的转基因幼苗对齐整小菌核 (Sclerotium rolfsii)的抗性均有所增强(He X, Miyasaka SC, Fitch MMM, Moore PH, Zhu YJ. Agrobacterium tumefaciens-mediated transformation of taro (Colocasia esculenta (L.) Schott) with a rice chitinase gene for improved tolerance to a fungal pathogen Sclerotium rolfsii. Plant cell reports. 2008, 27: 903–909.)。
本发明中几丁质酶JsCHI1来自漾濞大泡核桃(Juglans sigillata Dode)。漾濞大泡核桃是目前云南主要的核桃栽培品种,具有果大、壳薄、仁白、味香、出油率高、营养丰富等优点,并且对病原真菌胶孢炭疽菌具有较强的抗性。
发明内容
本发明的目的是提供一种从漾濞大泡核桃中克隆获得具有抗真菌活性的几丁质酶的全长基因JsCHI1,JsCHI1的核苷酸序列如SEQ ID NO:1所示,该基因全长为1147 bp,包含一个960 bp的开放阅读框、30 bp的5′非翻译区(untranslated regions,UTR)及157 bp的3′UTR,编码如SEQ ID NO:2所示氨基酸序列的蛋白质。
本发明所述几丁质酶基因JsCHI1的编码区是序列表SEQ ID NO:1中第31-990位所示的核苷酸序列。
本发明分离克隆漾濞大泡核桃的一个抗真菌相关基因的完整cDNA片段,通过根癌农杆菌(Agrobacterium tumefaciens)介导将目的基因转入受体植物中过量表达,并通过进一步实验验证该基因是否具有抗真菌的活性,为后期利用该基因改良烟草及其他植物抵御真菌病害的能力奠定基础,发明人将这个基因命名为JsCHI1。
植物几丁质酶分子量在25~40 kDa之间,定位于细胞内或细胞外,在合成时以前体的形式存在,经后加工才具有生物学活性。普遍认为几丁质酶与植物体内防御系统有关,是植物主要的病程相关(PR)蛋白之一,其表达水平不仅受到病原真菌、细菌及病毒的诱导,还受到重金属、紫外线、盐碱、机械损伤以及多种信号分子等因素的诱导。几丁质是大多数真菌细胞壁的主要成分之一,而植物体内并不含有几丁质。几丁质酶通过降解真菌菌丝生长末端新合成的几丁质,使其顶端细胞壁变薄,继而发生球状突起,最后原生质膜破裂,从而破坏菌丝端部生长,抑制真菌病害。CHI在植物防卫反应中起到积极的作用,超表达CHI基因能提高转基因植物的抗病性。
本发明涉及分离包含JsCHI1的DNA片段并鉴定其功能,具有该基因片段的植物在一定程度上具有抵抗特定真菌入侵的表型。其中所述DNA片段如序列表所示,对该基因进行分析,表明JsCHI1全长cDNA为1147 bp,包含一个960 bp的开放阅读框、30 bp的5′UTR及157 bp的3′UTR,其中ORF编码一个具有319个氨基酸的蛋白质。BLASTn比对结果显示JsCHI1的核酸序列与欧洲栗(Castanea sativa)的内切几丁质酶mRNA序列(U48687.1)有82%的相似性。BLASTp结果显示JsCHI1的预测蛋白序列与可可树(Theobroma cacao, XP_007046548.1)和苦瓜(Momordica charantia, ABD66068.1)几丁质酶的相似性分别为78%和77%。上述分析结果表明JsCHI1属于漾濞大泡核桃中的几丁质酶基因。超表达序列表SEQ ID NO :1所示序列可以增强烟草对茄腐镰刀菌、尖孢镰刀菌、葡萄座腔菌以及串珠状赤霉菌的抗性。
上述JsCHI1基因可以应用于提高烟草的抗真菌特性,具体操作如下:
(1)采用扩增JsCHI1的特异引物,从接种胶孢炭疽菌后的漾濞大泡核桃叶中提取总RNA,通过逆转录-聚合酶链式反应(reverse transcription-polymerase chain reaction,RT-PCR)扩增出JsCHI1的全长编码区,然后将其连接到pMD-18T载体上,经测序获得具有目的基因的克隆。
(2)用限制性内切酶BamHI和EcoRI酶切pMD18-T-JsCHI1载体和植物表达载体pCAMBIA2300S,通过胶回收得到目的基因片段和载体大片段,再将所获得JsCHI1基因片段与pCAMBIA2300S载体片段连接,构建植物超表达载体,之后将所构建的重组载体通过根癌农杆菌介导转入烟草中表达。
(3)以重组载体T-DNA上具有的抗性标记筛选转化子,并通过PCR以及RT-PCR检测得到阳性转基因植株,分析转基因植株对病原真菌的抗性,最后筛选出抗性明显增强的转基因植株。
本发明为提高植物对真菌病害的抗性提供了一种新的方法,通过基因工程手段培育抗病植物可以克服传统育种的不足,不仅育种周期缩短,而且操作简单,容易获得高抗材料。本发明中来自漾濞大泡核桃的JsCHI1基因能增强植物对几种病原真菌的抗性,将该基因导入烟草中,可以产生具有真菌抗性的新品种和新材料。利用基因工程技术培育抗性植物品种和材料具有明显的优势和不可取代的重要性。它不仅为大规模生产作物、花卉等提供方便,减少化学农药的使用,还为农业生产节约成本、减少环境污染,因此本发明具有广阔的市场应用前景。
附图说明
图1是本发明中部分JsCHI1转基因烟草基因组DNA的PCR检测结果,其中Marker:DL2000 DNA Marker (大连宝生物),由2,000 bp、1,000 bp、750 bp、500 bp、250 bp以及100 bp六条DNA片段组成;正对照:质粒pMD18-T-JsCHI1为模板的PCR反应;WT:非转基因烟草(野生型)总DNA为模板进行的PCR;
图2是本发明中部分阳性JsCHI1转基因烟草中JsCHI1转录水平的表达分析结果图,其中Marker:DL2000 DNA Marker(大连宝生物);WT:非转基因烟草总RNA逆转录cDNA为模板的PCR产物;正对照:质粒pMD18-T-JsCHI1为模板的PCR产物;
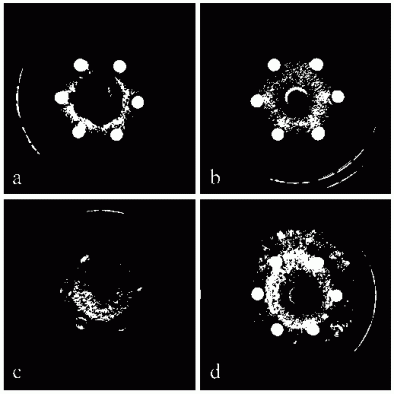
图3是本发明中JsCHI1转基因烟草体外抗真菌活性的抑菌效果图;其中a、b、c、d图示中的真菌分别是茄腐镰刀菌、尖孢镰刀菌、葡萄座腔菌以及串珠状赤霉菌;WT为野生型烟草的总蛋白;CK为空白对照,即无蛋白对照(用于提取蛋白的缓冲液)。
具体实施方式
下面通过附图和实施例对本发明进一步说明,但本发明保护范围不局限于所述内容,本实施例中方法如无特殊说明的均按常规方法操作,所用试剂如无特殊说明的采用常规试剂或按常规方法配置的试剂。
实施例1:JsCHI1全长cDNA克隆以及序列分析
用胶孢炭疽菌接种漾濞大泡核桃,用接种后4 h的叶提取总RNA,用液氮将处理过的漾濞大泡核桃的叶研磨成粉末,然后转入离心管中,采用异硫氰酸胍法提取总RNA。采用逆转录酶M-MLV (promega)以总RNA为模板合成cDNA第一链,反应体系和操作过程为:取5 μg 总RNA,依次加入50 ng oligo (dT),2 μL dNTP Mix (2.5 mM each),用DEPC水将反应体积补齐至14.5 μL;混匀后,70℃加热变性5 min后迅速在冰上冷却5 min,然后依次加入4 μL 5×First-stand buffer、0.5 μL RNasin (200 U)、1 μL M-MLV (200 U),混匀并简短离心,42℃温浴1.5 h,取出后70℃加热10 min,终止反应,cDNA第一链合成后置于-20℃保存备用。
以合成的第一链cDNA为模板,扩增目的基因JsCHI1,所用上下游引物序列分别为 及 。采用AdvantageTM 2 PCR Enzyme (Clontech)扩增出目的基因;PCR反应条件:95℃ 1 min;94℃ 30 s,57℃ 30 s,72℃ 70 s,32个循环;72℃ 5 min。反应体系(20 μL)为1 μL cDNA、2 μL 10×Advantage 2 PCR Buffer、1.8 μL dNTP Mix(10 mM each)、0.2 μL正向引物(10 μM)、0.2 μL 反向引物(10 μM)、0.2 μL Advantage 2 PCR Polymerase Mix、14.6 μL PCR-Grade water。PCR结束后,取8 μL进行琼脂糖凝胶电泳,以检测扩增产物的特异性以及大小。
所得到PCR产物只有一条DNA带,故直接对PCR产物进行TA克隆,使用的试剂盒为pMD18-T vector kit(大连宝生物),反应体系和操作过程为:取1.5 μL PCR产物,依次加入1 μL pMD18-T vector(50 ng/μL)和2.5 μL 2×Ligation solution I,混匀后置于16℃过夜反应。通过热激转化法将连接产物转入大肠杆菌DH5α感受态中。用含有氨苄青霉素(ampicillin,Amp)的LB固体培养基筛选阳性克隆。挑选若干个单菌落,摇菌后用扩增JsCHI1的特异引物检测多克隆位点插入JsCHI1的克隆。将得到的阳性克隆进行测序,最终获得的JsCHI1全长cDNA为1147 bp,通过NCBI ORF finder (http://www.ncbi.nlm.nih.gov/gorf/gorf.html)分析发现其包含一个960 bp的开放读码框(见序列表)。JsCHI1编码一个含319个氨基酸的蛋白质JsCHI1,其分子量约为34.28 KDa,等电点为8.57。借助生物信息学软件SignalP4.1分析JsCHI1编码的蛋白序列,检测其是否具有N端信号肽。结果显示在JsCHI1的N端存在信号肽,因此推测该蛋白是分泌蛋白。
实施例2:植物超表达载体构建
采用SanPrep柱式质粒DNA小量抽提试剂盒(上海生工)提取插入JsCHI1的大肠杆菌质粒pMD18-T-JsCHI1以及植物表达载体pCAMBIA2300S质粒,取1 μL用于琼脂糖凝胶电泳以检测所提取质粒的完整性及浓度高低。用限制性内切酶EcoRI (TaKaRa)和BamHI (TaKaRa)分别对质粒pMD18-T-JsCHI1和pCAMBIA2300S进行双酶切(100 μL体系),反应体系和操作过程为:分别取20 μL pMD18-T-JsCHI1和pCAMBIA2300S质粒、依次加入10 μL 10×K buffer、5 μL EcoRI、5 μL BamHI、60 μL ddH2O,混匀后短时离心,置于37℃过夜反应。将所有酶切产物进行琼脂糖凝胶电泳,然后使用SanPrep柱式DNA胶回收试剂盒(上海生工)对JsCHI1片段和pCAMBIA2300s载体大片段分别进行胶回收,取1 μL回收产物通过琼脂糖凝胶电泳检测回收片段的大小以及浓度,其余回收物置于-20℃保存备用。
利用T4 DNA Ligase (TaKaRa),将回收的JsCHI1DNA片段和pCAMBIA2300S载体片段连接起来,反应体系(20 μL)和操作过程为:取10 μL JsCHI1DNA片段依次加入2 μL pCAMBIA2300S载体DNA、2 μL 10×T4 DNA Ligase Buffer、1 μL T4 DNA Ligase、5 μL ddH2O,混匀后短时离心,然后16℃水浴过夜反应。接着采用热激转化法将连接产物转入大肠杆菌DH5α中,用含有50 mg/L卡那霉素(kanamycin,Km)的固体培养基筛选阳性克隆。挑选单菌落摇菌,以菌液为模板用扩增JsCHI1的特异引物进行PCR,挑选出JsCHI1与pCAMBIA2300S成功连接的克隆,并向检测得到的阳性菌株中加入甘油后置于-80℃保存备用。
采用SanPrep柱式质粒抽提试剂盒(上海生工)提取并纯化上述大肠杆菌DH5α中的pCAMBIA2300S-JsCHI1质粒。随后用液氮冻融法将上述构建的植物表达载体pCAMBIA2300S-JsCHI1转入所制备的根癌农杆菌LBA4404感受态细胞中。操作步骤为:取2 μg pCAMBIA2300S-JsCHI1质粒加入含有200 μL感受态细胞的离心管中,轻轻混匀后冰浴5 min,随后转入液氮中冷冻1 min,然后迅速置于37℃水浴5 min,再冰浴2 min,之后加入500 μL LB液体培养基于28℃振荡培养4 h。将活化后的农杆菌涂于含有50 mg/L Km的LB固体培养基上,28℃倒置培养。挑选单菌落摇菌,再用扩增JsCHI1的特异性引物进行PCR反应,检测pCAMBIA2300S-JsCHI1是否转入农杆菌中。对于阳性克隆,加入甘油后置于-80℃保存备用。
实施例3:农杆菌介导的植物遗传转化以及转基因植物筛选
本实验的转基因受体是烟草(Nicotiana tabacum L.)。将烟草种子用75%的酒精浸泡30 s,无菌水洗涤后用0.1%的HgCl2浸泡8 min,然后再用无菌水洗涤若干次,播种于1/2 MS培养基上,28℃暗培养5-8 d,发芽后转至光照培养箱(25℃,16 h/d光照),以后每月用MS培养基继代一次。
从-80℃冰箱中取出保存的含有pCAMBIA2300S-JsCHI1质粒的农杆菌LBA4404菌种,取20 μL接种于5 mL含有50 mg/L Km和20 mg/L利福平的LB液体培养基中,28℃培养至培养基浑浊。吸取1 mL浑浊的菌液至含有50 mg/L Km的LB固体培养基上,28℃培养48 h。随后将LB固体培养基上的农杆菌刮下适量接种于附加有20 mg/L的乙酰丁香酮的MGL液体培养基中,28℃振荡培养5-8 h以活化农杆菌。
取烟草无菌烟草幼嫩叶片切成约1 cm2的叶盘,完全浸泡于上述含有活化农杆菌的MGL液体培养基中,25℃浸染15 min。用无菌滤纸吸干叶盘表面的菌液,将叶盘置于共培养基上,22℃无光条件下共培养2天。烟草转化的共培养基为MS+0.02 mg/L 6-BA+2.1 mg/L NAA+30 g/L蔗糖+6 g/L琼脂。
将共培养后的叶盘转到加有抗生素的MS筛选培养基中分化成苗,同时筛选转基因植株。烟草筛选培养基为MS+0.5 mg/L 6-BA+0.1 mg/L NAA+30 g/L蔗糖+6 g/L琼脂+50 mg/L Km+200 mg/L 头孢霉素(cefotaxime sodium salt,Cef);筛选培养时将培养瓶转移至光照培养箱培养(25℃,16 h/d光照,8 h/d黑暗)。待烟草长出芽后用含有50 mg/L Km和200 mg/L Cef的MS培养基继代培养。因烟草愈伤分化率较高,故需要对再生植株进行进一步筛选。将烟草再生苗移至含有50 mg/L Km的MS培养基上使其生根,最后选用生根较好的再生苗做进一步的检测。
采用CTAB法提取转基因烟草植株叶片的基因组DNA,取1 μL所得基因组DNA进行琼脂糖凝胶电泳检测其完整性和浓度。以转基因植株的基因组DNA为模板用JsCHI1的特异引物进行PCR反应。PCR结束后,取8 μL产物用于琼脂糖凝胶电泳以检测阳性转基因植株。部分烟草转基因植株的扩增结果如图1所示,JsCHI1转基因烟草共筛选到36株阳性转基因植株。
实施例4:转基因烟草中JsCHI1的表达分析以及转基因植株抗真菌活性分析
分别取阳性转基因植株以及非转基因烟草(野生型)的嫩叶提取总RNA,逆转录生成cDNA第一链,并以此为模板用扩增JsCHI1的特异引物进行PCR,根据PCR结果分析各转基因植株中JsCHI1转录水平的表达量。总RNA提取以及RT-PCR的方法与实施例1中相同。PCR结束之后,取8 μL用于琼脂糖凝胶电泳,部分单株的检测结果如图2所示,共检测到23个转基因单株中JsCHI1在转录水平大量表达,这些单株的编号为1~23。
将实验室保存的几种真菌接种于PDA固体培养基(200 g/L马铃薯,15 g/L琼脂,20 g/L葡萄糖)上,28℃暗培养,待菌落生长至直径约为2~3 cm时添加蛋白,分析转基因植株体外抗真菌活性。为了防止其它杂菌污染所提取的蛋白,整个植物蛋白提取过程均是无菌操作。首先取1 g转基因烟草单株(编号分别为1、2、3、4)及野生型叶片放入研钵中,加入1 mL蛋白提取液(1 M NaCl,0.1 M 乙酸钠,1% PVP,pH 6),充分研磨。转入1.5 mL离心管中,混匀后4℃静置过夜。4℃离心30 min (12,000 g),取上清于新的1.5 mL离心管中,并取适量用紫外分光光度仪测定总蛋白浓度。将转基因和野生型植株的总蛋白浓度调整至0.2 μg/μL,然后分别取20 μL滴于各真菌培养基的无菌滤纸上。在每个真菌的平板上除了添加不同转基因烟草植株的总蛋白,同时平行添加野生型烟草的总蛋白和空白对照(蛋白提取液)。28℃培养几天后观察各处理真菌生长的情况,并据此来评价JsCHI1转基因烟草的体外抗真菌活性。结果如图3所示,JsCHI1转基因烟草蛋白对茄腐镰刀菌、尖孢镰刀菌、葡萄座腔菌以及串珠状赤霉菌的生长具有明显的抑制作用。
序列表
<110> 昆明理工大学
<120> 漾濞大泡核桃几丁质酶基因JsCHI1及应用
<160> 4
<170> PatentIn version 3.3
<210> 1
<211> 1147
<212> DNA
<213> JuglanssigillataDode
<220>
<221> mRNA
<222> (1)..(1147)
<220>
<221> 5'UTR
<222> (1)..(30)
<220>
<221> CDS
<222> (31)..(990)
<220>
<221> 3'UTR
<222> (991)..(1147)
<400> 1
tggggacaaa ccctgcatat cgccccatat atgggattaa aattgaaaat gaagcttttt 60
tctttgattc tccttttcgc tttctttctc ggagcctcgg cacaacaatg tgggagacag 120
gccgggggag ctgtgtgtat gaatgggcta tgttgcagcc aatttgggta ttgtggcagc 180
acaactgagt attgtggagc tggctgccag agccaatgtt ctggtgcaaa ccctacccca 240
acccccaata ctggtggcaa cgatgttagc agcatcataa gctcatctct ttttgaccaa 300
ctgctcaaat ataggaacga cgggagatgc agaagtaacg gattctacac ttacaatgct 360
ttcatcgctg ctgcacgatc tttcaatggc tttggcacaa ctggggatgt taacacacgt 420
aaaagggaga ttgcagcttt cttgggtcaa acctctcacg agaccacagg agggtggcca 480
agtgcaccag atggcccata tgcatgggga tattgcttta ttacagaaat caacaaaaca 540
gactattgta cgcccagtgc agcttggcca tgcgctccag gcaaacaata ctatggccgg 600
ggacccattc aactcaccca caactacaat tatgggccag ccggtaacgc cattggatct 660
aatctcataa ataatccgga tttggtagcc acagacccga ccatatcgtt caagacagcc 720
atatggtttt ggatgaccgc acagggaaac aaaccatcta gccacgatgt tatcattggg 780
agatggacac cgtcggccgc cgacaggtca gctggtcgag tcccaggtta cggtgtcatc 840
accaacataa tcaatggcgg gctcgaatgt gggcgtggtt ccgatgctag agtggctgac 900
aggattgggt tctataaaag atactgtgac atattcggag tgggctacgg ggacaacttg 960
gattgctata atcaaaggcc ttttgcctaa gatcgatgca tacccaagta ccgcacttat 1020
tagcaattaa ccacatgtaa ttggagatta tatatttctc ttgaactcca atatgaataa 1080
agaaagctca agatatgaat aaggaaaaag taaaatttgc aagtaaaaaa aaaaaaaaaa 1140
aaaaaaa 1147
<210> 2
<211> 319
<212> PRT
<213> JuglanssigillataDode
<400> 2
Met Gly Leu Lys Leu Lys Met Lys Leu Phe Ser Leu Ile Leu Leu Phe
1 5 10 15
Ala Phe Phe Leu Gly Ala Ser Ala Gln Gln Cys Gly Arg Gln Ala Gly
20 25 30
Gly Ala Val Cys Met Asn Gly Leu Cys Cys Ser Gln Phe Gly Tyr Cys
35 40 45
Gly Ser Thr Thr Glu Tyr Cys Gly Ala Gly Cys Gln Ser Gln Cys Ser
50 55 60
Gly Ala Asn Pro Thr Pro Thr Pro Asn Thr Gly Gly Asn Asp Val Ser
65 70 75 80
Ser Ile Ile Ser Ser Ser Leu Phe Asp Gln Leu Leu Lys Tyr Arg Asn
85 90 95
Asp Gly Arg Cys Arg Ser Asn Gly Phe Tyr Thr Tyr Asn Ala Phe Ile
100 105 110
Ala Ala Ala Arg Ser Phe Asn Gly Phe Gly Thr Thr Gly Asp Val Asn
115 120 125
Thr Arg Lys Arg Glu Ile Ala Ala Phe Leu Gly Gln Thr Ser His Glu
130 135 140
Thr Thr Gly Gly Trp Pro Ser Ala Pro Asp Gly Pro Tyr Ala Trp Gly
145 150 155 160
Tyr Cys Phe Ile Thr Glu Ile Asn Lys Thr Asp Tyr Cys Thr Pro Ser
165 170 175
Ala Ala Trp Pro Cys Ala Pro Gly Lys Gln Tyr Tyr Gly Arg Gly Pro
180 185 190
Ile Gln Leu Thr His Asn Tyr Asn Tyr Gly Pro Ala Gly Asn Ala Ile
195 200 205
Gly Ser Asn Leu Ile Asn Asn Pro Asp Leu Val Ala Thr Asp Pro Thr
210 215 220
Ile Ser Phe Lys Thr Ala Ile Trp Phe Trp Met Thr Ala Gln Gly Asn
225 230 235 240
Lys Pro Ser Ser His Asp Val Ile Ile Gly Arg Trp Thr Pro Ser Ala
245 250 255
Ala Asp Arg Ser Ala Gly Arg Val Pro Gly Tyr Gly Val Ile Thr Asn
260 265 270
Ile Ile Asn Gly Gly Leu Glu Cys Gly Arg Gly Ser Asp Ala Arg Val
275 280 285
Ala Asp Arg Ile Gly Phe Tyr Lys Arg Tyr Cys Asp Ile Phe Gly Val
290 295 300
Gly Tyr Gly Asp Asn Leu Asp Cys Tyr Asn Gln Arg Pro Phe Ala
305 310 315
<210> 3
<211> 26
<212> DNA
<213> 人工序列
<400> 3
atatgggatt aaaattgaaa atgaag 26
<210> 4
<211> 25
<212> DNA
<213> 人工序列
<400> 4
tggttaattg ctaataagtg cggta 25
漾濞大泡核桃几丁质酶基因JsCHI1及应用专利购买费用说明
![]()
Q:办理专利转让的流程及所需资料
A:专利权人变更需要办理著录项目变更手续,有代理机构的,变更手续应当由代理机构办理。
1:专利变更应当使用专利局统一制作的“著录项目变更申报书”提出。
2:按规定缴纳著录项目变更手续费。
3:同时提交相关证明文件原件。
4:专利权转移的,变更后的专利权人委托新专利代理机构的,应当提交变更后的全体专利申请人签字或者盖章的委托书。
Q:专利著录项目变更费用如何缴交
A:(1)直接到国家知识产权局受理大厅收费窗口缴纳,(2)通过代办处缴纳,(3)通过邮局或者银行汇款,更多缴纳方式
Q:专利转让变更,多久能出结果
A:著录项目变更请求书递交后,一般1-2个月左右就会收到通知,国家知识产权局会下达《转让手续合格通知书》。
动态评分
0.0