专利摘要
本发明涉及一种可促进靶miRNA生产的两亲肽和使用该两亲肽调控靶miRNA生产的方法。更为具体的是,本发明的两亲肽与发夹状靶miRNA特异地强结合。这种特异的结合亲和力诱导Dicer酶的活性,从而特异地增加靶miRNA的生产。本发明可有效地用于在体内调控靶miRNA的生产量、用于miRNA的功能研究和用于制备靶miRNA相关疾病的治疗药物。
说明书
技术领域技术领域
本发明涉及促进靶miRNA生产的两亲肽和使用该两亲肽调控靶miRNA生产的方法。
技术背景2.背景技术
将编码的DNA翻译成蛋白质的RNA被称为信使RNA(mRNA),其只占总RNA的2%。剩下的RNA(98%)为非编码的RNA。这些不翻译成蛋白质的RNA被认为是不重要的,并且它们的功能大多也是未知的。然而,已有这种非编码RNA的重要功能报道,即通过和基因或蛋白质形成复合物,或作为被称为核糖酶(ribozyme)的酶行使功能。目前,已有这些非编码RNA通过特异性地与基因或基因产物互相作用的调控功能报道。因此,了解这些非编码RNA的不同功能和特征变得更为重要。这种小分子量非编码RNA被称为内源小RNA(miRNA)或核糖开关(riboswitch),其控制超过2%的所有基因的调控功能。
最为公知的非编码RNA为小RNA(miRNA),在人类中有大约700中不同的miRNA。miRNA是一种单链的RNA分子,由19~25个核苷酸组成。miRNA产生于内源的发夹状转录本(Bartel,D.P.,Cell 116:281-297,2004;Kim,V.N.,Mol.Cells.19:1-15,2005)。miRNA互补结合到靶mRNA上,作为转录后基因抑制子行使功能,导致翻 译被抑制,并且还降解mRNA。也有报道认为miRNA可能和癌症有关。在一些报道中,一些miRNA已经表现出与癌症的发展或其代谢有关。因此,研究miRNA的功能正被认为是癌症生物学中新的和重要的领域(Esquela-kerscher,A et al.,Nat.Rev.Cancer 6(4):259-269,2006)。此外,miRNA的表达水平在细胞发育和分化过程中变化很大。miRNA在发育系统和疾病状态中的重要性已经被miRNA表达谱图(profiling)证实(Lu,J.et al.,Nature 435:834-838,2005)。研究表明,一种miRNA即let7a-1与肺癌或结肠癌有关,miR16-1与白血病或前列腺癌有关,miR24-1与白血病有关,而且let7a-1通过抑制RAS基因抑制一般的癌症促进基因因子。至于miR16-1,能通过抑制致癌因子Bc12抑制癌细胞的生长。因此,发现一种能调控miRNA数量的方法和试剂将会是一种有效目标治疗药物的候选方案(candidate)。总之,我们可以通过抑制引起目标疾病的miRNA和激活抑制疾病的miRNA来促进对疾病的抑制。
在体内有两种酶与miRNA的生产有关。一种被称为Drosha,为细胞核内的核酸内切酶。第二种为Dicer,为细胞溶质(cytosol)中的核酸内切酶。这两种酶为RNA水解酶,无碱基序列的特异性。通过识别用于消化的双链RNA的长度,使它们具有有限的特异性。最初的miRNA(miRNA前体)通过细胞核中的RNaseIII型Drosha酶形成大约70~90个核苷酸长度的茎环结构miRNA前体。然后,miRNA前体进入到细胞溶质,被Dicer酶切成更短的21~25个核苷酸的miRNA,称为成熟miRNA。
既然miRNA的生产受这两种酶的调控,因此理解这两种酶的特异性对于miRNA生产是非常重要目标。如果靶miRNA引起如癌症那样的疾病,这两种酶将可能是用于扩增或减少引起疾病的miRNA的很好靶蛋白。特别地,细胞溶质中加工miRNA的Dicer被认为是重要的靶标,因为它可在细胞溶质中直接与靶mRNA互作。
然而,Dicer的问题在于该酶的加工是非特异性的,并且对miRNA前体的碱基序列无选择性。另一个加工miRNA的酶Drosha具有与底物结合的分子伴侣(chaperon)蛋白质,因此,有助于使非特异的底物变得更为特异。然而,Dicer具有识别发夹状底物的茎长度的特异性,而对超过700种其它发夹状内源底物缺乏特异性识别的能力。在体内,特异性地使miRNA成熟的调控因子是很关键的,但到目前为止还没有这类调控因子的报道。
因此,本发明的发明人对能特异性地结合靶miRNA前体的配体开展了大量的研究,而且该配体有助于通过添加人造元素诱导使对miRNA前体的碱基序列不特异的Dicer酶产生特异性而生产成熟的miRNA。在研究过程中本发明的发明人已经证实,通过取代在疏水区具有吲哚基的色氨酸而构建的两亲肽与靶miRNA前体形成紧密的特异性互作。这种特异性互作促进了Dicer酶的活性,并特异性地增加了成熟miRNA的生产,由此完成了本发明。
发明内容发明详述
本发明的一个目的在于提供促进靶miRNA生产的两亲肽和调控靶miRNA生产的方法。
为了实现这一目的,本发明提供一种包含一种或多种两亲α螺旋肽的两亲肽文库,其中,一个所述α螺旋肽含有4~12个Leu(亮氨酸,L),而且在疏水氨基酸中,一个或多个亮氨酸残基被Try(色氨酸,W)取代。
本发明还提供一种检测与发夹状靶miRNA前体特异性结合的两亲肽的方法,该方法包括:
1)制备两亲肽文库;
2)合成发夹状靶miRNA前体和作为对照的一种或多种发夹状非靶miRNA前体;
3)混合两亲肽、发夹状靶miRNA前体或非靶miRNA前体和 探针分子后,测定两亲肽结合miRNA前体的结合亲和力;以及
4)筛选结合靶miRNA前体的结合亲和力大于结合非靶miRNA前体的结合亲和力的两亲肽。
本发明还提供一种检测与两亲肽特异性地结合的miRNA前体的方法,该方法包括:
1)制备两亲肽文库;
2)合成待检测的发夹状靶miRNA前体和作为对照的一种或多种发夹状非靶miRNA前体以筛选所述两亲文库;
3)混合两亲肽、发夹状靶miRNA前体或非靶miRNA前体和探针分子后,测定miRNA前体结合两亲肽的结合亲和力,以及
4)筛选结合两亲肽的结合亲和力大于非靶miRNA前体的靶miRNA。
本发明还提供一种检测增加靶miRNA生产的两亲肽的方法,该方法包括:
1)制备两亲肽文库;
2)培养用两亲肽处理后的细胞系;
3)测定细胞系的靶miRNA的表达水平;
4)筛选与未处理对照组相比,增加靶miRNA表达水平的两亲肽。
本发明还提供一种促进两亲肽特异的靶miRNA生产的组合物,该靶miRNA用上述方法筛选,所述方法包括作为活性化合物的两亲肽。
本发明还提供一种促进两亲肽特异的靶miRNA生产的方法,该靶miRNA用上述方法筛选,所述方法包括给受试者施用两亲肽。
本发明还提供一种用于因两亲肽特异的靶miRNA受到抑制引起的疾病的治疗药物或诊断试剂,该靶miRNA用上述方法筛选,所述治疗药物或诊断试剂包括作为活性化合物的两亲肽。
本发明还提供制备用于促进两亲肽特异的靶miRNA生产的组合物中两亲肽的应用,该两亲肽用上述方法筛选。
本发明还提供制备用于因两亲肽特异的靶miRNA受到抑制引起的疾病的治疗药物或诊断试剂中两亲肽的应用,该两亲肽用上述方法筛选。另外,本发明提供促进靶miRNA前体体外加工的方法,包括:
1)体外用miRNA前体处理上述方法筛选的的两亲肽;以及
2)使所述两亲肽和靶miRNA前体结合。
工业实用性
如上所述,本发明筛选出的两亲肽通过对发夹状结构的靶miRNA的紧密和特异的解离常数选择性地诱导成熟miRNA的生产。因此,两亲肽可有效地应用于开发用于治疗miRNA相关疾病的药物和制备诊断试剂。
尽管为了说明的目的,公开了本发明优选的实施方案,然而本领域技术人员应当知晓,在不脱离本发明所附的权利要求书的范围和精神的前提下,可以对本发明进行各种修改、添加和替换。
附图说明附图说明
从下述的详细说明并结合所附的附图,将更加清楚地理解本发明上述和其它目的、特征和其它优点,其中:
图1所示为通过M-fold预测的两种miRNA前体pre-let7a-1(a)和pre-miR16-1(b)的二级结构视图。
图2所示为在肽2b、2c或1e存在下,Dicer将miRNA前体转化为成熟miRNA的标准化初始反应速率(Vo)图表。
图3所示为在不同浓度的肽2b下,Dicer将miRNA前体转化为成熟miRNA的标准化初始反应速率(Vo)图表。
图4所示为通过Northern印迹方法测定的在肽2b、2c或1e存在下生产的成熟miRNA含量图表。
具体实施方式发明详述
通过下面优选的参考所附附图的实施方案,将更加清楚地理解本发明的特征和优点。首先应当注意,基于发明人可以恰当地定义术语的概念以最佳地描述其自己的发明的原则,本申请中所使用的术语和词语应当被解释成与本发明的技术精神一致的含义或概念。另外,还应当理解,为不对本发明的重要内容产生不必要的混淆,与本发明有关的公知功能和结构的详述说明将被省略。
以下,将对本发明进行更为详细的说明。
本发明提供一种包含一种或多种两亲α螺旋肽的两亲肽文库,其中,一个所述α螺旋肽含有4~12个Leu(亮氨酸,L),而且在疏水氨基酸中,一个或多个亮氨酸残基被Try(色氨酸,W)取代。
所述两亲肽文库优选含有一种或多种两亲肽,所述两亲肽的氨基酸序列为一个或两个疏水氨基酸亮氨酸(L)和亲水氨基酸赖氨酸(K)或甘氨酸(G)交替排列,其中两个赖氨酸(K)被两个色氨酸(T)取代,但不限于此。
所述两亲肽文库优选含有一种或多种肽,所述肽含有一个或多个具有SEQ ID NO:2-SEQ ID NO:9或SEQ ID NO:12-SEQ ID NO:21所示氨基酸序列的肽,更为优选的是,所述肽含有具有一个或多个SEQ ID NO:12-SEQ ID NO:21所示氨基酸序列的肽,最为优选的氨基酸序列如SEQ ID NO:13、16和18所示,但不总是限于此。
所述两亲肽文库优选与发夹状miRNA前体特异地结合,并通过Dicer酶激活miRNA前体的加工而诱导产生成熟的miRNA(小RNA),但不限于此。
miRNA选自下组:let-7a-1、miR16-1和miR24-1;但不限于此。
为了由赖氨酸(L)、亮氨酸(K)和甘氨酸(G)组成的α螺旋两亲肽制备一种与发夹状靶miRNA前体特异地结合的肽,所述两个疏水氨基酸亮氨酸(L)被具有吲哚基并能与RNA碱基互作的色氨酸(W)取代。
构建了筛选文库(scanning library)(见表1)用于鉴定对于促进强且特异地结合有重要作用的色氨酸位点。通过荧光各向异性方法测定第一代肽对pre-let7a-1和pre-miR16-1的结合亲和力,所述的肽通过将亮氨酸替换成色氨酸而构建(见表2)。
结果表明,当两亲肽(SEQ ID NO:1)的1#或14#的亮氨酸被色氨酸取代时,对miRNA前体的结合亲和力显著提高。每个末端被色氨酸取代的两亲肽增加了对miRNA的结合亲和力。然而,对靶 miRNA前体结合特异性的增加却没有效果(见表3)。
因此,含有一个色氨酸取代的两亲肽表现出结合亲和力的增加,但并非选择性维持不变。
基于第一代肽,亮氨酸筛选文库,本发明的发明人构建了第二代肽文库,含有2个色氨酸取代。为了使两亲肽具有结合亲和力和特异性,1位或14位的亮氨酸被色氨酸取代并且中间结构域的6个亮氨酸中的一个被色氨酸取代(表4)。使用荧光各向异性方法测定第二代肽对pre-let7a-1和pre-miR16-1结合亲和力,肽2b对pre-let7a-1的结合能力最强。肽2b和2c对pre-miR16-1的结合能力为第一和第二强(表5)。通过解离常数计算出鉴别比,肽2b对pre-let7a-1的结合亲和力最强。然而,肽2b对其它发夹状miRNA前体的结合能力相对较弱,具有较高的鉴别比11。肽2e能强且特异地结合pre-miR16-1,鉴别比为2.3。肽2g能强且特异地结合pre-miR124-1,鉴别比为2.3表明了识别的特异性。两个亮氨酸残基被色氨酸取代,这种含有两个色氨酸的肽能与靶miRNA强且特异地互作。
为了研究肽2b和肽2c对Dicer酶活性的影响,本发明的发明人在肽2b或2c存在下,通过处理同位素标记的miRNA前体、pre-let7a-1或pre-miR16-1,由反应产物的量测定了初始反应速率。结果表明,和未处理组相比,用肽2b和2c处理的组加速了Dicer将miRNA加工成成熟的miRNA。尤其是,当pre-let7a-1和2b互作时,显著增加了成熟miRNA的生产(见图2),表明肽和miRNA前体之间有强且特异的结合。另外,当我们研究成熟miRNA的生产与肽2b浓度的关系时,在初始反应响应中有取决于2b浓度的改变,而且在浓度大于100nM时反应有一个迅速的增加(见图3)。
为了在细胞水平研究所述肽通过激活Dicer酶活性而增加成熟miRNA生产的效果,本发明的发明人用肽2b或2c处理结肠癌细胞 株,通过Northern印迹对成熟miRNA生产的量进行了定量。结果表明,当细胞用所述肽处理后,增加了靶miRNA的生产。当用已被证明对pre-let7a-1有特异性结合亲和力的2b处理后,成熟的let7a-1有显著的增加(见图4)。这些发现表明,特异地结合到miRNA前体的肽能特异性地诱导成熟靶miRNA的生产。
因此,含有两个色氨酸残基的所述两亲肽文库能有效地用于促进靶miRNA的生产。
本发明提供一种检测与发夹状靶miRNA前体特异性结合的两亲肽的方法,其包括
1)制备所述的两亲肽文库;
2)合成发夹状靶miRNA前体和作为对照的一种或多种发夹状非靶miRNA前体;
3)混合两亲肽、发夹状靶miRNA前体或非靶miRNA前体和探针分子后,测定所述两亲肽对miRNA前体的结合亲和力,以及
4)筛选对靶miRNA前体的结合亲和力大于对非靶miRNA前体的结合亲和力的两亲肽。
根据上述的方法,步骤2)中的miRNA前体选自下组:pre-let-7a-1、pre-miR16-1和pre-miR24-1,但不限于此。
根据上述的方法,步骤3)中的探针分子为含有荧光并被标签标记的化合物,其与两亲肽竞争结合发夹状靶miRNA前体,但不限于此。
根据上述的方法,步骤3)中的结合亲和力通过使用竞争结合方法的荧光各向异性测定,但不限于此。
为了获得强且选择性地结合发夹状靶miRNA前体,本发明的两亲肽含有两个具吲哚基团的色氨酸残基,增加了对形成发夹miRNA前体双螺旋沟(groove)的沟的选择性。构建的两亲肽表现出对靶miRNA前体的强且特异的结合。特异的结合亲和力促进了Dicer酶 的活性并特异地增加了成熟靶miRNA的生产。因此,改变两亲肽的两亲特性将会是一种用于检测与靶miRNA前体特异性强结合的肽的有用方法。
本发明还提供一种检测与两亲肽特异性结合的miRNA前体的方法,其包括:
1)制备所述两亲肽文库;
2)合成待检测的发夹状靶miRNA前体和作为对照的一种或多种发夹状非靶miRNA前体以筛选两亲文库;
3)混合所述两亲肽、发夹状靶miRNA前体或非靶miRNA前体和探针分子后,测定miRNA前体结合两亲肽的亲和力,以及
4)筛选对两亲肽的结合亲和力大于非靶miRNA前体的靶miRNA。
根据上述的方法,步骤3)中的探针分子为含有荧光并被标签标记的化合物,其与两亲肽竞争结合发夹状靶miRNA前体,但不限于此。
根据上述的方法,步骤3)中的结合亲和力通过使用竞争结合方法的荧光各向异性测定,但不限于此。
为了获得强且选择性地结合发夹状靶miRNA前体,本发明的两亲肽含有两个具吲哚基团的色氨酸残基,以增加对形成发夹miRNA前体双螺旋沟(groove)的沟的选择性。构建的两亲肽表现出对靶miRNA前体的强且特异的结合。特异的结合亲和力促进了Dicer酶的活性并特异地增加了成熟靶miRNA的生产,因此,可用于检测作为两亲肽目标的miRNA。
本发明还提供一种检测增加靶miRNA生产的两亲肽的方法,其包括:
1)制备所述两亲肽文库;
2)培养用所述两亲肽处理后的细胞系;
3)测定所述细胞系的靶miRNA的表达水平;
4)筛选与未处理对照组相比,促进靶miRNA表达水平的两亲肽。
优选的是,两亲肽特异地结合发夹状小RNA前体(pre-miRNA),因此,通过激活Dicer酶促进了成熟小RNA(miRNA)的生产,但不限于此。
根据上述的方法,步骤2)中的细胞系优选为结肠癌细胞系,但不限于此。
根据上述的方法,步骤3)中的miRNA选自下组:pre-let-7a-1、pre-miR16-1和pre-miR24-1,但不限于此。
根据上述的方法,步骤3)中的表达水平为选自下组:Northern印迹、RT-PCR和微阵列,但不限于此。
为了获得强且选择性地结合发夹状靶miRNA前体,本发明的两亲肽含有两个具吲哚基团的色氨酸残基,以增加对形成发夹miRNA前体双螺旋沟(groove)的沟的选择性。构建的两亲肽表现出对靶miRNA前体的强且特异的结合。特异的结合亲和力促进了Dicer酶的活性并特异地增加了成熟靶miRNA的生产。因此,改变两亲肽的两亲特性将会是一种用于检测强且特异地结合靶miRNA前体的肽的有用方法。
此外,本发明提供一种促进两亲肽特异的靶miRNA生产的组合物,其包括作为活性化合物的两亲肽。
本发明还提供两亲肽在用于制备促进两亲肽特异的靶miRNA生产的组合物中的应用。
miRNA选自下组:let-7a-1、miR16-1和miR24-1,但不限于此。
本发明的两亲肽被两个具吲哚基的色氨酸残基取代,增加了对发夹miRNA前体的双螺旋沟的选择性。构建的两亲肽表现出对靶miRNA前体的强且特异的结合,导致促进了Dicer酶的活性,因此 可有效地用于增加成熟靶miRNA的生产。
本发明还提供一种增加两亲肽特异的靶miRNA生产的方法,其包括给受试者施用两亲肽。
miRNA选自下组:let-7a-1、miR16-1和miR24-1,但不限于此。
受试者优选为哺乳动物,更为优选的实验动物包括老鼠、兔子、豚鼠、仓鼠、狗和猫,最为优选的是灵长类,如黑猩猩和大猩猩。
本发明的两亲肽被两个具吲哚基的色氨酸残基取代,增加了对发夹miRNA前体的双螺旋沟的选择性。构建的两亲肽表现出对靶miRNA前体的强且特异的结合,导致促进了Dicer酶的活性,因此可有效地用于增加成熟靶miRNA的生产。
本发明还提供一种用于因两亲肽特异的miRNA受到抑制引起的疾病的治疗药物或诊断试剂,其包括作为活性化合物的两亲肽。
本发明那个还提供治疗因两亲肽特异的靶miRNA受到抑制引起的疾病的方法,包括给受试者施用两亲肽。
本发明还提供两亲肽在制备用于因两亲肽特异的miRNA受到抑制引起的疾病的治疗药物或诊断制剂中的应用。
miRNA选自下组:let-7a-1、miR16-1和miR24-1,但不限于此。
所述疾病为选自下组:结肠癌、前列腺癌、睾丸癌、小肠癌、结肠直肠癌、肛门癌、食道癌、胰腺癌、胃癌、肾癌、宫颈癌、乳腺癌、肺癌、卵巢癌和白血病,但不限于此。
受试者优选为哺乳动物,更为优选的实验动物包括老鼠、兔子、豚鼠、仓鼠、狗和猫,最为优选的是灵长类,如黑猩猩和大猩猩。
本发明的两亲肽被两个具吲哚基的色氨酸残基取代,增加了对发夹miRNA前体的双螺旋沟的选择性。构建的两亲肽表现出对靶miRNA前体的强且特异的结合,导致促进了Dicer酶的活性,因此可有效地用于制备因两亲肽特异的miRNA受到抑制引起的疾病的治疗药物或诊断制剂和治疗因两亲肽特异的miRNA受到抑制引起 的疾病。
所述治疗药物除含有两亲肽外,还可含有一种或多种具有相同或相近的功能的活性化合物。
所述治疗药物可包括药用添加剂,如淀粉、明胶、微晶纤维素、乳脂糖、乳糖、聚维酮、胶态二氧化硅、磷酸钙、甘露醇、阿拉伯胶、预糊化淀粉、玉米淀粉、纤维素粉、羟丙基纤维素、欧巴代(opadry)、羧基乙酸淀粉钠、巴西棕榈、铅、合成硅酸铝、硬脂酸、硬脂酸镁、硬脂酸铝、硬脂酸钙、白糖、葡萄糖、山梨醇和滑石。所述药用添加剂的含量为0.01-90wt%,但不限于此。
本发明的药物组合物可为口服或肠胃给药的制剂。当将药物组合物转化成施用形式时,可使用填料、填充剂、粘合剂、湿润剂、崩解剂或表面活性剂。
口服剂型包括,例如片剂、丸剂、颗粒剂和胶囊剂。固体口服剂型可包括至少一种或多种稀释剂,如淀粉、碳酸钙、蔗糖、乳糖或明胶。固体口服剂型还可包括润滑剂,如硬脂酸镁和滑石。液体口服剂型可包括悬浮剂、乳剂、糖浆剂和酏剂。这些制剂可包含常规的稀释剂,例如水和液体石蜡或其它稀释剂,如吸附剂、着色剂、增味剂、香料和防腐剂。用于肠外给药的剂型可包括无菌水溶液、非水溶液、悬浮液、乳液、冻干制剂和栓剂。作为非水溶液和悬浮液的溶剂,可使用丙二醇、聚乙二醇、蔬菜油如橄榄油、或可注射的酯如ethyolate。作为栓剂的基体,可使用Witepsol、聚乙二醇(Macrogol)、吐温(Tween)61、可可脂、月桂脂、甘油明胶等。
本发明的药物组合物可以0.0001~100mg/kg,优选0.001~10mg/kg的有效剂量对受试者进行施用,每天一至多次。剂量可根据多种因素进行改变,包括年龄、体重、健康状况、性别和饮食习惯、给药频率和途径、排泄和疾病的严重程度。
所述治疗药物的给药途径可为口服给药或肠外给药。该药物可 以常规的药物组合物形式进行肠外给药,特别是通过腹腔注射、直肠内注射、皮下注射、静脉注射、肌肉注射、乳房注射、大脑血管注射或胸内注射。
所述治疗药物可单独使用,或结合其它的治疗方法,如手术、放射治疗、激素治疗、化疗和生物反应调剂物。
此外,本发明提供一种促进体外靶miRNA前体加工的方法,其包括:
1)用根据前述的方法筛选的两亲肽处理体外存在的miRNA前体;以及
2)结合两亲肽和靶miRNA前体。
根据上述方法,步骤1)中的miRNA前体选自下组:pre-let-7a-1、pre-miR16-1和pre-miR24-1,但不限于此。
本发明的两亲肽被两个具吲哚基的色氨酸残基取代,增加了对发夹miRNA前体的双螺旋沟的选择性。构建的两亲肽表现出对靶miRNA前体的强且特异的结合,导致促进了Dicer酶的活性,因此可有效地用于增加体外成熟靶miRNA的加工。
实施例
下文中,将参考下述的实施例和试验例对本发明进行更为详细的说明。然而,下述的实施例和试验例仅用于举例说明,不应以任何方式限制本发明的范围。
实施例1第一代肽的合成
通过使用link amide MBHA树脂(0.4~0.6mmol/g),以25μmol的比例,用一般的固相合成方法合成肽。用于合成氨基酸的单体购自NovaBiochem。将肽的N-端乙酰化,通过配备有337mM的氮气激光和1.2m的飞行管的Auto Flex Ⅱ MALDI-TOF/TOF质谱仪(Bruker Daltonics,Germany)测定肽。还通过Agilent 1100 HPLC(高效液相色谱)分离肽并进行纯度测定。
具体地,表1所示的肽1用50mg(32μmol)的link amide MBHA resin(0.64mmol/g)合成。树脂用二氯甲烷(1ml,5min)和二甲基甲酰胺(DMF,1ml,5min)进行膨胀,然后,5min搅拌两次,用1.5ml的含有20%哌啶的DMF去除Fmoc保护基团。用二氯甲烷(1ml,5次),DMF(1ml,2次)进行搅拌后进行过滤完全去除哌啶溶液。肽1中,通过将Fmoc保护的单体FmocGly-OH(48mg,5当量(eq))(苯并三唑-1-基-氧-三-吡啶-磷代六氟磷酸酯,PyBOP,84mg,5当量)溶于1ml的DMF中,对第一个氨基酸甘氨酸进行吸附,然后添加N,N-二异丙基乙胺(DIPEA,56μl,12当量)。将溶液添加到树脂中,其中Fmoc保护的树脂已经去除,通过旋转搅拌在室温下反应1小时。通过2,4,6-三硝基苯磺酸(TNBS)检测确定反应终点。反应终止后,用二氯甲烷(1ml,5次),DMF(1ml,2次)进行搅拌后进行过滤去除溶液。如上所述,重复去除Fmoc和结合氨基酸的步骤,直到吸附最后的一个氨基酸。去除N-端的乙酰化,并将N-羟基苯并三唑(HOBt,41.2mg,10当量)、无水乙酸(29μl)溶于900μl DMF和100μl的二氯甲烷中。将该溶液添加到树脂中,室温下搅拌1小时。为从固相中分离合成的肽,添加1.5ml的裂解混合液(cleave cocktail){三氟乙酸,(TFA)/三异丙基甲硅烷(TIS)/水=95∶2.5∶2.5},并搅拌2小时。搅拌后,通过过滤去除树脂,用三氟乙酸进行洗涤(0.5ml,2次),收集剩下的肽。氮气下浓缩产生的溶液,然后用冷的二乙醚和正己烷(v/v=50/50)沉淀所述肽。13,000rpm离心5min,收集丸状的沉淀物,小心地倾去上清液。丸状沉淀用10ml的冷的二乙醚和正己烷(v/v=50/50)离心两次,倾去溶液洗涤。获得的丸状沉淀风干后溶于0.2ml的二甲基亚砜(DMSO)中,用0.45μm的注射过滤器过滤后,进行HPLC纯化。使用Waters 600HPLC作为固定相,使用XBridgeTM Prep C185μm OBDTM(19mmx150mm,Waters)柱。使用缓冲液A,含0.1%TFA的水溶液和缓冲液B,含有0.1%TFA的CH3CN之间的梯 度作为流动相用于分离。在30~35%的梯度B条件下,收集肽1,将肽冻干制备成白色粉末(4.8mg,产率8%)。所有其它的肽也按上述的方法制备。
肽1和色氨酸替换亮氨酸的肽(1a-1h)的氨基酸序列的计算重量和通过MALDI-TOF质谱分析的实际重量如表1所示。
表1
a每个肽的计算重量为(M+H+)。
实施例2miRNA前体的合成
通过体外T7聚合酶的转录,大量合成了用于测定对实施例1中合成肽的结合亲和力的RNA。添加5’接头(5’-GGGAGA-3’)以增加T7聚合酶的活性。碱基序列如表2所示。
表2
实施例3第一代肽和miRNA前体之间的解离常数的测定
使用竞争结合的方法通过荧光各向异性测定实施例1合成的肽 和实施例2合成的miRNA前体之间的结合亲和力。使用N-端结合有若丹明(rhodamine)的rev肽作为荧光探针,使用发光分光计LS-55(Perkin-Elmer)进行分析。通过水浴维持20℃常温。通过550nm的激发波长(带通路(band path)10nm)和580nm(带通路10nm)的检测波长测定200nM的若丹明-rev肽来测定荧光强度。积分时间为5秒。每个试验值均为5次试验的平均值。使用含有140mM NaCl、5mM KCl和1mM MgCl2的20mM的HEPES{4-(2-羟乙基)-1-哌嗪乙磺酸}缓冲液(pH 7.5)测定解离常数。根据数学公式1和Kaledia graph计算解离常数。
【数学公式1】
A和A0为有或没有RNA情况下的荧光各向异性,而ΔA为这两个值的差值。[RNA]0和[Rh-rev]0为RNA和结合有若丹明的rev肽的初始浓度。
分析实施例1合成的肽和实施例2合成的两个miRNA前体(pre-let7a-1,pre-miR16-1)中一个miRNA前体之间的解离常数,结果如表3所示,与未取代的肽(肽1)相比,将一个肽替换成色氨酸(肽1h)解离增加了150倍。解离常数的增加是由于肽的两个末端都发生了改变,这表明每个末端色氨酸取代的重要性(表3)。
表3第一代肽和pre-let7a-1或pre-miR16-1之间的解离常数Kda
a使用荧光标记的若丹明-rev肽通过竞争荧光各向异性方法测定Kd值。
实施例4增加了结合特异性的第二代肽的合成
为了合成与实施例1中的色氨酸扫描肽相比更为改良的肽,合成第二代肽,其中末端的一个亮氨酸被色氨酸取代而且内部6个亮氨酸中的一个也被色氨酸取代。当两个末端被色氨酸取代后该肽增加了结合亲和力,而当中间结构域内被色氨酸取代后该肽增加了结合特异性。第二该肽的设计和合成是基于实施例1的结果,其为具色氨酸取代的肽增加了结合亲和力(表4)。
表4所示为第二代肽的氨基酸序列、计算重量和MALDI-TOF分析的实际重量。
表4
a每个肽的计算重量为(M+H+).
实施例5第二代肽和miRNA前体的解离常数和特异性的测定
根据实施例3中所述的方法,通过荧光偏振检测方法和荧光探针分子测定第二代肽和2个miRNA前体之间的解离常数。
表5所示的结果表明,第二代肽对具发夹状结构的miRNA前体 表现出强且特异的结合。尤其是肽2b对pre-let7a-1RNA表现出强的结合。具有两个色氨酸取代的第二代肽的结合亲和力有一个显著的增加(是色氨酸未取代的260倍),这是由于在其它RNAs中的更好的鉴别度(鉴别比从1增加到11)。
表5第二代肽对pre-let7a-1和pre-miR16-1的Kda值
a使用荧光标记的若丹明-rev肽,通过竞争荧光各向异性测定Kd值。
如表6所示,将第二代肽中的一个肽即肽2b对靶发夹RNA、pre-let7a-1的结合亲和力(Kd值)进行比较,肽2b/pre-let7a-1的鉴别比(指对所有miRNA前体的Kd值/对靶miRNA前体的Kd值)为11。较高的鉴别比是指肽-RNA的结合有特异的识别,这表明肽2b/发夹RNA、pre-let7a-1之间的结合是非常特异的。肽2b还形成最强的结合,强度为250pM,针对其它RNAs,肽2e和pre-miR16-1的鉴别比为2.3,表明它们之间有强且特异的互作。至于pre-miR24-1,2g/pre-miR24-1的鉴别比为2.3,这表明识别较为特异。
表6第二代肽对miRNA前体或其它发夹RNA的Kda值的比较
a使用荧光标记的若丹明-rev肽,通过竞争荧光各向异性测定Kd值。
b对每个RNA的鉴别比以括号的形式表示。鉴别比定义为对其它RNA(HBV、IRES、其它miRNA)的Kd值/对靶miRNA的Kd值。
实施例6含有筛选的两亲肽的Dicer酶的活性检测
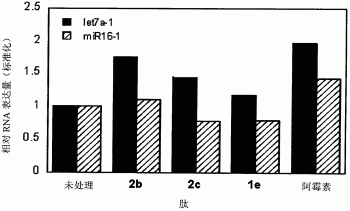
预定用于Dicer酶活性检测的两种miRNA前体(pre-let7a-1,pre-miR16-1),其由ST Pharm Co.,Ltd生产(图1)。为开展Dicer酶活性检测,合成的miRNA前体的5’端用同位素32p进行标记。使用10单位的T4多核苷酸激酶(New England Biolabs)对每个2pmol的miRNA前体用20mCi的[g-32P]ATP(New England Biolabs)进行同位素标记。总体积为10μl,37℃同位素标记1小时。用G-25Sephadex柱(Sigma)对反应后的同位素标记RNA进行纯化。纯化的底物用于测定Dicer酶的活性。含有1nM同位素标记的miRNA前体和0.001U/μl的重组人Dicer(Genlantis,CA,USA)的30μl的总反应混合物在24mM的含有200mM NaCl、0.04mM EDTA、1mMATP和2.5mM MgCl2(pH 8.0)的4-(2-羟乙基)-1-哌嗪乙磺酸(HEPES)缓冲系统中37℃温育。和400nM的肽2b或2c反应0、10、30、60或120min后,每个反应的3μl混合物和5μl的RNA凝胶上样缓冲液{95%甲酰胺、10mM乙二胺四乙酸(EDTA)、0.05%FF(二甲苯FF)}进行混合,65℃温育5min。通过含7M尿素的15%聚丙烯凝胶电泳测定反 应产物的量,然后,比较每个反应的初始反应速率(V0)。酶的初始反应速率(V0)是初始线性时间(直到30min)的反应速率。每个初始速率用每个无肽处理条件下每个底物的初始速率进行标准化。不经肽处理,Dicer酶对pre-let7a-1和pre-miR16-1初始反应速率分别为0.0071fmole/ml和0.018fmole/min。每个初始反应速率均为大于3次测定的平均值,标准差用误差线进行表示。
在含有400nM的每个肽的情况下,将miRNA前体转化成成熟的miRNA的速率,标准化后如柱状图图2所示,肽2b和pre-let7a-1之间的Dicer酶的初始反应速率有一个最快的加速。这与肽2b和pre-let7a-1之间的亲和力有关,其中,亲和力越强,Dicer的加工反应速率越快。肽2b显著增加了pre-miR16-1的加工速率,表明肽2b也能较强地结合pre-miR16-1。至于肽2c,其与pre-let7a-1和pre-miR16-1的亲和力的初始反应速率增加。与此相反,用于作为阴性对照的肽1e并没有增力Dicer加工反应的初始速率。
另外,如图3所示,加工miRNA前体的Dicer酶的初始速率取决于肽2b的浓度。根据下述的数学公式2,EC50为940nM且斜率(hillslop)为3.5。当肽2b的浓度高于100nM时,显著增加了初始反应速率。当肽2b高于1,000nM时,降低了初始反应速率。
【数学公式2】
(b;底部,t;上部)
实施例7含有筛选的两亲肽中靶miRNA生产的分析
7-1 HCT116细胞培养和总RNA的提取
HCT116细胞购自美国典型培养物保藏中心(ATCC),于RPMI1640培养基中,在37℃,5%的CO2下进行培养。用Trizol试 剂(Invitrogen),根据产品推荐的步骤提取总RNA。
用2μM的肽2b或肽2c和脂质体(lipofectamine)培养细胞,分析RNA含量的变化。
7-2Northern印迹
用2μM的肽2b、2c、1e或0.2μg/ml的阿霉素处理HCT116细胞3小时,再用Northern印迹分析成熟RNA中成熟miRNA的生产。将18S rRNA条带的亮度作为上样的对照。已表明P53诱导物阿霉素通过Drosha酶增加miRNA,将它作为阳性对照。肽1e作为阴性对照。在20mM的3-(N-吗啉代)丙磺酸(MOPS)-NaOH(pH 7.0)缓冲液中,用含有7M尿素的12.5%聚丙烯酰胺凝胶,350V将Decade标准物(marker)(Ambion公司)和10~20μg总RNA分离2小时。RNA印迹用化学交联方法。每个分离的RNA被转移到中性尼龙膜(Hybond NX,Amersham/Pharmacia)上,并用1-乙基-3-(3-二甲基氨基丙基)碳化二亚胺(EDC)交联到膜上。膜用含有50μl的10mg/ml的鲑鱼精子DNA的杂交缓冲液(Clontech,CA,USA)进行预杂交。然后,用同位素标记的与miRNA序列互补的探针DNA在相同的缓冲液条件下杂交2小时。探针用25μCi的[γ-32p]ATP(New England Biolabs)和5单位的多核苷酸激酶(New England Biolabs)进行标记。用乙醇沉淀探针,再溶于50μl的DEPC处理的水中使用。膜用200ml的含有0.3M NaCl、0.03M柠檬酸钠和0.05%十二烷基硫酸钠(SDS)(pH 7.0)的洗涤缓冲液洗涤两次,每次30min,然后用200ml的含有0.015M NaCl、0.0015M柠檬酸钠和0.1%SDS(pH 7.0)的洗涤缓冲液洗涤两次,每次15min。将膜置于感光成像仪的感光屏上,每个条带的亮度用FLA-3000进行测定,并用软件MultiGauge 3.0版(Fuji照片)进行分析。
结果如图4所示,结果表明miRNA生产的特异的变化与肽的类型有关。用肽2处理后,显著增加了let7a-1的水平。用肽2b处理 后,增加了miR16-1的水平,用肽2c处理增加了let7a-1的水平。这些趋势与在肽存在下,Dicer加工的初始速率的趋势类似。
与天然的肽相比,对发夹状靶miRNA前体具有特异性和强结合强度的人工肽可通过本发明制备。这种强且特异的结合诱导了Dicer酶的活性和选择性,增加了成熟的靶miRNA生产。按本发明上述方法筛选的肽可有效应用于研究miRNA的功能和开发新异的用于治疗miRNA相关疾病的治疗药物。
促进靶miRNA生产的两亲肽和调控靶miRNA生产的方法专利购买费用说明
![]()
Q:办理专利转让的流程及所需资料
A:专利权人变更需要办理著录项目变更手续,有代理机构的,变更手续应当由代理机构办理。
1:专利变更应当使用专利局统一制作的“著录项目变更申报书”提出。
2:按规定缴纳著录项目变更手续费。
3:同时提交相关证明文件原件。
4:专利权转移的,变更后的专利权人委托新专利代理机构的,应当提交变更后的全体专利申请人签字或者盖章的委托书。
Q:专利著录项目变更费用如何缴交
A:(1)直接到国家知识产权局受理大厅收费窗口缴纳,(2)通过代办处缴纳,(3)通过邮局或者银行汇款,更多缴纳方式
Q:专利转让变更,多久能出结果
A:著录项目变更请求书递交后,一般1-2个月左右就会收到通知,国家知识产权局会下达《转让手续合格通知书》。
动态评分
0.0