IPC分类号 : C07D313/00,A61P29/00,A61P31/00
专利摘要
本发明涉及一种三氟甲基修饰的(+)-Patulolide?C,通过在(+)-Patulolide?C上添加三氟甲基,预期能够得到良好的抗菌性和抗炎活性。本发明还涉及制备该三氟甲基修饰的(+)-Patulolide?C的方法。
权利要求
1.一种三氟甲基修饰的(+)-PatulolideC,其特征在于,其结构式为化学式(15)所示,
2.根据权利要求1所述的三氟甲基修饰的(+)-PatulolideC,其特征在于,其以1,8-辛二醇为起始原料。
3.一种制备权利要求1或2所述的三氟甲基修饰的(+)-PatulolideC的方法,其特征在于,包括以下步骤:
步骤一:使1,8-辛二醇与TBSCl反应得到化合物(9)
步骤二:所述化合物9经IBX氧化得到醛,使所述醛与CF3TMS反应,然后加入TBAF将TBS完全脱除得到化合物(10)
步骤三:化合物(10)与TBSCl反应,得到单一的化合物(11)
步骤四:使化合物(11)与丙烯酰氯反应得到化合物(12)
步骤五:化合物(12)脱除TBS保护基,得到化合物(13)
步骤六:化合物(13)经Dess-Martin氧化得到中间体醛,再经快速柱层析后与格氏试剂反应得到化合物(14)
步骤七:化合物(14)利用RCM关环反应合成目标产物化合物(15)
4.根据权利要求3所述的方法,其特征在于,所述步骤一中为了得到化合物(9),在反应中选择性地将1,8-辛二醇的一端的羟基保护。
5.根据权利要求3所述的方法,其特征在于,所述步骤二中的反应是在TBAF的催化下进行的。
6.根据权利要求3所述的方法,其特征在于,所述步骤三中的反应是以Et3N为碱而发生的。
7.根据权利要求3所述的方法,其特征在于,所述步骤四中的反应是在二氯甲烷中进行的。
8.根据权利要求3所述的方法,其特征在于,所述步骤五中的反应是在TBAF与乙酸的共同作用下进行的。
9.根据权利要求3所述的方法,其特征在于,所述步骤六中的格氏试剂为乙烯基格氏试剂。
10.根据权利要求3所述的方法,其特征在于,所述步骤七中的反应是在Grubbs二代催化剂的催化下进行的。
说明书
技术领域
本发明涉及一种三氟甲基修饰的化合物,更具体地涉及一种三氟甲基修饰的(+)-PatulolideC及其制造方法。
背景技术
有机氟化学的历史可以追溯到19世纪末。1886年H.Moissan用电解法首次合成了单质氟,真正意义上开启了氟化学的大门。1896年,F.Swarts等合成了一氟乙酸乙酯,由此揭开了研究有机氟化学的序幕。此后有机氟化学取得了长足的进步,已经深入医药科学、生命科学、材料科学等诸多学科,并在工业、医学、航天航空等众多领域得到了日益广泛的重视和应用。
关于含氟生理活性物质的研究则始于1954年。当年,J.Fried等发现9α-氟代醋酸可的松比相应的醋酸可的松作为糖皮激素,其消炎活性高10-12倍以上,第一次向人们展示了将氟原子引入到有机分子中对于改善其生理活性的重要作用。1957年,5-氟尿嘧啶的合成开创了癌症治疗史上的新局面,让人们再一次领略到氟原子在药物设计中独特的魅力。如今,众多有机化学家和药物学家投入到相应的工作当中,大量具有生理活性的含氟有机化合物被合成出来。据最近的一项统计显示,在上世纪80年代之前,每年只有一到三个含氟药物上市,然而,自从1973年选择性氟化试剂DAST((Diethylamino)sulfurtrifluoride)报道后,1982年后上市的含氟药物数量明显增加(见图1)。
2006年,美国化学会《Chemical&EngineeringNews》以CoverStory的形式介绍了氟在医药科学中的应用。文中指出,目前上市的农药中有30-40%含氟,而含氟药物则占到了上市药物的20%。2007年,《Science》发表了有关含氟药物的综述,该文通过从“CambridgeStructuralDatabase”和“TheProteinDataBank”二个数据库中对含氟化合物的晶体结构与蛋白质结构的作用分析来说明氟原子对生物活性的影响。
2008年,美国康纳尔大学的J.T.Njardarson教授总结了当年世界销售额前200名的药物,其中含氟药物有33种,占16.5%。在销量排名前50的药物中,含氟药物则是占到了1/5。第一名更是被美国辉瑞公司治疗高脂血、高胆固醇血症的含氟药物LIPITOR(立普妥)所占据,其销量为136亿美元,比第二名的美国施贵宝公司的抗血小板药物PLAVIX(保栓通,86亿美元)多出了58%(见下表1)。
表1.2008年全球销售额排名前50位药物中的含氟药物*
*根据美国康纳尔大学J.T.Njardarson教授小组网页原始数据整理
大量事实表明,将氟原子或含氟基团选择性地引入有机分子能显著改变原有分子的生理活性,因此含氟化合物在医药领域得到越来越广泛的利用,这主要是缘于氟原子以下独特的性质:
1、氟原子与氢原子的范德华半径非常接近( ),使得氟原子代替分子中的氢原子后整个分子体积变化不大,因而不容易被生物体内的酶受体所识别,能顺利地代替非氟母体进入生物体的代谢过程,即产生所谓的“伪拟效应”。
2、除了氢原子可以被氟替代以外,有机活性分子中的其他一些原子和官能团同样可以用氟原子或含氟基团来模拟。这就是所谓的“生物等位体”原理。它既可以在几何学上对另一官能团进行模拟,也可以模拟母体分子的极性和静电荷分布形态。一般来说,生物标靶分子的结构并不能区分同属的和生物等位体之间的差别。比如,氟原子半径与羟基非常接近,所以氟原子经常用于模拟羟基,表现出“伪拟效应”。又如,二氟亚甲基是醚氧的等极体(isopolar)和等体体(isosteric),在很多场合能替代氧原子,表现出重要的生理特性。其中一个著名的例子就是将磷酸酯中的氧原子用二氟亚甲基取代,改造后的分子既保持了原有磷酸酯的生物活性,同时大大增强了其稳定性,从而能发挥更有效的作用。
3、氟原子的电负性是所有原子中最高的(C:2.6,H:2.2,F:4.0)。从微观上讲,分子中引入氟原子后电子云分布将会发生偏移,使得分子的电子性质、偶极矩和酸碱性等受到影响,同时邻位基团的反应性也将发生变化。这在宏观上就表现为许多含氟有机化合物与相应的非氟化合物相比,往往在化学、物理性质上均有很大的改变。从生理学水平看,就是在代谢过程中含氟底物会以不同于非氟母体的方式与受体结合,从而导致不同的生化反应,引发不同的代谢过程,使受体不可逆失活。这是很多含氟药物设计的基础。
4、许多药物由于代谢降解速度太快,不仅降低了疗效,同时也增加了肝、肾的负担,限制了其在临床上的应用。有些药物更是在代谢的过程中产生了有毒或能诱导有机体突变的物质,根本不能应用于临床。而碳-氟键的键能很高(C-F:115.7kcal/mol;C-H:98.0kcal/mol),而且氟原子很难以正离子或自由基的形式离去,所以不能以断裂碳-氢键的方式来断裂碳-氟键。因此,在底物特定部位中引入氟原子,能选择性地阻止一些我们不希望的代谢途径。
5、将氟原子引入有机分子常常能增加分子的亲脂性,这就使得含氟化合物在生物体内对膜、组织的穿透能力增强,从而提高了含氟化合物在生物体内的吸收和传输速度。
6、近年来的研究表明,碳-氟键中的氟原子能与分子中的缺电子中心(如酸性的质子、碳基、氰基等)相互吸引产生氢键等弱相互作用,从而影响分子的构象、与受体的结合方式以及反应性等。
正是由于氟原子的上述特性,含氟有机化合物的应用越来越广泛,对于含氟有机化合物品种和数量上的需求也越来越大,含氟药物的被关注程度更是与日俱增。
然而在自然界中,天然的含氟有机物非常少见,只有在少量的热带和亚热带植物,以及两种放线菌中分离得到。事实上到目前为止,自然界中发现的含氟有机化合物仅有12种。因此,向有机分子中选择性地引入氟原子或含氟基团以合成含氟有机物一直是化学家们孜孜以求的研究领域。
(+)-PatulolideC是Yamada教授从青霉菌斑(Penicilliumurticae)S11R59中分离得到的。它是一个十二环内酯化合物,且具有非常好的抗菌和抗炎活性。由于(+)-PatulolideC独特的结构特征及其所表现出的生物活性,化学家对其表现出了极大的兴趣。早在1992年,以Irie教授为代表的多个课题组利用Yamaguchi内酯化反应实现了十二环的构建,随后又有多个小组分别利用Mitsunobu内酯化反应、Shiina内酯化反应和关环复分解反应完成了PatulolideC的合成。2012年,Steven教授利用烯烃的氢化羰基化-大环内酯化串联反应实现了PatulolideC的合成。虽然PatulolideC全合成报道较多,但鲜有人对其构效关系进行研究。
众所周知,三氟甲基的强吸电性使得含三氟甲基的有机化合物其代谢稳定性和亲酯性都得以增强。近年来,三氟甲基也越来越多地出现在药物分子中。因此将三氟甲基引入到PatulolideC中,无疑也是具有吸引力的。基于对含氟生物活性物质的研究兴趣,我们设计将三氟甲硫基引入PatulolideC的C(11)位,利用三氟甲基的立体电子效应,希望能提高其抗菌和抗炎活性(参见附图2)。
发明内容
从附图3可以看出,以1,8-辛二醇为起始原料,经过8步反应即可制得化合物8。于是,我们将1,8-辛二醇与1.0当量的苯甲酰氯反应,选择性将一端的羟基保护得化合物1。化合物1在二甲基亚砜中与IBX反应,能以82%的收率得到醛2。醛2无需纯化直接用于下一步反应,在TBAF的催化下与CF3TMS反应,能以中等的收率得到化合物3。化合物3在NaH的作用下与BnBr反应,并且以较高的分离收率得到化合物4。在1%的KOH甲醇溶液中,化合物4顺利脱除Bz得到化合物5。化合物5经Dess-Martin氧化得到中间体醛6,醛6经柱层析快速分离后,与乙烯基格式试剂反应,能以两步50%的收率得化合物7。化合物7的羟基用Bz保护即可制备关键中间体8。然而,中间体8在BCl3的作用下,并不能将苄基脱除,原料没有反应。而使用Me3SiI脱苄基时,化合物8仍不反应。
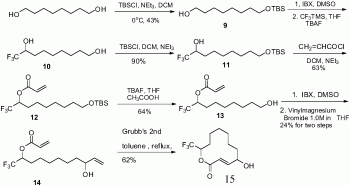
本发明的发明人在经过大量的条件摸索(反应投料比、温度和反应时间)后,化合物8均不能有效地脱除苄基。随后,我们重新设计了如下路线(参见图4)。即1,8-辛二醇与1.0当量的TBSCl反应,选择性将一端的羟基保护得化合物9。化合物9经IBX氧化所得的醛无需纯化,在TBAF的催化下直接与CF3TMS反应,最后加入2.0eq的TBAF将TBS完全脱除得到化合物10。以Et3N为碱,化合物10的伯羟基能顺利地与TBSCl反应,单一的得到化合物11。这是由于三氟甲基的位阻比较大,阻止了化合物10的仲羟基与TBSCl反应。在二氯甲烷中,化合物11与丙烯酰氯反应,能以63%的收率得到化合物12。在TBAF和乙酸的共同作用下,化合物12顺利脱除了TBS保护基,以64%的收率得到化合物13。化合物13经Dess-Martin氧化得到中间体醛,经快速柱层析后,与乙烯基格式试剂反应,两步能以24%的收率得化合物14。这两步产率偏低,是因为中间体醛上的酯基也能和乙烯基格式试剂反应。最后,化合物14在Grubbs二代催化剂的催化下,我们顺利地利用RCM关环反应合成了11-trifluoromethyl-PatulolideC。
附图说明
图1为1957-2006年上市的含氟药物及其占据总体上市药物的份额数据图;
图2为由(+)-PatulolideC制得三氟甲基修饰的(+)-PatulolideC的示意图;
图3为三氟甲基修饰的(+)-PatulolideC的合成中存在问题的工艺流程的示意图;
图4为本发明的能够顺利得到三氟甲基修饰的(+)-PatulolideC的工艺流程图。
具体实施方式
以下结合实施例来具体描述本发明的三氟甲基修饰的(+)-PatulolideC的制备过程,但本发明并不是所描述的具体实施例的任何限定。
将26.4g1,8-辛二醇溶解在300mL无水四氢呋喃中,加入22g三乙胺,降温至0~5℃,控温滴加25.4gBzCl,滴毕,保温0~5℃反应1小时。过滤滤除固体,母液减压旋除溶剂,残留物溶于二氯甲烷,分别用1N盐酸和食盐水洗,分离出有机相,无水硫酸钠干燥,减压旋除溶剂后粗品柱层析分离得到25.3g化合物1(产率:56%)。
1HNMR(400MHz,CDCl3)δ7.98(d,J=7.6Hz,2H),7.48(t,J=7.6Hz,1H),7.37(t,J=7.6Hz,2H),4.25(t,J=6.8Hz,2H),3.56(t,J=6.8Hz,2H),2.83(br,1H),1.73-1.66(m,2H),1.52-1.47(m,2H),1.39-1.29(m,8H)。
将25.3g化合物1溶解到250mLDMSO中,分批加入42.4gIBX,加毕,rt搅拌反应4小时。将上述反应体系倒入150mL冰水中,搅拌分散固体,硅藻土过滤,滤饼用二氯甲烷反复洗涤,分液,合并有机相,无水硫酸钠干燥,减压旋除溶剂后粗品柱层析分离,得到20.6g化合物2(产率:82%)。
1HNMR(400MHz,CDCl3)δ9.72(t,J=1.2Hz,1H),8.00(d,J=9.6Hz,2H),7.52(t,J=9.6Hz,1H),7.40(t,J=9.6Hz,2H),4.28(t,J=6.8Hz,2H),2.39(td,J=7.2Hz,1.6Hz,2H),1.76-1.70(m,2H),1.64-1.57(m,2H),1.44-1.31(m,6H)。
将20.6g化合物2溶解在200mL无水四氢呋喃中,降温至-5~0℃,加入17.9gCF3TMS,控温缓慢滴加6.6mLTBAF(1.0M四氢呋喃溶液),滴毕,升温至20~25℃反应过夜。加入60mL1N盐酸淬灭,减压旋除溶剂,残留物用300mL二氯甲烷溶解,分液,有机相用无水硫酸钠干燥,减压浓缩后的粗品柱层析分离得到14g化合物3(产率:53%)。
1HNMR(400MHz,CDCl3)δ8.02(d,J=7.6Hz,2H),7.54(t,J=7.6Hz,1H),7.42(t,J=7.6Hz,2H),4.30(t,J=6.8Hz,2H),3.91-3.87(m,1H),1.77-1.55(m,5H),1.43-1.33(m,7H);13CNMR(100MHz,CDCl3)δ166.8,132.8,130.4,129.5,128.3,125.2(q,J=280.5Hz),70.4(q,J=30.6Hz),65.0,29.5(q,J=1.5Hz),29.0,28.9,28.6,25.8,24.8;19FNMR(376MHz,CDCl3)δ-80.1(d,J=6.8Hz,3F)。
将1.6g60%氢化钠、100mL无水四氢呋喃和0.8gBu4NI依次加入反应瓶中,降温至-5~0℃,控温滴加化合物3和40mL无水四氢呋喃的混合溶液,滴毕,搅拌反应1小时。控温滴加9gBnBr,滴毕,反应3h。滴加饱和氯化铵淬灭反应,减压浓缩溶剂后用加入200mL二氯甲烷,分液,有机相用无水硫酸钠干燥,减压旋除溶剂得到粗品,柱层析分离得到15.8g化合物4(Yield:88%)。
1HNMR(400MHz,CDCl3)δ8.05-8.03(m,2H),7.57-7.53(m,1H),7.43(t,J=8.0Hz,2H),7.35-7.30(m,5H),4.70(dd,J=110.0Hz,11.2Hz,2H),4.30(t,J=6.8Hz,2H),3.68-3.66(m,1H),1.78-1.71(m,2H),1.66-1.60(m,2H),1.43-1.23(m,8H);19FNMR(376MHz,CDCl3)δ-76.4(d,J=6.8Hz,3F)。
将15.8g化合物4溶解在150mL甲醇中,加入24g10%氢氧化钾水溶液,加热回流反应3小时。减压浓缩溶剂,残留物用二氯甲烷萃取,合并有机相,用无水硫酸钠干燥,旋除溶剂后得到粗品,柱层析分离得到7.4g化合物5(产率63%)。
1HNMR(400MHz,CDCl3)δ7.36-7.30(m,5H),4.69(dd,J=109.6Hz,11.2Hz,2H),3.69-3.60(m,3H),1.65-1.47(m,5H),1.35-1.25(m,8H);19FNMR(376MHz,CDCl3)δ-76.4(d,J=6.8Hz,3F)。
将7.4g化合物5溶解在150mL二氯甲烷中,水浴控温20~25℃,分批加入30.9gDess-MartinReagent,加毕,控温反应4小时。将反应体系倒入200mL冰水中,搅拌分散析出的固体,硅藻土过滤,滤饼用二氯甲烷充分洗涤,分液,有机相用无水硫酸钠干燥,旋除溶剂后得到化合物6。
1HNMR(400MHz,CDCl3)δ9.75(d,J=1.6Hz),7.38-7.25(m,5H),4.70(dd,J=113.2Hz,11.2Hz,2H),3.69-3.64(m,1H),2.42-2.31(m,2H),1.65-1.49(m,5H),1.27-1.24(m,5H);19FNMR(376MHz,CDCl3)δ-76.4(d,J=6.8Hz,3F)。
将上步所得化合物6溶解在无水四氢呋喃中,冷却至-50~-40℃,控温滴加1.0M乙烯基溴化镁的四氢呋喃溶液24mL,滴毕,保温反应1小时。用饱和氯化铵淬灭反应,分层,水层用乙酸乙酯萃取,合并有机相,无水硫酸钠干燥,减压旋除溶剂后得到粗品,柱层析分离得到化合物74.0g(Yield:50%fortwosteps)。
1HNMR(400MHz,CDCl3)δ7.39-7.30(m,5H),5.90-5.82(m,1H),5.22(dt,J=17.2Hz,1.6Hz,1H),5.10(dd,J=11.6Hz,0.8Hz,1H),4.33(dd,J=110.0Hz,11.2Hz,1H),4.08(q,J=6.8Hz,1H),3.70-3.65(m,1H),1.67-1.26(m,12H);19FNMR(376MHz,CDCl3)δ-76.4(dd,J=6.8Hz,4.1Hz,3F)。
将4.0g化合物7溶解在40mL四氢呋喃中,加入1.5g三乙胺,降温至0~5℃,滴加BzCl,滴毕,保温反应1小时。过滤除去固体,滤液减压浓缩后用100mL二氯甲烷溶解,水洗,分出有机相,用无水硫酸钠干燥,减压浓缩得粗品,柱层析得到化合物84.3g(Yield81%)。
1HNMR(400MHz,CDCl3)δ8.06(d,J=7.6Hz,2H),7.56(t,J=7.6Hz,1H),7.44(t,J=7.6Hz,2H),7.35-7.30(m,5H),5.93-5.84(m,1H),5.48(q,J=6.4Hz,1H),5.32(dt,J=17.2Hz,1.2Hz,1H),5.20(dt,J=10.4Hz,1.2Hz,1H),4.70(dt,J=110.4Hz,11.2Hz,1H),3.68-3.63(m,1H),1.79-1.60(m,4H),1.39-1.24(m,8H);19FNMR(376MHz,CDCl3)δ-76.4(d,J=6.8Hz,3F)。
1)将100mg化合物8溶解在无水四氢呋喃中,降温至5~10℃,滴加88mg三氯化硼乙醚络合物,滴毕升温至RT反应过夜,TLC显示无反应。
2)将100mg化合物8溶解在无水四氢呋喃中,降温至5~10℃,加入92mg三甲基碘硅烷,升温至RT反应过夜,TLC显示无反应。
将20g1,8-辛二醇溶解在300mL二氯甲烷中,加入27.6g三乙胺,降温至5~10℃,滴加21gTBSCl和50mL二氯甲烷的混合溶液,滴毕保温反应1小时。加入100mL水淬灭反应,分液,有机相用无水硫酸钠干燥,减压浓缩后得粗品,柱层析分离得到15.3g化合物9(产率:43%)。
1HNMR(400MHz,CDCl3)δ3.61-3.54(m,4H),1.54-1.45(m,5H),1.33-1.27(m,8H),0.85(s,9H),0.01(s,6H)。
将15.3g化合物9溶解在150mLDMSO中,控温20~25℃,分批加入24.7gIBX,加毕,保温反应4小时。将反应体系倒入300mL冰水中,搅拌使析出的固体分散,硅藻土过滤,滤饼用二氯甲烷充分洗涤,分液,合并有机相,用无水硫酸钠干燥,减压浓缩,残留物用150mL无水四氢呋喃溶解,降温至-5~0℃,加入12.5gCF3TMS,控温滴加4.7mLTBAF(1.0M的TBAF四氢呋喃溶液),加毕,室温反应过夜。加入50mL1N盐酸淬灭反应,减压旋除溶剂,残留物加入200mL二氯甲烷,分液,有机相用无水硫酸钠干燥,减压浓缩后得到化合物10。
将化合物10溶解在150mL二氯甲烷中,加入7.1g三乙胺,降温至5~10℃,控温滴加9.7gTBSCl和30mL二氯甲烷的混合溶液,滴毕,室温反应3小时。加入80mL水淬灭反应,分液,有机相用无水硫酸钠干燥,减压浓缩得到粗品,柱层析分离得到11g化合物11(三步的产率:57%)。
1HNMR(400MHz,CDCl3)δ3.87-3.86(m,1H),3.57(t,J=6.8Hz,2H),2.12(br,1H),1.67-1.29(m,12H),0.86(s,9H),0.02(s,6H);19FNMR(376MHz,CDCl3)δ-80.1(d,J=6.8Hz,3F)。
反应瓶中,依次加入11g化合物11、100mL二氯甲烷和4.1g三乙胺,降温至0~5℃,滴加3.3g丙烯酰氯,滴毕,保温反应1小时。加入30mL水淬灭反应,分液,有机相用无水硫酸钠干燥,减压浓缩得粗品,柱层析分离得到8.1g化合物12(产率:63%)。
1HNMR(400MHz,CDCl3)δ6.49(dd,J=17.6Hz,1.2Hz,1H),6.15(dd,J=17.6Hz,10.8Hz,1H),5.93(dd,J=10.8Hz,1.2Hz,1H),5.37-5.32(m,1H),3.57(t,J=10.8Hz,1H),1.79-1.73(m,2H),1.49-1.46(m,2H),1.32-1.24(m,8H),0.87(s,9H),0.02(s,6H);13CNMR(100MHz,CDCl3)δ164.5,132.7,127.1,123.8(q,J=279.4Hz),69.7(q,J=31.9Hz),63.2,32.7,29.0,27.8(q,J=1.5Hz),25.9,25.6,24.4,18.3,-4.9,-5.3;19FNMR(376MHz,CDCl3)δ-77.2(d,J=6.8Hz,3F)。
将8.1g化合物12用80mL无水四氢呋喃溶解,降温至0~5℃,滴加4.5g冰醋酸,滴毕,保温搅拌15分钟,滴加64mLTBAF(1.0M的TBAF四氢呋喃溶液),滴毕,自然升温至RT反应过夜。将反应体系倒入300mL冰水中,二氯甲烷萃取,合并有机相,用无水硫酸钠干燥,减压浓缩得粗品,柱层析分离得到3.6g化合物13(产率:64%)。
1HNMR(400MHz,CDCl3)δ6.48(dd,J=17.2Hz,0.8Hz,1H),6.15(dd,J=17.6Hz,10.8Hz,1H),5.92(dd,J=10.4Hz,1.2Hz,1H),5.37-5.29(m,1H),3.59(t,J=6.8Hz,1H),1.80-1.72(m,2H),1.65(br,1H),1.53-1.48(m,2H),1.30-1.23(m,8H);13CNMR(100MHz,CDCl3)δ164.6,132.8,125.2,123.8(q,J=280.0Hz),69.6(q,J=31.9Hz),62.8,32.6,29.0,28.9,27.7(q,J=1.5Hz),25.5,24.4;19FNMR(376MHz,CDCl3)δ-77.2(d,J=6.8Hz,3F)。
将3.6g化合物13溶解在40mLDMSO中,控温20~25℃,分批加入5.6gIBX,加毕,保温反应4小时。将反应体系倒入100mL冰水中,析出固体,搅拌使固体分散,硅藻土过滤,滤饼用二氯甲烷充分洗涤,分液,水相用二氯甲烷萃取,合并有机相,用无水硫酸钠干燥,减压浓缩,残留物用50mL无水四氢呋喃溶解,降温至-50~-40℃,控温滴加13mL1.0M的乙烯基溴化镁的四氢呋喃溶液,滴毕保温反应1小时。用10mL饱和氯化铵淬灭反应,分液,水相用15mL乙酸乙酯萃取,合并有机相,无水硫酸钠干燥,减压旋除溶剂得到粗品,柱层析分离得到0.95g化合物14(两步产率:24%)。
1HNMR(400MHz,CDCl3)δ6.48(dd,J=17.6Hz,1.2Hz,1H),6.18-6.11(m,1H),5.95-5.92(m,1H),5.87-5.79(m,1H),5.37-5.31(m,1H),5.18(d,J=17.2Hz,1H),5.07(d,J=10.4Hz,1H),4.05(q,J=6.4Hz,1H),1.77-1.74(m,2H),1.49-1.47(m,2H),1.30-1.23(m,8H);13CNMR(100MHz,CDCl3)δ164.6,132.8,127.0,123.8(q,J=279.2Hz),69.7(q,J=31.9Hz),62.8,32.6,29.0,28.9,27.8,25.5,24.4;19FNMR(376MHz,CDCl3)δ-77.2(d,J=6.4Hz,3F)。
将50mg化合物14溶解在300mL重蒸甲苯中,加入11gGrubbscatalystⅡ,氮气置换三次,升温回流反应48小时,冷却至室温,减压浓缩得到粗品,柱层析得到目标化合物。
1HNMR(400MHz,CDCl3)δ6.48(dd,J=17.2Hz,1.2Hz,1H),6.14(dd,J=17.2Hz,10.4Hz,1H),5.93(dd,J=10.0Hz,0.8Hz,1H),5.36-5.31(m,1H),2.42-2.35(m,4H),1.78-1.72(m,2H),1.60-1.49(m,2H),1.35-1.23(m,7H),1.02(t,J=7.2Hz,3H);13CNMR(100MHz,CDCl3)δ211.7,164.6,132.8,127.0,123.8(q,J=279.3Hz),69.6(q,J=31.3Hz),42.2,35.9,28.85,28.82,27.7(q,J=1.5Hz),24.3,23.6,7.819FNMR(376MHz,CDCl3)δ-77.2(d,J=6.8Hz,3F).
以上所述仅为本发明的较佳实施例,并非用来限定本发明的实施范围;如果不脱离本发明的精神和范围,对本发明进行修改或者等同替换,均应涵盖在本发明权利要求的保护范围当中。
产业上的实用性
本发明提供了一种三氟甲基修饰的(+)-PatulolideC,由于纳入了三氟甲基,因此能够预期其抗菌性和抗炎活性均高于现有的普通(+)-PatulolideC。本发明还提供了用于制备该三氟甲基修饰的(+)-PatulolideC的方法,该方法能够迅速高效地制备该三氟甲基修饰的(+)-PatulolideC,因此拥有良好的应用前景。
一种三氟甲基修饰的(+)-PatulolideC及其制造方法专利购买费用说明
![]()
Q:办理专利转让的流程及所需资料
A:专利权人变更需要办理著录项目变更手续,有代理机构的,变更手续应当由代理机构办理。
1:专利变更应当使用专利局统一制作的“著录项目变更申报书”提出。
2:按规定缴纳著录项目变更手续费。
3:同时提交相关证明文件原件。
4:专利权转移的,变更后的专利权人委托新专利代理机构的,应当提交变更后的全体专利申请人签字或者盖章的委托书。
Q:专利著录项目变更费用如何缴交
A:(1)直接到国家知识产权局受理大厅收费窗口缴纳,(2)通过代办处缴纳,(3)通过邮局或者银行汇款,更多缴纳方式
Q:专利转让变更,多久能出结果
A:著录项目变更请求书递交后,一般1-2个月左右就会收到通知,国家知识产权局会下达《转让手续合格通知书》。
动态评分
0.0