IPC分类号 : C12N15/31,C12N1/21,C07K14/36,C12P29/00,C12R1/465N
专利摘要
本申请公开了利用土霉素正调控基因构建重组菌和提高土霉素产量的方法。土霉素正调控基因otcR,选自编码序列表的氨基酸序列3所示的正调控蛋白OtcR的基因;和编码具有所述OtcR蛋白活性的多肽的基因中的一个,优选序列表的核苷酸序列1所示基因。利用该基因构建一系列多个拷贝的otcR过表达质粒,并将这些重组质粒分别整合到龟裂链霉菌基因组上,增强土霉素合成的代谢途径,获得高产土霉素的工程菌株。本发明的工程菌株制备简单易得,土霉素产量高。
权利要求
1.一种土霉素合成的正调控基因otcR,所述基因为选自编码序列表的氨基酸序列3所示的正调控蛋白OtcR的基因;和编码具有所述OtcR蛋白活性的多肽的基因中的一个;优选地,所述基因为序列表的核苷酸序列1所示基因。
2.一种土霉素合成的正调控蛋白OtcR,所述蛋白为序列表的氨基酸序列3所示的蛋白。
3.一种重组龟裂链霉菌,所述重组龟裂链霉菌是在产土霉素的龟裂链霉菌中过表达序列表的序列3所示的OtcR蛋白的菌株。
4.根据权利要求3所述的重组龟裂链霉菌,其中所述重组龟裂链霉菌的基因组中包含至少2个,优选2~6个,更优选3~4个拷贝的土霉素合成的正调控基因otcR,所述基因为选自编码序列表的氨基酸序列3所示的正调控蛋白OtcR的基因,和编码具有所述OtcR蛋白活性的多肽的基因中的一个;优选地,所述基因为序列表的核苷酸序列1所示基因。
5.根据权利要求3所述的重组龟裂链霉菌,其中所述过表达序列表的序列3所示的OtcR蛋白的方法包括:构建含至少1个,优选1~5个,更优选为2~3个拷贝的otcR基因的重组质粒,并将所述重组质粒整合到龟裂链霉菌的基因组上,其中所述otcR基因是选自编码所述OtcR蛋白或具有所述OtcR蛋白活性的多肽的核苷酸序列和编码具有所述OtcR蛋白活性的多肽的基因中的一个;优选地,所述otcR基因是序列表中核苷酸序列1。
6.根据权利要求5所述的重组龟裂链霉菌,其中所述重组质粒以pGusT-SF14为出发质粒,以序列表的序列2所示的SF14组成型启动子为启动子。
7.一种利用产土霉素的龟裂链霉菌提高土霉素产量的方法,所述方法包括利用基因重组技术使所述龟裂链霉菌过表达序列表的序列3所示的OtcR蛋白,和发酵培养该重组的龟裂链霉菌。
8.根据权利要求7所述的方法,其中所述使所述龟裂链霉菌过表达序列表的序列3所示的OtcR蛋白包括以下步骤:构建包含至少1个、优选2~5个、更优选2~3个拷贝的otcR基因的重组质粒,和将所述重组质粒整合到龟裂链霉菌的基因组上,其中otcR基因选自编码序列表中氨基酸序列3所示的OtcR蛋白的基因和编码具有所述OtcR蛋白活性的多肽的基因中的一个;优选地,所述otcR基因是序列表中核苷酸序列1。
9.根据权利要求8所述的方法,所述重组质粒采用pGusT-SF14为出发质粒,序列表的核苷酸序列2为所示的SF14组成型启动子。
10.根据权利要求1所述的基因或根据权利要求2所述的蛋白在微生物发酵生产土霉素中提高土霉素产量的用途。
说明书
技术领域
本发明属于微生物制药领域,具体涉及土霉素正调控基因重组质粒及高产土霉素工程菌株的构建,为医药及工业生产提供了一种提高土霉素产量的方法。
背景技术
链霉菌(Streptomyces)常见于土壤及腐烂植物中,为好氧、具有丝状分枝细胞的革兰氏阳性菌,属于原核生物界放线菌纲链霉菌科。链霉菌的一个重要生理特点是能合成丰富的、类型多样的有着重要医药及工农业应用价值的次级代谢产物,如:抗生素、抗肿瘤化合物、免疫调节剂和杀虫剂等。在已知的由微生物产生的抗生素中,约三分之二源自放线菌,而其中的80%以上又来源于链霉菌,因而链霉菌被人们称为药物的天然合成工厂。
龟裂链霉菌(Streptomycesrimosus)是土霉素(Oxytetracycline,OTC)的生产菌,目前关于龟裂链霉菌的遗传学研究主要集中在俄罗斯国家工业微生物保藏中心和全俄抗生素研究中心、英国Pfizer制药研究中心和克罗地亚PLIVA研究所等。已公开的研究的菌株名称分别是Russian(LS-TI18),Pfizer(M4018)和Zagreb(R6)。同时在世界上最大的生物资源中心——美国模式培养物集存库(Americantypeculturecollection,ATCC)中,保存有编号10970的龟裂链霉菌菌株,该菌株常作为研究土霉素合成代谢途径的模式菌株。2013年,Streptomycesrimosussubsp.rimosusATCC10970全基因组测序完成并公开(GenBank:ANSJ00000000,http://www.ncbi.nlm.nih.gov/nuccore/ANSJ00000000.Pethick,F.E.,etal..DraftGenomeSequenceoftheOxytetracycline-ProducingBacteriumStreptomycesrimosusATCC10970.GenomeAnnounc,2013,1(2):e0006313.);2014年,曾经用于工业生产土霉素的菌株StreptomycesrimosusR6-500全基因组测序完成并公布(Genbank:JMGY00000000,http://www.ncbi.nlm.nih.gov/nuccore/JMGY00000000.Baranasic,D.,etal.(2014)."GenomeSequencesoftheOxytetracyclineProductionStrainStreptomycesrimosusR6-500andTwoMutantswithChromosomalRearrangements."GenomeAnnounc2(4).)。在前期的研究和已公布的龟裂链霉菌全基因组序列基础上,近年来TangYi等研究团队深入全面的揭示了土霉素的合成代谢途径(Pickens,L.B.andY.Tang.Oxytetracyclinebiosynthesis.JBiolChem,2010,285(36):27509-27515.),对土霉素合成途径的20个结构基因进行了实验研究和功能预测,然而土霉素合成途径中调控基因的研究仍是一块空白。
土霉素是四环素类广谱抗生素,对革兰氏阳性菌、革兰氏阴性菌、支原体、衣原体、立克次氏体等引起的感染有很好疗效,在畜牧业以及水产养殖方面也具有广泛的应用,因此具有重要的市场价值。土霉素的主要作用机制是能特异性地与细菌核糖体30S亚基的A位置结合,阻止氨酰tRNA核糖体复合体的形成,进而抑制蛋白质肽链的增长(PetkovicH,CullumJ,HranueliD,etal.GeneticsofStreptomycesrimosus,theOxytetracyclineProducer.MicrobialMolBiolR,2006,70(3):704-728)。自然界分离得到的野生菌株生产抗生素的水平一般很低,不符合工业化生产的要求,因此如何将野生低产菌株改造成为适合大规模发酵的高产菌株,成为微生物制药能否真正产业化的关键。目前改造的方法有传统物理化学诱变,基因组改组,核糖体工程等;此外还有一些代谢工程的方法,比如启动子替换,增加结构基因或合成途径中限速酶的拷贝数,失活阻遏蛋白,过表达正调控基因或途径特异性激活子等方法。放线菌中的绝大部分途径特异性的激活子都属于链霉菌抗生素调控蛋白(StreptomycesAntibioticRegulatoryProteins,SARP)家族。过表达SARP家族的正调控因子可导致多种抗生素产量的提高,如过表达redD和actII-orf4导致天蓝色链霉菌(Streptomycescoelicolor)中放线紫红素和十一烷基灵菌红素产量提高(Fernandez-Moreno,M.A.,J.L.Caballero,D.A.Hopwood,andF.Malpartida.Theactclustercontainsregulatoryandantibioticexportgenes,directtargetsfortranslationalcontrolbythebldAtRNAgeneofStreptomyces.Cell,1991,66:769-780.Narva,K.E.,andJ.S.Feitelson.NucleotidesequenceandtranscriptionalanalysisoftheredDlocusofStreptomycescoelicolorA3(2).JBacteriol,1990,172:326-333.)。
近年来,分子生物学技术迅猛的发展,如Gibson研究团队开发的体外等温一步法DNA组装技术(Gibson,D.G.,etal.EnzymaticassemblyofDNAmoleculesuptoseveralhundredkilobases.NatMethods,2009,6(5):343-345.),使得利用基因工程技术改造微生物代谢途径变得更加容易。
发明内容
针对上述情况,为了提高龟裂链霉菌土霉素产量,适应工业生产的需求,本发明人对土霉素合成的调控基因进行了研究,发现了一种新的土霉素合成的正调控基因otcR,并利用该基因通过体外DNA重组技术构建了过表达土霉素合成的正调控基因(otcR)质粒并由此获得了适用于大规模工业生产的高产工程菌株,同时提供一种能够提高龟裂链霉菌土霉素产量的方法。
为了达到上述目的,本发明一方面提供一种土霉素合成的正调控基因otcR,所述基因为选自编码序列表的氨基酸序列3所示的正调控蛋白OtcR的基因;和编码具有所述OtcR蛋白活性的多肽的基因中的一个。优选地,所述基因为序列表的核苷酸序列1所示基因。
同时还提供上述基因的编码蛋白,即一种土霉素合成的正调控蛋白OtcR,所述蛋白为序列表的氨基酸序列3所示的蛋白。
本发明第二方面提供一种重组龟裂链霉菌,所述重组龟裂链霉菌是在产土霉素的龟裂链霉菌中过表达序列表的序列3所示的OtcR蛋白或具有该蛋白活性的多肽的菌株。
本领域技术人员应理解,对序列表的序列3所示的OtcR蛋白进行一个或多个氨基酸的突变和/或修饰,例如替换、增加、缺失等得到的多肽,如果仍具有正调控土霉素合成的活性,甚至是相比于序列3所示蛋白增强的活性时,仍适用于本发明。编码该多肽的基因则同样可用于本发明来构建可提高土霉素产量的重组菌。
所述重组龟裂链霉菌的基因组中包含至少2个,优选2~6个,更优选3~4个拷贝的土霉素合成的正调控基因otcR,所述基因为选自编码序列表的氨基酸序列3所示的正调控蛋白OtcR的基因;和编码具有所述OtcR蛋白活性的多肽的基因中的一个;优选地,所述基因为序列表的核苷酸序列1所示基因。
根据一种实施方式,所述过表达序列表的序列3所示的OtcR蛋白的方法包括构建包含至少一个otcR基因的重组质粒,并将所述重组质粒整合到龟裂链霉菌(Streptomycesrimosus)的基因组上。
所述otcR基因是选自编码所述OtcR蛋白或具有所述OcR蛋白活性的多肽的核苷酸序列和编码具有所述OtcR蛋白活性的多肽的基因中的一个。优选地,所述基因为序列表的核苷酸序列1所示基因。
所述至少一个拷贝的otcR基因为1~5个,优选为2~3个。
根据一种实施方式,所述重组质粒优选以pGusT-SF14为出发质粒,以序列表的序列2所示的SF14组成型启动子为目的启动子。
本发明的第三方面,提供一种利用龟裂链霉菌提高土霉素产量的方法,所述方法包括利用基因重组技术使所述龟裂链霉菌过表达序列表的序列3所示的OtcR蛋白,和发酵培养该重组的龟裂链霉菌。
利用基因重组技术使所述龟裂链霉菌过表达序列表的序列3所示的OtcR蛋白的方法可以是本领域中任何适宜的方法。例如将目的基因的敲入菌体的基因组、将包含目的基因的重组质粒引入菌体、将包含目的基因的重组质粒整合到菌体的基因组上等等。
根据一种实施方式,所述使所述龟裂链霉菌过表达达序列表的序列3所示的OtcR蛋白包括以下步骤:构建包含至少一个otcR基因的重组质粒,和将所述重组质粒整合到龟裂链霉菌的基因组上。
其中otcR基因选自编码序列表中氨基酸序列3所示的OtcR蛋白的基因和编码具有所述OtcR蛋白活性的多肽的基因中的一个。优选地,所述otcR基因是序列表中核苷酸序列1。
其中过表达otcR基因的重组质粒是在出发质粒中引入至少1个、优选2~5个、更优选2~3个拷贝的otcR重组质粒。
所述出发质粒可以采用现有的技术和载体包括原生质体介导的基因交换、限制性突变株和具有宽宿主范围的质粒和噬菌体载体等实现。例如常用的遗传操作质粒有pSET152(Bierman,M.,R.Logan,K.O'Brien,E.T.Seno,R.N.Rao,andB.E.Schoner.1992.PlasmidcloningvectorsfortheconjugaltransferofDNAfromEscherichiacolitoStreptomycesspp.Gene116:43-49.)和pSOK804(MellaertLV,MeiL,LammertynE,SchachtS,AnneJ.Site-specificintegrationofbacteriophageVWBgenomeintoStreptomycesvenezuelaeandconstructionofaVWB-basedintegrativevector.Microbiol.1998;144:3351–3358.)等。
优选地,出发质粒为pGusT-SF14,启动子为SF14组成型启动子。SF14启动子为链霉菌内的组成型启动子之一,在绝大多数链霉菌内均能表现很好的转录活性,高效的促进其下游基因的转录表达,是链霉菌分子遗传操作实验中最为普遍采用的一段核酸序列,如天蓝色链霉菌(Streptomycescoelicolor),灰色链霉菌(Streptomycesgriseus)和龟裂链霉菌(Streptomycesrimosus)等。SF14的核苷酸序列为序列表中序列2所示。
本发明优选的出发质粒pGusT-SF14(Rudolph,M.M.,etal..SyntheticriboswitchesfortheconditionalcontrolofgeneexpressioninStreptomycescoelicolor.Microbiology,2013,159(7):1416-1422.)含有SF14启动子(Labes,G.,etal.IsolationandcharacterizationofastrongpromoterelementfromtheStreptomycesghanaensisphageI19usingthegentamicinresistancegene(aacC1)ofTn1696asreporter.Microbiology,1997,143(5):1503-1512.),该启动子为链霉菌组成型启动子,能够持续性启动其下游基因的转录,从而进一步增加土霉素的产量。
本发明方法所使用的启动子不限于SF14启动子,也包括其它链霉菌遗传操作常用的启动子,如红霉素PermE*启动子(Bibb,M.J.,etal.(1994)."ThemRNAforthe23SrRNAmethylaseencodedbytheermEgeneofSaccharopolysporaerythraeaistranslatedintheabsenceofaconventionalribosome-bindingsite."MolMicrobiol14(3):533-545.),PkasO*启动子(Wang,W.,etal.(2013)."AnengineeredstrongpromoterforStreptomycetes."ApplEnvironMicrobiol79(14):4484-4492.)等。
具体地,过表达1个拷贝的otcR重组质粒pSF-otcR-1采用BamHI和XbaI酶切出发载体和带相应酶切位点的otcR扩增片段,并用T4DNA连接酶进行连接得到。过表达2~5个拷贝的otcR重组质粒pSF-otcR-2、pSF-otcR-3、pSF-otcR-4和pSF-otcR-5,利用经酶切获得的线性载体片段和含有与载体部分重叠DNA序列的otcR扩增片段,通过体外DNA组装技术(Gibson,D.G.,etal.EnzymaticassemblyofDNAmoleculesuptoseveralhundredkilobases.NatMethods,2009,6(5):343-345,该文献公开的内容通过引用并入本文)得到。
将构建好的otcR重组质粒,通过例如结合转移技术、原生质体融合技术、化学转化以及电击转化等技术,整合到龟裂链霉菌的基因组上,优选结合转移技术。
所述龟裂链霉菌可以是龟裂链霉菌属生产土霉素中的任何适宜的菌株。
本发明的第四方面,提供上述otcR基因或OtcR蛋白在微生物发酵生产土霉素中提高土霉素产量的用途。
本发明首次发现直接调控土霉素合成的正调控基因otcR以及其编码蛋白的功能。该蛋白可特异性启动土霉素合成结构基因的转录和表达。otcR编码的调控蛋白为土霉素合成基因簇的正调控蛋白,在土霉素合成过程中起着决定性作用。本发明的研究显示,该基因的缺失直接导致土霉素的合成终止,过表达该基因后能促进土霉素产量提升。体内实验通过绿色荧光蛋白表征OtcR蛋白对土霉素合成的各个结构基因的转录活性影响,试验结果表明OtcR能显著提高这些基因启动子的转录活性。利用该基因过表达OtcR蛋白的重组龟裂链霉菌能够显著提高土霉素的产量。提高了土霉素的发酵生产的产量,降低了成本,使其工业化生产成为可能,具有广阔的应用前景。
附图说明
为了使本发明的目的、技术方案和有益效果更加清楚,本发明提供了如下附图,并进行说明:
图1A和1B分别为土霉素合成的正调控基因otcR敲除突变株及其回补突变株PCR鉴定的电泳图。
图2为对土霉素合成的正调控基因otcR敲除突变株及其回补突变株发酵液进行高效液相色谱分析的谱图。
图3A为表征启动子活性的报告质粒PoxyA/I/J/R/S-gfp(-/+OtcR)示意图,3B为土霉素合成的正调控蛋白OtcR对土霉素合成结构基因启动子转录活性影响的柱形图。
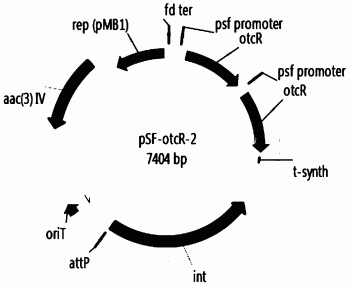
图4A~E分别为根据本发明构建的土霉素合成的正调控基因otcR过表达质粒(pSF-otcR-1,pSF-otcR-2,pSF-otcR-3,pSF-otcR-4和pSF-otcR-5)示意图。
图5为根据本发明构建的土霉素合成的正调控基因otcR过表达质粒酶切鉴定电泳图。
图6为根据本发明构建的龟裂链霉菌土霉素合成的正调控基因otcR的过表达突变株PCR鉴定结果的电泳图。
图7A为土霉素标准品测定的标准曲线及其计算公式,7B为根据本发明的重组龟裂链霉菌发酵后发酵液中土霉素浓度随培养时间变化的曲线图,和7C为根据本发明的重组龟裂链霉菌发酵后发酵液中生物量(OD595)随培养时间变化的曲线图。
具体实施方式
下面通过实例并结合附图对本发明做进一步的说明。
本发明所述土霉素又称为地霉素或氧四环素,为淡黄色结晶或无定形粉末,无臭,在碱性溶液中很容易破坏失效。在乙醇中微熔,在水中极微溶解;在氢氧化钠溶液和稀盐酸中易溶解。
土霉素结构式如上所示,化学式C22H24N2O9,分子量为460.45。化学名称:6-甲基-4-(二甲氨基)-3,5,6,10,12,12a-六羟基-1,1,1-二氧化-1,4,4a,5,5a,6,11,12a-八氢-2-并四苯甲酰胺。
土霉素属四环素类抗生素,是广谱抑菌剂。临床上用于治疗上呼吸道感染﹑胃肠道感染﹑斑疹伤寒等。现也多用于兽用药和水产养殖用药。
由已公布的测序数据来看,各种产土霉素的龟裂链霉菌菌株其土霉素合成基因簇排布相同。与其它链霉菌产生的次级代谢产物相似,土霉素是由龟裂链霉菌合成的聚酮类抗生素。本发明人发现土霉素合成途径受到正调控基因otcR调节,体内研究实验表明,otcR敲除之后土霉素合成终止;而在敲除株中回补otcR基因之后土霉素合成得到恢复,进一步经过生物信息学软件分析表明otcR转录编码的调控蛋白(OtcR)能够特异性结合和启动土霉素合成结构基因的转录和表达。
本发明发现并验证了otcR编码的的调控蛋白的功能。在此基础上,以StreptomycesrimosusJCM为出发菌,以pGusT-SF14为出发质粒,构建了系列可过表达OtcR蛋白的重组菌,证实在龟裂链霉菌中过表达OtcR蛋白能够显著提高土霉素产量。
具体地,由出发质粒构建土霉素合成的正调控基因otcR过表达质粒,分别为pSF-otcR-1(过表达1个拷贝的otcR基因),pSF-otcR-2(过表达2个拷贝的otcR基因),pSF-otcR-3(过表达3个拷贝的otcR基因),pSF-otcR-4(过表达4个拷贝的otcR基因),pSF-otcR-5(过表达5个拷贝的otcR基因),质粒图谱参见附图4。通过接合转移技术,构建S.rimosusJCM土霉素合成的正调控基因otcR的过表达突变株,分别为JCM(pSF-otcR-1),JCM(pSF-otcR-2),JCM(pSF-otcR-3),JCM(pSF-otcR-4),JCM(pSF-otcR-5)。
本领域技术人员应理解,虽然本发明的实施例涉及上述出发菌和出发质粒,但是在具有相同或相似代谢途径的龟裂链霉菌中过表达OtcR蛋白同样能够取得提高土霉素产量的效果。这些内容均在本发明要求保护的范围之内。
实施例1.土霉素合成的正调控基因otcR敲除突变株及其回补株的构建
一、构建土霉素合成的正调控基因otcR敲除突变株
分别选取S.rimosusM4018基因组内拟敲除的调控基因otcR位置两侧序列(分别为序列表中的序列4(otcR上游序列5’-3’)和序列表中的序列5(otcR下游序列5’-3’))设计引物OtcR-up-F2/OtcR-up-R2和OtcR-down-F2/OtcR-down-R2(5'-3'),引物序列由英潍捷基(上海)贸易有限公司(北京分公司)合成(下同),下划线代表限制性内切酶酶切位点(下同):
OtcR-up-F2:CCCAAGCTTGTGGCCATTGCGGACTTCTACC(HindIII);
OtcR-up-R2:AAAAGCTGCAGGATCCAGCGGCCGAACC(PstI);
OtcR-down-F2:AAAACTGCAGCGGATCCAGACGCTAATGGC(PstI);
OtcR-down-R2:CCGGAATTCAAGTAGTCGTAGAGGTACGG(EcoRI)。
PCR反应体系:10×KOD-Plus缓冲液5μl,2mMdNTPs5μl,25mMMgSO42μl,KOD-Plus-(1U/μl)1μl(以上试剂购自TOYOBO,Japan);10μM引物OtcR-up-F2和OtcR-up-R2各1.5μl,(10μM引物OtcR-down-F2和OtcR-down-R2各1.5μl)基因组模板1μl(1-50ng),ddH2O32μl,DMSO1μl,总反应体积50μl。
PCR循环条件:预变性:94℃,2min。变性:94℃,15sec;退火:60℃,30sec。延伸:68℃,1min,30个循环;68℃,2min,4℃,保存。
扩增otcR的上游片段3146bp和下游片段3130bp,上游片段经HindIII(NEB)和PstI(NEB)双酶切,下游片段经PstI(NEB)和EcoRI(NEB)双酶切,利用天根琼脂糖DNA回收试剂盒(TIANGEN,Beijing)进行回收,上述回收得到片段与pKC1132载体骨架(Bierman,M.,etal.(1992)."PlasmidcloningvectorsfortheconjugaltransferofDNAfromEscherichiacolitoStreptomycesspp."Gene116(1):43-49.)进行连接反应(T4DNA连接酶,NEB),构建敲除载体pOtcRDM,将pOtcRDM通过结合转移进入到M4018菌株中,按照Kieser发表的链霉菌基因敲除方法(KieserT,Bibb,M.J.,Buttner,M.J.,Chater,K.F.,andHopwood,D.A.:PracticalStreptomycesGenetics.TheJohnInnesFoundation,Norwich,UK;2000.)筛选otcR敲除突变株,并利用引物ΔOtcR-Test2-F/ΔOtcR-Test2-R进行PCR扩增鉴定(5'-3')。
ΔOtcR-Test2-FCAGAGGGACATATTGCCGCC;
ΔOtcR-Test2-RTCATGACCTGGTTCCTGCGC。
PCR反应体系和循环条件同上。出发菌株M4018含有otcR片段,PCR片段大小为1462bp,otcR敲除突变株(命名为ΔotcR)扩增片段大小为600bp,如图1A所示。
二、土霉素合成的正调控基因otcR回补突变株
以M4018基因组为模板,利用引物PotcR-F/PotcR-R扩增调控基因otcR及其启动子区域共计1028bp(5'-3')(即序列表中序列6),
PotcR-F:GGAAGATCTGACGCCTGACCGTACGAAGACG(BglII);
PotcR-R:CTAGTCTAGACTCCCAGATCGGCCAGTGAGG(XbaI),
PCR反应体系及循环程序同上。
该经扩增获得的片段经BglII(NEB)和XbaI(NEB)双酶切,利用以上相同的试剂盒进行回收,出发质粒pGusT-SF14经限制性核酸内切酶BglII(NEB)和XbaI(NEB)酶切,得到的骨架片段与otcR基因及其启动子序列相连,得到回补载体pOtcR,质粒由英潍捷基(上海)贸易有限公司(北京分公司)进行测序。测序引物如下(5'-3'):
TestF1:AAGCGATTCTCGACCTCGTC;
TestR1:TCAGGCTGCGCAACTGTTGG,
PCR反应体系和循环条件同上。
龟裂链霉菌otcR的回补突变株构建原理为接合转移技术,将上述构建好的质粒pOtcR通过该质粒上编码的ΦC31整合酶整合到otcR敲除株的基因组上,使ΔotcR菌株获得otcR片段并稳定遗传。该操作过程需要借助E.coliET12567/pUZ8002(Flett,F.,etal.HighefficiencyintergenericconjugaltransferofplasmidDNAfromEscherichiacolitomethylDNA-restrictingStreptomycetes.FEMSMicrobiolLett,1997,155(2):223-229.)来完成。
具体操作流程如下:首先将上述构建好的质粒pOtcR转化进入E.coliET12567/pUZ8002,挑取含有重组质粒的ET12567/pUZ8002克隆于Luria-Bertani培养基(下称LB培养基:胰蛋白胨10g/L,酵母提取物5g/L,氯化钠10g/L,pH7.0)培养至OD600=0.4~0.6(培养时添加50μg/ml卡那霉素、50μg/mL安普霉素和50μg/mL氯霉素)。收集菌体用新鲜LB培养基洗涤两次,等体积重悬于2×YT培养基(胰蛋白胨16g/L,酵母粉10g/L,NaCl5g/L,pH7.0)中备用。敲除突变株ΔotcR划线接种至MS培养基(甘露醇20g/L,大豆粉20g/L,琼脂粉20g/L),30℃培养5天,将敲除突变株ΔotcR的孢子用2×YT培养基洗涤两次并重悬于2×YT培养基中,稀释至OD600=0.4~0.6,50℃水浴中热激10分钟,冷却至室温待用。取200μl上述转化的E.coliET12567/pUZ8002和10~50μl经热激的ΔotcR孢子充分混合,在30℃摇床孵育萌发2h,最后涂布至MS固体培养基平板上。30℃倒置培养12~14小时后,每板加1mL无菌水稀释的萘啶酮酸(终浓度25μg/mL)和安普霉素(终浓度为500μg/mL),30℃继续培养5~7天。待长出白色菌丝及孢子后,转接MS平板(含终浓度25μg/ml萘啶酮酸和500μg/mL的安普霉素)。根据菌株生长情况,在有抗平板上传代1~2代后,即可收集孢子进行鉴定,并经无抗平板分离培养获得otcR回补重组子(命名为ΔotcR::otcR)。
otcR回补突变株PCR鉴定:提取敲除株ΔotcR和otcR回补突变株ΔotcR::otcR的基因组作为模板,鉴定引物序列设计如下(5'-3'):
TestF2:GTGTTTGTGCGGCTTGAAGGGAAG;
TestR2:CCCAGGAGGACGACCTCCAGGTTGG,
PCR反应体系和循环条件同上。
引物TestF2为上述实施例中构建好的重组质粒上一段序列(与出发质粒pGusT-SF14相同),引物TestR2为出发龟裂链霉菌基因组上整合位点附近的一段序列,通过上述接合转移操作,回补质粒pOtcR整合到敲除株ΔotcR基因组上并能稳定遗传。因此,将上述扩增获得的PCR片段混合物进行1%的琼脂糖凝胶电泳,能扩增出长度大小1400bp片段的为otcR回补株,而阴性对照以ΔotcR基因组为模板,不含pOtcR质粒,扩增的结果是无任何大小片段如图1B所示。
如图1所示,以出发菌株M4018为对照,土霉素合成的正调控基因otcR敲除突变株ΔotcR构建成功;以敲除株ΔotcR为对照,调控基因otcR回补突变株ΔotcR::otcR构建成功。
实施例2:土霉素合成的正调控基因敲除突变株及回补突变株土霉素合成分析
一、发酵培养采用如下培养基:
种子培养基配方:淀粉3wt%,黄豆饼粉0.3wt%,硫酸铵0.4wt%,碳酸钙0.5wt%,玉米浆0.4wt%,氯化钠0.5wt%,磷酸二氢钾0.015wt%,121℃,1.01×105Pa灭菌20分钟。
发酵培养基配方:淀粉15wt%,黄豆饼粉2wt%,硫酸铵1.4wt%,碳酸钙1.4wt%,氯化钠0.4wt%,玉米浆0.4wt%,磷酸二氢钾0.01wt%,氯化钴10μg/ml,淀粉酶0.1%-~0.2wt%,121℃,1.01×105Pa灭菌20分钟。
二、发酵工艺:
将预先准备好的S.rimosusM4018(来自辉瑞公司)和上述构建好的敲除突变株ΔotcR,回补突变株ΔotcR::otcR孢子在MS平板进行划线活化,铲取约2cm2菌丝块接种到内装40mL上述种子培养基的三角瓶中,30℃,250r/min振荡培养1天后。将所得的种子菌液按5%接种量转接到发酵培养基中,30℃、250r/min振荡培养6天。
三、高效液相色谱分析土霉素:
HPLC分析仪为(日本岛津,LC-20AT)。分别吸取上述培养好的1mL发酵液,加9mol/L盐酸溶液酸化至pH=1.5~1.7(酸化时不停涡旋振荡混匀,用pH=0.5~5.0试纸测试,约20μl左右),室温放置5分钟;12000rpm,室温离心5分钟;取上清20μl进行仪器分析,色谱柱选择DiamonsilC18反相柱(250×4.6mm),流动相条件为60%去离子水,10%甲醇,20%乙腈和10%磷酸(2mM),流速为1.0ml/min,检测波长为350nm,土霉素(OTC)吸收峰的保留时间4.1分钟。
如图2所示,以土霉素标准品(Standards)为对照,培养发现otcR敲除突变株土霉素(OTC)合成终止,即,检测不到任何土霉素的生成;而回补突变株又能够合成土霉素,说明otcR为土霉素合成途径中的正调控基因,是决定土霉素合成的开关。
实施例3:土霉素合成的正调控蛋白对土霉素合成途径中基因转录活性影响一、不含调控基因otcR的对照质粒构建:
评价启动子转录活性的报告基因为绿色荧光蛋白基因gfp,其模板来源于质粒pTAC(LouC,StantonB,ChenYJ,MunskyB,VoigtCA:Ribozyme-basedinsulatorpartsbuffersyntheticcircuitsfromgeneticcontext.NatBiotechnol2012,30:1137-1142.),扩增引物如下(5'-3'),引物中下划线序列(下同)为Gibson研究团队开发的体外DNA组装技术中待组装片段之间的重叠区域(overlap,下同)(Gibson,D.G.,etal.EnzymaticassemblyofDNAmoleculesuptoseveralhundredkilobases.NatMethods,2009,6(5):343-345.):
Gfp-F:TGAGCTACAATCAATACTCGATTAGGGATCCGATTTCTGGAAACTAGAAGGAGG;
Gfp-R:AGCGGCCCTGGTTCCTTCTTGTTGTCTAGAGAGTCACTAAGGGCTAACTAAC,
PCR反应体系和循环条件同上。
出发质粒pGusT-SF14经限制性核酸内切酶BamHI(NEB)和XbaI(NEB)双酶切得到含SF14启动子(序列表中序列2)的线性片段,该片段与上述PCR回收得到gfp基因进行融合,方法采用Gibson研究团队开发的体外等温一步法DNA组装技术。
体外等温一步法DNA组装过程:
①5×等温反应缓冲液:25%PEG-8000,500mMTris-HClpH7.5,50mMMgCl2,50mMDTT,4mMdNTPs(每种dNTP1mM)和5mMNAD,-20℃保存。
②组装主反应液:320μl5×等温缓冲液,0.64μlT5核酸外切酶(10U/μlEpicentre),20μlPhusionDNA聚合酶(2U/μlNEB),160μlTaqDNA连接酶(40U/μlNEB),加水至终体积为1.2ml。
③SF-GFP组装体系:15μl组装主反应液+2.5μl含有载体重叠序列的gfp基因片段(>10ng)+2.5μl酶切得到的线性pGusT-SF14载体片段(>10ng);
④以上总体积20μl的组装反应体系在50℃热循环仪中反应1小时,取10μl组装产物转化E.coliTop10(Invitrogen),挑取单克隆进行液体培养和测序验证。
按照上述步骤构建得到质粒pSF-GFP。
根据TangYi等研究团队对于土霉素合成的研究成果:土霉素合成基因簇内包含20个结构基因(命名oxyA-T),其中oxyABCDE,oxyIHGF,oxyJKLMNO,oxyRQPO和oxyST这5个操纵子各自共用一个启动子转录,以M4018基因组为模板,设计引物扩增PoxyA,PoxyI,PoxyJ,PoxyR和PoxyS这5个启动子序列(PoxyA,PoxyI,PoxyJ,PoxyR和PoxyS启动子序列分别为序列表中序列7、序列8、序列9、序列10和序列11),引物如下(5'-3'):
PoxyA-gfp-F:AGAAGTAGGGAAAACGGGGATGTTGAGATCTGTATCTGGCCGAGGACATTCC;
PoxyA-gfp-R:TTCCTCCTTCTAGTTTCCAGAAATCGGATCCTGAGTCTCCTCTGCCGTCGTCG;
PoxyI-gfp-F:AGTAGGGAAAACGGGGATGTTGAGATCTGGCCTTGTCCTCCGGTGTTGTG;
PoxyI-gfp-R:TCCTCCTTCTAGTTTCCAGAAATCGGATCCACGACTCTCCTCTCCGGCG;
PoxyJ-gfp-F:GAAGTAGGGAAAACGGGGATGTTGAGATCTATACGACTCTCCTCTCCGGC;
PoxyJ-gfp-R:CTCCTTCTAGTTTCCAGAAATCGGATCCGGCCTTGTCCTCCGGTGTTGTG;
PoxyR-gfp-F:GAAGTAGGGAAAACGGGGATGTTGAGATCTACACGCTCCTCGGATCATCAG;
PoxyR-gfp-R:CCTCCTTCTAGTTTCCAGAAATCGGATCCGAAGCGTCCTCGGGGTCCGTAG;
PoxyS-gfp-F:GAAGTAGGGAAAACGGGGATGTTGAGATCTGAAGCGTCCTCGGGGTCCGTAG;
PoxyS-gfp-R:TTCCTCCTTCTAGTTTCCAGAAATCGGATCCACACGCTCCTCGGATCATCAGTGG,
PCR反应体系,循环条件同上。
上述构建好的质粒pSF-GFP经BglII(NEB)和BamHI(NEB)双酶切,并进行回收得到不含SF14启动子的骨架片段,按照体外等温一步法DNA组装过程,PoxyA,PoxyI,PoxyJ,PoxyR和PoxyS启动子与不含SF14启动子的骨架片段进行融合分别得到表征启动子活性的报告质粒PoxyA-gfp,PoxyI-gfp,PoxyJ-gfp,PoxyR-gfp和PoxyS-gfp(如图3A,PoxyA/I/J/R/S-gfp(-OtcR)),将测序正确的质粒转化入E.coliDH5ɑ(Novagen)得到转化子,通过测量转化子绿色荧光蛋白的荧光值来表征PoxyA,PoxyI,PoxyJ,PoxyR和PoxyS启动子转录活性。
二、含有调控基因otcR报告质粒构建:
以出发载体pGusT-SF14为模板设计引物扩增SF14启动子序列(5'-3'):
SF14-F:GATCCCCGGGGACCTGCAGGTCGACTCTAGCTAGGCCTTGACCTTGATGAGGCG;
SF14-R:ATGGGTCCTCCTGTGGAGTGGTTCTGTGGATCCCTAATCGAGTATTGATTGTAG
PCR反应体系和循环条件同上。
以M4018基因组为模板扩增无启动子只有编码序列的otcR片段,引物设计如下(5'-3'):
Gib-otcR-F1:ACAGAACCACTCCACAGGAGGACCCATATGGACTTCAAGGCACTCGG;
Gib-otcR-R1:CTCACCGCGACGTATCGGGCCCTGGCCAGCTAGGAATTCTCAAGACGCCGACC,
PCR反应体系和循环条件同上。
上述构建好的质粒PoxyA/I/J/R/S-gfp(-OtcR)进行NheI(NEB)限制性内切酶酶切,并用上述相同的DNA试剂盒回收,回收得到线性片段分别与SF14启动子片段,otcR片段进行三片段体外等温组装,从而构建报告质粒PoxyA-gfp-SFotcR,PoxyI-gfp-SFotcR,PoxyJ-gfp-SFotcR,PoxyR-gfp-SFotcR,PoxyS-gfp-SFotcR(如图3A所示,PoxyA/I/J/R/S-gfp(+OtcR)),并将这些质粒转化入E.coliDH5ɑ(Novagen),得到的转化子含有调控基因otcR,在SF14启动子作用下能够持续性编码调控蛋白OtcR。通过测量绿色荧光蛋白的荧光值可表征OtcR对PoxyA,PoxyI,PoxyJ,PoxyR和PoxyS启动子转录活性影响。
三、检测绿色荧光蛋白
分别将转化子E.coliDH5ɑ(PoxyA/I/J/R/S-gfp(-OtcR))和E.coliDH5ɑ(PoxyA/I/J/R/S-gfp(+OtcR))接种至5ml含有终浓度50μg/ml安普霉素的LB培养基中,每组3个平行,250r/min,37℃培养6小时后,分别取200μl培养液加入到96孔板中,利用酶标仪(SynergyH4Multi-ModeReader)测量gfp荧光值,激发波长为485nm,淬灭波长为510nm。
如图3B所示,以E.coliDH5ɑ(PoxyA/I/J/R/S-gfp(-OtcR))为对照,当质粒上加入调控基因otcR,该基因在SF14启动子作用下转录和编码调控蛋白OtcR,OtcR作用于PoxyA,PoxyI,PoxyJ,PoxyR和PoxyS启动子,转化子E.coliDH5ɑ(PoxyA/I/J/R/S-gfp(+OtcR))的荧光值明显高于对照E.coliDH5ɑ(PoxyA/I/J/R/S-gfp(-OtcR));这表明OtcR能够显著增强PoxyA,PoxyI,PoxyJ,PoxyR和PoxyS启动子的转录活性,对土霉素生物合成起到正调控作用。
实施例4:土霉素合成的正调控基因otcR过表达质粒构建
一、pSF-otcR-1质粒构建过程:
用于构建pSF-otcR-1质粒的otcR基因片段(序列表中序列1所示)通过PCR扩增获得,所用引物如下(5'-3'):
Primer1-F:CGCGGATCCACAGAACCACTCCACAGGAGGACCCATATGGACTTCAAGGCACTCGG(BamHI)
Primer1-R:CTAGTCTAGATGTGTGGAATTGTGAGCGG(XbaI)
下划线为限制性核酸内切酶识别序列,双下划线为链霉菌最优核糖体结合位点,粗体ATG为起始密码子。
所用扩增模板为S.rimosusM4018的基因组。
PCR反应体系和循环条件同上。
将PCR扩增得到的otcR片段混合物进行1%琼脂糖凝胶电泳,利用天根琼脂糖DNA回收试剂盒(TIANGEN,Beijing)进行回收,得到的otcR片段进行限制性核酸内切酶BamHI(NEB)和XbaI(NEB)酶切,酶切产物再次经天根琼脂糖DNA回收试剂盒进行回收得到otcR酶切片段853bp;出发质粒pGusT-SF14经限制性核酸内切酶BamHI(NEB)和XbaI(NEB)酶切,得到含SF14启动子的载体片段5649bp,将otcR的酶切片段与含SF14启动子的载体片段5649bp进行T4DNA连接酶(NEB)连接,得到pSF-otcR-1质粒,将质粒pSF-otcR-1转化E.coliTop10(Invitrogen),利用天根高纯质粒提取试剂盒(TIANGEN,Beijing)提取质粒pSF-otcR-1,进行BglII和XbaI限制性内切酶酶切验证,酶切结果如附图3,酶切otcR片段大小为837bp,质粒由英潍捷基(上海)贸易有限公司(北京分公司)进行测序。测序引物为TestF1和TestR1(同上)。
二、pSF-otcR-2,3,4,5质粒构建过程:
用于构建pSF-otcR-2,3,4,5质粒的otcR基因片段通过PCR扩增获得,所用引物如下(5'-3'):
Primer2-F:GTGAAATTGTTATCCGCTCACAATTCCACACATGCCTTGACCTTGATGAGGCGG
Primer2-R:CTTGAAGCGGCCCTGGTTCCTTCTTGTTGTCTAGA
所用扩增模板为质粒pSF-otcR-1。
PCR反应体系和PCR循环条件同上。
如前所述,pSF-otcR-2,3,4,5质粒构建采用Gibson研究团队开发的体外等温一步法DNA组装技术。组装体系如下:
pSF-otcR-2组装体系:15μl组装主反应液+2.5μl含有载体重叠序列的otcR基因片段(>10ng)+2.5μlpSF-otcR-1载体片段(限制性核酸内切酶XbaI(NEB)单酶切回收,>10ng);
pSF-otcR-3组装体系:15μl组装主反应液+2.5μl含有载体重叠序列的otcR基因片段(>10ng)+2.5μlpSF-otcR-2载体片段(限制性核酸内切酶XbaI(NEB)单酶切回收,>10ng);
pSF-otcR-4组装体系:15μl组装主反应液+2.5μl含有载体重叠序列的otcR基因片段(>10ng)+2.5μlpSF-otcR-3载体片段(限制性核酸内切酶XbaI(NEB)单酶切回收,>10ng);
pSF-otcR-5组装体系:15μl组装主反应液+2.5μl含有载体重叠序列的otcR基因片段(>10ng)+2.5μlpSF-otcR-4载体片段(限制性核酸内切酶XbaI(NEB)单酶切回收,>10ng)。
以上总体积20μl的各组装反应体系在50℃热循环仪中反应1h,取10μl组装产物转化E.coliTop10(Invitrogen),挑取单克隆进行液体培养和测序验证。
根据以上步骤,共计构建土霉素合成的正调控基因otcR过表达质粒5个(如附图4所示),分别为pSF-otcR-1(表达1个拷贝的otcR基因),pSF-otcR-2(过表达2个拷贝的otcR基因),pSF-otcR-3(过表达3个拷贝的otcR基因),pSF-otcR-4(过表达4个拷贝的otcR基因)和pSF-otcR-5(过表达5个拷贝的otcR基因)。这些质粒分别进行了BglII(NEB)和XbaI(NEB)双酶切验证,酶切结果如附图5。
实施例5:构建S.rimosusJCMotcR基因的过表达突变株
S.rimosusJCM为中国普通微生物菌种保藏管理中心(ChinaGeneralMicrobiologicalCultureCollectionCenter,CGMCCNo.4.1438)的产土霉素的模式菌株,龟裂链霉菌otcR的过表达突变株构建原理是根据结合转移技术,将实施例4中构建好的质粒上编码的ΦC31整合酶整合到S.rimosusJCM的基因组上,使之能够稳定遗传。该操作过程同实施例1。
otcR的过表达定点整合突变株的鉴定方法同实施例1。
提取出发菌株S.rimosusJCM和otcR的过表达重组子的基因组作为模板,鉴定引物序列为TestF2和TestR2(同上)。
PCR反应体系和循环条件同上。
将上述PCR扩增获得的PCR片段混合物进行1%的琼脂糖凝胶电泳,引物TestF2为上述实施例4中构建好的重组质粒上一段序列,引物TestR2为出发龟裂链霉菌JCM基因组上整合位点附近的一段序列,通过上述结合转移操作,过表达otcR的质粒整合到S.rimosusJCM基因组上,并能稳定遗传,因此能扩增出长度大小约1400bp的PCR片段,而阴性对照为S.rimosusJCM基因组为模板,扩增的结果是无任何片段。如附图6所示。
按相同的方法,共计构建S.rimosusJCM土霉素合成的正调控基因otcR过表达突变株5个,分别为JCM(pSF-otcR-1),JCM(pSF-otcR-2),JCM(pSF-otcR-3),JCM(pSF-otcR-4)和JCM(pSF-otcR-5)。
实施例6:S.rimosusJCMotcR基因过表达突变株发酵培养
一、发酵培养的培养基同实施例2
二、发酵工艺同实施例2,将所得的种子菌液按5%接种量转接到发酵培养基中,30℃、250r/min振荡培养10天。其中,每两天取发酵液进行生物量和土霉素含量测试。
三、发酵液土霉素含量测试:
测试原理:土霉素分子中的酚羟基可与铁离子(Fe3+)反应生成褐色溶液,其颜色深浅与土霉素含量成正比,可在500nm下通过比色进行定量。
标准曲线制作:
土霉素(Sigma)标准溶液配制:称取土霉素标准品100mg于100mL容量瓶中,加入0.1mol/L盐酸溶液11.4mL,使其溶解,补水至刻度,摇匀,4℃保存备用。
取96孔板,空白对照组和标准样品组分别按下表加入:
室温放置20分钟,在酶标仪500nm波长下测定吸光度,以土霉素浓度为纵坐标,以吸光度值为横坐标制作标准曲线,求得土霉素浓度计算公式y=658.82×x+9.4166,如附图7A所示。
发酵液中土霉素含量测定的具体操作方法:吸取1mL发酵液,加9mol/L盐酸溶液酸化至pH=1.5~1.7(酸化时不停涡旋振荡混匀,用pH=0.5~5.0试纸测试,约20μl左右),放置5分钟;12000rpm,离心5分钟;取上清10μl至96孔板中,加入90μl的0.01mol/LHCl,混匀;加入100μl的0.05%FeCl3溶液(对照加入100μl的0.01mol/LHCl),混匀,放置20分钟;以对照管归零,500nm下测定吸光值A;吸光值代入上述标准曲线得出的公式,求得发酵液土霉素浓度y(μg/mL)。y=(658.82×x+9.4166)×(200/10)×发酵液稀释倍数,如附图7B所示。
四、发酵液生物量测试方法:
生物量测定方法采用赵友宝发表的二苯胺法(Zhao,Y.,etal.Asimplifieddiphenylaminecolorimetricmethodforgrowthquantification.ApplMicrobiolBiotechnol.2013,97(11):5069-5077.)。反应原理:DNA在酸性条件下,其嘌呤碱与脱氧核糖之间的糖苷键断裂,生成嘌呤碱、脱氧核糖和脱氧嘧啶核苷酸,而2-脱氧核糖在酸性环境中加热脱水生成ω-羟基-γ-酮基戊糖,与二苯胺试剂反应生成蓝色物质,在595nm波长处最大吸收。DNA在40~400μg范围内,光吸收与DNA浓度成正比。在反应液中加入乙醛,可以提高反应灵敏度。具体操作流程是二苯胺试剂:称取1g二苯胺,溶于100ml分析纯的冰乙酸中,再加入1.5ml的浓硫酸,混匀待用。临用前加入1ml的1.6%乙醛,配成的试剂应为无色。收集1ml发酵液,离心去上清后用SET缓冲液(75mMNaCl,20mMTris-HCl(pH7.5),25mMEDTA(pH8.0))洗一次,离心去上清;将菌体重悬于2ml二苯胺试剂中,60℃水浴1h之后离心取上清测定OD595吸光值,如附图7C所示。
五、土霉素含量比较
附图7显示了上述构建好的5个龟裂链霉菌otcR过表达突变株和出发菌株S.rimosusJCM发酵土霉素产量差异,结果显示龟裂链霉菌otcR过表达突变株发酵土霉素的产量均明显高于出发株S.rimosusJCM,附图7C表示otcR过表达突变株和出发菌株S.rimosusJCM的生物量差异,结果显示otcR过表达突变株和出发菌株S.rimosusJCM的生长趋势基本一致,证明突变株土霉素产量的提高是由于过表达了正调控基因otcR所致。
利用土霉素正调控基因构建重组菌和提高土霉素产量的方法专利购买费用说明
![]()
Q:办理专利转让的流程及所需资料
A:专利权人变更需要办理著录项目变更手续,有代理机构的,变更手续应当由代理机构办理。
1:专利变更应当使用专利局统一制作的“著录项目变更申报书”提出。
2:按规定缴纳著录项目变更手续费。
3:同时提交相关证明文件原件。
4:专利权转移的,变更后的专利权人委托新专利代理机构的,应当提交变更后的全体专利申请人签字或者盖章的委托书。
Q:专利著录项目变更费用如何缴交
A:(1)直接到国家知识产权局受理大厅收费窗口缴纳,(2)通过代办处缴纳,(3)通过邮局或者银行汇款,更多缴纳方式
Q:专利转让变更,多久能出结果
A:著录项目变更请求书递交后,一般1-2个月左右就会收到通知,国家知识产权局会下达《转让手续合格通知书》。
动态评分
0.0