IPC分类号 : H01M10/0568,H01M10/0567,H01M10/054,H01M12/00
专利摘要
公开了用于镁可再充电电池的电解质溶液,其与常规电解质溶液相比,具有高的离子传导率和宽的电化学窗口。所述电解质溶液通过使用金属氯化物催化剂的组合将金属镁溶解到醚溶液中来制备。所述电解质溶液可应用于制造镁可再充电电池和镁混合电池,其与使用常规电解质溶液的那些电池相比具有显著增加的可逆容量、倍率能力和循环寿命。还公开了用于制备所述电解质的方法。
权利要求
1.一种用于镁可再充电电池的电解质溶液,其由金属氯化物、镁金属和有机溶剂的组合制成。
2.根据权利要求1所述的电解质溶液,其中所述电解质溶液通过从金属氯化物、镁金属和镁离子处于平衡状态的溶液中除去固体级分,并收集剩余的液体级分而获得。
3.根据权利要求1所述的电解质溶液,其中所述金属氯化物选自AlCl3-nRn(其中n是0至3的整数,R选自烷基、芳基、杂芳基和烯基)、BCl3-nRn(其中n和R如以上所限定)、CrCl3、FeCl3、MnCl2、FeCl2、CoCl2、NiCl2、CuCl2、ZnCl2、TiCl4、ZrCl4、VCl4、NbCl5、RhCl3及其混合物。
4.根据权利要求1所述的电解质溶液,其中所述有机溶剂选自四氢呋喃(THF)、甘醇二甲醚、二甘醇二甲醚、三甘醇二甲醚、四甘醇二甲醚、二氧六环、苯甲醚、冠醚、聚乙二醇、乙腈、碳酸亚丙酯及其混合物。
5.根据权利要求1所述的电解质溶液,其中所述金属氯化物以0.001M至1.0M的浓度存在。
6.根据权利要求1所述的电解质溶液,其中所述金属氯化物盐是以下物质的混合物:(i)选自AlCl3-nRn、BCl3-nRn及其混合物的第一金属氯化物盐,以及(ii)选自CrCl3、FeCl3、MnCl2、FeCl2、CoCl2、NiCl2、CuCl2、ZnCl2、TiCl4、ZrCl4、VCl4、NbCl5、RhCl3及其混合物的第二金属氯化物盐。
7.根据权利要求6所述的电解质溶液,其中所述第一金属氯化物盐和所述第二金属氯化物盐各自以0.01M至1.0M的浓度存在。
8.根据权利要求1所述的电解质溶液,其中1-氧杂-2-镁杂环己烷是用于形成所述电解质溶液的前体。
9.根据权利要求1所述的电解质溶液,其还包含式1的化合物:
其中R选自未被取代的C1-C10直链或支化烷基、被C1-C10直链或支化烷氧基取代的C1-C10直链或支化烷基、未被取代的C5-C12环烷基、被C1-C10直链或支化烷氧基取代的C5-C12环烷基、未被取代的C5-C12芳基、被C1-C10直链或支化烷氧基取代的C5-C12芳基、未被取代的烯丙基以及被C1-C10直链或支化烷氧基取代的烯丙基,并且X选自卤素基团、未被取代的磺酰亚胺基、被卤代烷基取代的磺酰亚胺基、未被取代的磺酰胺基和被卤代烷基取代的磺酰胺基。
10.根据权利要求9所述的电解质溶液,其中式1中的R选自烯丙基、甲基、乙基、丙基、异丙基、丁基、异丁基、2-[2-(2-甲氧基乙氧基)乙氧基]乙基、环戊基、环己基和苯基。
11.根据权利要求10所述的电解质溶液,其中所述式1的化合物以按重量计0.01%至1%的量存在。
12.根据权利要求10所述的电解质溶液,其中所述式1的化合物选自N-烯丙基-N-甲基吡咯烷 氯化物、N-烯丙基-N-甲基吡咯烷 溴化物、N-烯丙基-N-甲基吡咯烷 双(三氟甲烷)磺酰亚胺、N-丁基-N-甲基吡咯烷 溴化物、N-丁基-N-甲基吡咯烷 氯化物、1-{2-[2-(2-甲氧基乙氧基)乙氧基]乙基}-1-甲基吡咯烷 溴化物和1-{2-[2-(2-甲氧基乙氧基)乙氧基]乙基}-1-甲基吡咯烷 氯化物。
13.根据权利要求9所述的电解质溶液,其中所述式1的化合物与镁离子的络合物存在于所述电解质中。
14.根据权利要求9所述的电解质溶液,其还包含锂盐。
15.根据权利要求14所述的电解质溶液,其中所述锂盐选自LiCl、双(三氟甲烷磺酰基)酰亚胺锂、LiClO4、LiBF4、LiPF6及其混合物。
16.根据权利要求14所述的电解质溶液,其中所述锂盐以0.1M至0.5M的浓度存在。
17.一种镁电池,其包括根据权利要求9所述的电解质溶液,其中所述镁电池是镁二次电池或镁混合电池。
18.一种镁电池,其包括根据权利要求9所述的电解质溶液,其中所述镁电池是镁可再充电电池或可充电镁混合电池。
说明书
相关申请的交叉引用
本申请根据美国法典第35卷第119节要求于2014年7月25日在韩国知识产权局提交的韩国专利申请No.10-2014-0094856的优先权,其公开内容通过引用整体并入本文。
技术领域
本发明涉及用于镁可再充电电池的电解质溶液以及用于制备所述电解质的方法,所述电解质溶液在高电压区是电化学稳定的并且具有改善的离子传导率。
背景技术
众所周知,采用锂金属的传统锂电池遭受了电解质系统对反应性锂阳极的许多寄生反应(parasiticreaction),这在其安全性方面造成了数个关键问题。此外,因为锂作为自然资源相对少见,所以其被称为贵重元素。特别地,随着最近对中等规模和大规模应用如电动车辆和ESS的需求不断增加,可再充电锂电池的安全性和成本问题成为应当被考虑的主要因素之一并且被认为是中等规模/大规模应用的主要障碍。
为了试图解决这些问题,最近已提出了使用金属镁作为电极活性材料的镁可再充电电池作为可再充电锂电池的替代品。镁可再充电电池通过来自作为电极(具体为阳极)的镁板的镁离子嵌入阴极活性材料中/从阴极活性材料中脱嵌期间的电子迁移而工作。镁具有与锂相似的理论容量并且是环境友好的。镁比锂便宜得多并且在电池安全性方面比锂更优异。由于这些优点,所以镁可再充电电池作为可再充电锂电池的潜在替代品已受到相当多的关注。
先前对开发用于镁充电电池的电解质系统的研究都集中于在电极上显示出可逆镁沉积和溶解行为的格氏溶液(Grignardsolution)(烷基卤化镁,RMgX,R=烷基,X=卤素)。然而,格氏溶液具有较低的离子传导率,导致电池的充电/放电倍率较低,限制了电池性能。因此,需要根本改进以开发比现有电池更具竞争力的镁可再充电电池和镁混合电池。
镁金属因其高的每单位质量和体积的能量密度(分别为2205Ah/kg,3833Ah/L)而是很有前景的电池阳极材料。特别地,镁是丰富的自然资源并且易于处理。此外,使用镁作为阳极材料防止了在充电和放电期间在电极表面上形成枝晶。由于这些原因,所以镁电池在安全性和价格竞争力方面优异。在这方面,镁电池作为用于电能存储和电动车辆的中型和大型电池系统受到了大量关注,其市场有望在不久的将来得到扩展。
虽然镁可再充电电池属于具有最高理论能量密度的电池系统之一,仅次于锂电池,但是T.Gregory等在20世纪90年代才首次对镁可再充电电池进行了认真研究。然而,在该报道之后的十多年中,对镁电池的报道很少。在21世纪前十年,巴伊兰大学的D.Aurbach小组开发了谢夫尔相(Chevrel-phase)阴极活性材料以确保可逆性。从那时起,镁电池作为可再充电锂电池有前景的替代品,因其能够解决锂电池安全性和价格问题而再次开始引起广泛关注。然而,迄今为止已开发的镁再充电电池的能量密度是锂离子电池的一半或更少。在这些情况下,迫切需要开发新的阴极活性材料、电解质材料和集电体。
特别地,对于镁金属在负电极上的可逆沉积和溶解、Mg2+离子向阴极材料的可逆嵌入和脱嵌以及固相内Mg2+离子的扩散,存在着许多挑战。这些挑战的一个关键解决方案是开发对阴极和阳极都适用的新电解质。
阴极活性材料和电解质是镁电池开发中的两个主要研究领域。在阴极活性材料的领域中,正在研究多种化合物如金属-硫化合物、有机硫化合物、金属氧化物和金属硅酸盐化合物,以实现高的每单位重量的可逆容量和增强的可逆性。然而,这些化合物的性能仍然不令人满意。在目前的技术水平下,仅阴极活性材料如谢夫尔相Mo6S8和Mo6Se8显示出适合于商品化的电池性能。
在电解质的领域中,大多数研究都集中在对镁阳极可逆的格氏溶液。近年来,已报道了一些镁材料(包括铝酸镁)表现出优良的性能特征。然而,能够可逆地沉积和溶解镁的格氏电解质因其高还原力而与常规阴极材料非常容易反应,使得其不能实际应用于电池。相反地,基于溶解在有机溶剂中的镁盐的能够使Mg2+离子可逆地嵌入阴极材料中/从阴极材料中脱嵌的传统电解质,在镁阳极的表面上形成厚的钝化膜,阻碍了金属的可逆沉积和溶解。
松下电器产业有限公司(MatsushitaElectricIndustrialCo.,Ltd)的美国专利No.6,713,213提出了一种非水性镁可再充电电池,其包括可再充电正极、非水性电解质和可再充电负极,其中所述非水性电解质包含由RMgX表示的含卤素有机镁化合物。
索尼的日本专利公开No.2007-188709提出了一种电化学装置,其具有第一电极、第二电极和电解质,其中第二电极的活性材料因氧化而形成镁离子并且电解质是由RMgX(其中R是烷基或芳基,X是氟、氯或溴)表示的格氏溶液和有机金属化合物或盐(而不是镁盐)的混合物。
然而,这些电解质具有在高电势区的差的电化学稳定性并且低的离子传导率,而且所述电池和所述装置在高电压下具有低的充电/放电速率,限制了其性能。因此,需要进一步改进以开发比现有电池更具竞争力的高电压镁电池和镁混合电池。
发明内容
本发明的一个目的是提供用于镁可再充电电池的新的电解质,其在高电势区是高度电化学稳定的并且同时具有高离子传导率。
本发明的另一个目的是提供制备用于镁可再充电电池的电解质的方法,所述电解质在高电势区是高度电化学稳定的。
本发明的另一个目的是提供包括所述电解质的镁可再充电电池和可充电镁混合电池,所述电解质具有在高电势区优异的电化学稳定性和高离子传导率。
本发明的一个方面涉及用于镁电池的电解质,其包含金属氯化物盐、镁离子和有机溶剂。
本发明的另一个方面涉及用于镁电池的电解质,其包含金属氯化物盐、镁离子、有机溶剂和由式1表示的化合物:
本发明的另一个方面涉及制备用于镁可再充电电池的电解质的方法,其包括:(a)将镁粉添加到有机溶剂中金属氯化物盐的溶液中以获得第一溶液。
本发明的又一个方面涉及包括根据示例性实施方案中任一个的电解质的镁可再充电电池。
与包括基于格氏溶液的镁盐的常规电解质相比,根据本发明的具有大电化学窗口的用于镁可再充电电池的电解质溶液在高电势区是高度电化学稳定的并且具有高的离子传导率。此外,本发明的电解质在阴极和阳极处均不引起副反应,使得电池的充电/放电效率能够达到100%的水平。此外,与采用常规电解质的电池相比,本发明的电解质可用于制造具有更高放电容量、更长循环寿命和更好的高倍率能力的高性能镁可再充电电池。因此,本发明的电解质适用于高电压镁充电电池和镁混合电池。
本发明的电解质与常规电解质相比具有更高的离子传导率并表现出更好的电化学稳定性。在本发明的电解质中Mg2+盐的离解度比在常规电解质中高。本发明的电解质可用于制造具有显著较高的可逆容量、倍率能力和循环寿命性能的镁可再充电电池和镁混合电池。特别地,与包括常规电解质的电池相比,在100次充电/放电循环后,包括本发明电解质的电池具有大大改善的每单位重量的放电容量。
附图说明
结合附图,由实施方案的以下描述将使本发明的这些和/或其他方面和优点变得明显并且更易理解,在附图中:
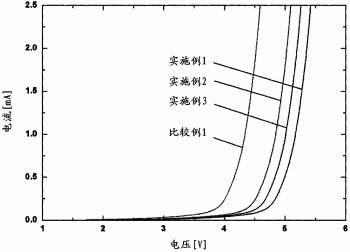
图1示出了实施例1至3和比较例1中制备的电解质的电化学稳定性的测试结果;以及
图2示出了使用实施例1至3和比较例1制备的电解质制造的镁可再充电电池和镁混合电池的可逆容量、倍率性能和循环寿命特征的测试结果。
具体实施方式
现在将更加详细地描述本发明的几个方面和多个实施方案。
根据本发明的一个方面,公开了用于镁电池的电解质,其包含金属氯化物盐、镁离子和有机溶剂。金属氯化物盐在电解质中将金属镁转变为镁离子。
根据一个实施方案,电解质通过从其中金属氯化物盐、金属镁和镁离子处于平衡状态的溶液中除去固体级分并收集剩余的液体级分而获得。在有机溶剂中,金属氯化物盐与金属镁粉发生化学反应。此时,金属氯化物盐在金属镁的表面上起催化作用,并因此使金属镁离子化并溶解于有机溶剂中。该过程持续进行直到金属镁的溶解反应达到化学平衡(其中溶剂中镁离子的浓度没有任何进一步的增加)。通过从溶液中除去固体级分并收集剩余的液体级分而获得本发明的电解质。
根据另一个实施方案,金属氯化物盐选自AlCl3-nRn(其中n是0至3的整数,并且R选自烷基、芳基、杂芳基和烯基)、BCl3-nRn(其中n和R如上所限定)、CrCl3、FeCl3、MnCl2、FeCl2、CoCl2、NiCl2、CuCl2、ZnCl2、TiCl4、ZrCl4、VCl4、NbCl5、RhCl3及其混合物。
烷基可以是C1-C7或C8-C15烷基。芳基可以是例如苯基或萘基,但不限于此。杂芳基可以是例如噻吩基或吲哚基,但不限于此。
根据另一个实施方案,有机溶剂选自四氢呋喃(THF)、甘醇二甲醚、二甘醇二甲醚、三甘醇二甲醚、四甘醇二甲醚、二氧六环、苯甲醚、冠醚、聚乙二醇、乙腈、碳酸亚丙酯及其混合物。
这些溶剂与金属镁的反应性较低并因此是稳定的。其他溶剂因其可在镁金属表面上自发分解而并不理想。这些溶剂中,更优选的是THF,其中金属镁的溶解可通过金属氯化物盐的作用而得到促进。
根据另一个实施方案,金属氯化物盐以0.1M至1M的浓度被包含。如果金属氯化物盐的浓度小于以上限定的下限时,镁在电解质制备期间缓慢溶解并且镁离子以低浓度存在于电解质中,不利地导致了低的离子传导率。同时,如果金属氯化物盐的浓度超过以上限定的上限时,金属氯化物盐可能不完全溶解并且可能不期望地以固体形式沉积。
根据另一个实施方案,金属氯化物盐是以下物质的混合物:(i)选自AlCl3-nRn、BCl3-nRn及其混合物的第一金属氯化物盐,以及(ii)选自CrCl3、FeCl3、MnCl2、FeCl2、CoCl2、NiCl2、CuCl2、ZnCl2、TiCl4、ZrCl4、VCl4、NbCl5、RhCl3及其混合物的第二金属氯化物盐。当金属氯化物盐是第一金属氯化物盐和第二金属氯化物盐的混合物时,使用THF作为有机溶剂是优选的,因为金属镁在该溶剂(THF)中的溶解可通过第二金属氯化物盐来促进并且第一金属氯化物盐与溶解的金属镁的反应可促进电解质的制备。
根据另一个实施方案,第一金属氯化物盐和第二金属氯化物盐各自以0.01M至1M的浓度被包含。如果第一金属氯化物盐和第二金属氯化物盐的浓度低于各自的下限,则镁在电解质制备期间缓慢溶解并且镁离子以低浓度存在于电解液中,不利地导致了低的离子传导率。同时,如果第一金属氯化物盐和第二金属氯化物盐的浓度超过各自的上限,则金属氯化物盐可能不完全溶解。
根据另一个实施方案,1-氧杂-2-镁杂环己烷(1-oxa-2-magnesiacylcohexane)存在于电解质中。
根据另一个实施方案,电解质还包含式1的化合物:
其中R选自未被取代的C1-C10直链或支化烷基、被C1-C10直链或支化烷氧基取代的C1-C10直链或支化烷基、未被取代的C5-C12环烷基、被C1-C10直链或支化烷氧基取代的C5-C12环烷基、未被取代的C5-C12芳基、被C1-C10直链或支化烷氧基取代的C5-C12芳基、未被取代的烯丙基及被C1-C10直链或支化烷氧基取代的烯丙基,并且X选自卤素基团、未被取代的磺酰亚胺基、被卤代烷基取代的磺酰亚胺基、未被取代的磺酰胺基和被卤代烷基取代的磺酰胺基。
式1的化合物是能够与Mg2+离子形成络合物的离子液体。这种络合可改进电解质的离子传导率、Mg2+离子的迁移数和镁盐的离解度。
根据另一个实施方案,式1中的R选自烯丙基、甲基、乙基、丙基、异丙基、丁基、异丁基、2-[2-(2-甲氧基乙氧基)乙氧基]乙基、环戊基、环己基和苯基。
根据另一个实施方案,式1的化合物以按重量计0.01%至1%的量被包含。如果式1的化合物的含量小于以上限定的下限,则可与镁离子形成少量的络合物并且改善离解度的效果可劣化,导致了离子传导率的改善的可能性可不明显。同时,如果式1的化合物的含量超过以上限定的上限,则离子液体不溶解并以固体形式存在,导致电池的电阻增加和短路危险增加,使得其难以应用于镁电池。
根据另一个实施方案,式1的化合物选自N-烯丙基-N-甲基吡咯烷 氯化物、N-烯丙基-N-甲基吡咯烷 溴化物、N-烯丙基-N-甲基吡咯烷 双(三氟甲烷)磺酰亚胺、N-丁基-N-甲基吡咯烷 溴化物、N-丁基-N-甲基吡咯烷 氯化物、1-{2-[2-(2-甲氧基乙氧基)乙氧基]乙基}-1-甲基吡咯烷 溴化物和1-{2-[2-(2-甲氧基乙氧基)乙氧基]乙基}-1-甲基吡咯烷 氯化物。
根据另一个实施方案,式1的化合物与镁离子的络合物存在于电解质中。该络合物可具有其中镁离子被式1的化合物溶剂化的多种结构。这种络合可有效地改善电解质的离子传导率和镁离子的迁移数。
根据另一个实施方案,公开了用于镁电池的电解质,其除根据前述实施方案中任一个所述的电解质组分之外还包含锂盐。锂盐的存在可有效地改善阴极处的反应速率。
根据另一个实施方案,锂盐选自氯化锂选自LiCl、双(三氟甲烷磺酰基)酰亚胺锂、LiClO4、LiBF4、LiPF6及其混合物。
根据另一个实施方案,锂盐以0.1M至0.5M的浓度被包含。如果锂盐的浓度低于以上限定的下限,则电解质的离子传导率不会有很大程度的增加并且在混合电池制造中在阴极上可加载有限量的阴极材料。同时,如果锂盐的浓度超过以上限定的上限,则过量添加的锂盐并不有助于进一步改善离子传导率并且电解质是过饱和的,使得部分锂盐不溶解。
在另一个方面中,本发明提供了制备用于镁电池的电解质的方法,其包括:(a)将镁粉添加到有机溶剂中金属氯化物盐的溶液中以获得第一溶液。
根据一个实施方案,所述方法还包括在步骤(a)之后,(b)将式1的化合物添加到第一溶液中以制备第二溶液。
根据另一个实施方案,该方法还包括:(c)将锂盐在步骤(a)之后添加到第一溶液中或在步骤(b)之后添加到第二溶液中以制备第三溶液。
在另一个方面,本发明提供了包括根据示例性实施方案中任一个的电解质的镁电池。本发明的镁电池可以是镁可再充电电池或镁混合电池,但不限于此。
将对本发明的另一些实施方案进行进一步的描述。然而,本发明不应解释为限于以下描述。
根据本发明的一个实施方案,将镁粉添加到有机溶剂中金属氯化物盐如AlCl3或CrCl3的溶液中,这将本发明的电解质与常规格氏溶液区分开来。镁缓慢溶解直到金属氯化物盐、金属镁和镁离子达到平衡。金属氯化物盐是用于形成镁离子的电解质盐,是用于镁电池的电解质的非常重要的离子。
根据一个实施方案,可将由式1表示的离子液体化合物添加到电解质以与镁离子形成络合物。可进一步任选地将锂盐添加到处于平衡状态的该溶液或包含络合物的溶液以改善阴极处的反应速率。
特别地,当有机溶剂是四氢呋喃(THF)且金属氯化物盐是第一金属氯化物盐(例如,氯化铝(AlCl3))和第二金属氯化物盐(例如,CrCl3)的混合物时,由金属镁和THF通过第二金属氯化物盐的催化活性形成具有式2结构的1-氧杂-2-镁杂环己烷,并使其在电解质中与第一金属氯化物盐混合。
然后使该化合物与AlCl3结合以产生包含大量用于电荷输送的离子物质的电解质溶液。由此制备的电解质溶液基本上包含[MgCl·5THF]+或[Mg2Cl3·3THF]+作为阳离子以及烷基烷氧基铝酸盐如[Al(C4H8O)2]-、[AlCl2(C4H8O)]-或聚合物作为阴离子。[Al(C4H8O)2]-和[AlCl2(C4H8O)]-分别由式3和式4表示:
金属氯化物盐的总浓度优选为约0.001至约1.0M。
将在以下讨论包括电解质的镁电池充电/放电过程的机理。当电池放电时,在镁阳极发生氧化反应,其中金属镁被氧化成Mg2+离子,其溶解在电解质中。Mg2+离子从电解质迁移至阴极。在阴极处Mg2+离子被还原。具体而言,Mg2+离子被嵌入到阴极活性材料结构中。
当充电时,在阴极处发生氧化反应,其中Mg2+离子从阴极活性材料结构中脱嵌到电解质中。脱嵌的Mg2+离子从电解质迁移至镁阳极。Mg2+离子在Mg电镀发生的阳极处被还原成镁。
由于Mg2+离子的嵌入和脱嵌,在阴极处的反应较慢,限制了对适于加速反应的阴极活性材料的选择。根据本发明的一些实施方案,进一步添加锂盐,以通过Li+离子的嵌入和脱嵌替代Mg2+离子在阴极活性材料中的嵌入和脱嵌。锂盐提供了阴极活性材料的广泛选择。
锂盐可包含在其中式1的化合物存在或不存在的电解质中。锂盐的使用可改善阴极处的反应速率并且可有效地拓宽阴极活性材料的选择。
在高功率电池如用于电动车辆的电池中,常规格氏电解质遭受低的离子传导率和低的Mg2+离子迁移数,并且需要加以改进。根据本发明的一些实施方案,使用由式1表示的离子液体化合物可改善电解质的离子传导率和镁离子的迁移数,原因是其能够与镁离子形成络合物。因此,本发明的电解质可用于制造具有改善功率的镁电池并且其适用性可扩展至用于电动车辆的高输出镁电池。
根据本发明的一些实施方案,本发明的电解质包含按重量计0.01%至1%的式1的离子液体化合物。
如果以低于按重量计0.01%的量添加离子液体,则与镁离子形成少量的络合物并且改善离解度的效果可劣化,导致了低的离子传导率。同时,如果以超过按重量计1%的量添加离子液体时,则离子液体不溶解并以固体形式存在,导致电池电阻的增加和短路的危险增加,使得其难以适用于镁电池。
本发明还提供了制备用于镁电池的电解质的方法,其包括:(a)将金属氯化物盐(例如,AlCl3和CrCl3)溶解在有机溶剂中,将镁粉添加到该溶液中,使得镁能够缓慢溶解以制备在其中金属氯化物盐、金属镁和镁离子达到平衡状态的第一电解质溶液,并任选地将由式1表示的离子液体化合物添加到第一电解质溶液中以制备第二电解质溶液,在其中形成了离子液体化合物与镁离子的络合物;以及(b)将能够改善阴极处的反应速率的锂盐溶解在第一电解质溶液或第二电解质溶液中以制备第三电解质溶液。
发现与用于镁电池的常规电解质相比,通过本发明方法制备的电解质具有较高的离子传导率(测验实施例1)并在0至4V(相对Mg/Mg2+)的范围中显示出更稳定的电化学性质(参见测验实施例2)。这些结果表明本发明的电解质适用于镁电池。
将参考以下实施例更加详细地解释本发明。然而,这些实施例不应被解释为限制或约束本发明的范围和公开内容。应理解,基于本发明的教导(包括以下的实施例),本领域的技术人员可容易地实践其实验结果未明确示出的本发明的其他实施方案。
实施例
实施例1:制备AlCl3-CrCl3-BMPBr-镁离子络合物-LiCl混合物的溶液
将6.667gAlCl3和0.1584gCrCl3溶解于100mL作为溶剂的THF中以制备溶液,其中AlCl3和CrCl3分别以0.5M和0.01M的浓度存在。向该溶液中添加3g镁粉。将该混合物保持24小时以使AlCl3、CrCl3、金属镁和镁离子达到平衡,然后将0.2gBMPBr作为离子液体溶解在其中以与镁离子形成络合物。最后,将2.120gLiCl溶解于l00mL包含镁离子络合物的溶液中。所得溶液由0.5MAlCl3、0.01MCrCl3、0.2%BMPBr、镁离子络合物和0.5MLiCl构成。从溶液中除去固体级分后,收集剩余的液体级分并用作电解质。
实施例2:制备AlCl3-CrCl3-AMPCl-镁离子络合物-LiCl混合物的溶液
除了将AMPCl用作离子液体替代BMPBr之外,以与实施例1相同的方式制备电解质。
实施例3:制备AlCl3-CrCl3-BMPCl-镁离子络合物混合物的溶液
除了不将LiCl添加到溶液中之外,以与实施例1相同的方式制备电解质。
实施例4:制备AlCl3-CrCl3混合物的溶液
除了不使用离子液体和LiCl之外,以与实施例1相同的方式制备电解质。
实施例5:制备AlCl3-CrCl3-LiCl混合物的溶液
除了不使用离子液体之外,以与实施例1相同的方式制备电解质。
比较例1:制备APC溶液
根据常规方法,将0.04摩尔(PhMgCl)2-AlCl3作为复盐溶解在100mL作为溶剂的THF中以制备0.4MAPC电解质。
测试实施例1:离子传导率测量
测量了实施例1-5和比较例1的电解质的离子传导率。结果示于表1。
表1
如可由表1结果看出的,在正常操作温度范围中实施例1至3的电解质的离子传导率为5.0至7.0mS/cm并且不含有离子液体的实施例4和5的电解质的离子传导率分别为4.5mS/cm和5.0mS/cm,其高于比较例1的电解质(4.0mS/cm)。
此外,在实施例1至5的电解质中Mg2+盐的离解度得到了改善。
测试实施例2:电化学稳定性评估
在该测试实施例中,评估了实施例1至3和比较例1的电解质的电化学稳定性。首先,组装镍电极、PP隔板和作为对电极的镁金属,以构建镁半电池(halfcell)。将实施例1至3和比较例1的电解质各自注入半电池中。此后,通过线性扫描伏安法以10mV/秒的扫描速率研究电池的电化学稳定性。结果示于图1。
参照图1,发现实施例1至3的电解质在0至4V(相对于Mg/Mg2+)的电压范围中显示出比比较例1的电解质更稳定的电化学性质。这些结果表明,在实施例1至3的电解液中形成的[MgCl·5THF]+和[Mg2Cl3·3THF]+阳离子以及式3和式4的阴离子在电极表面上进行较少的氧化分解,表明与电解质一起使用高电压阴极材料可导致更稳定的电化学行为。
测试实施例3:测量镁电池性能
在该测试实施例中,对使用实施例1至3的电解质是否有助于改善镁可再充电电池和镁混合电池的性能进行了研究。首先,组装镁阳极、PP隔板和Mo6S8阴极并将电解质各自注入其中以制造镁可再充电电池或镁混合电池。在设定为0.5至1.9V的充电/放电电压下研究电池的容量和循环寿命。结果示于图2中。
参照图2,发现包括实施例1至3的电解质的电池在100次充电/放电循环后,具有102mAh/g或更高的每单位质量的放电容量,比包括比较例1的电解质的电池(85mAh/g)高得多。
总之,实施例1至3的电解质比常规电解质具有更高的离子传导率并显示出更好的电化学稳定性。此外,实施例1至3的电解质中Mg2+盐的离解度高于常规电解质。发现包括实施例1至3的电解质的电池具有显著改善的容量和循环寿命特征。特别地,发现包括实施例1至3的电解质的电池在100次充电/放电循环后,与包含常规电解质的电池相比,具有大大改善的每单位质量的比放电容量。
不含离子液体化合物的实施例4和实施例5的电解质略不如实施例1至3的电解质有效,但是发现与比较例1的电解质相比,显示出很大的改善效果。
用于镁可再充电电池的电解质及其制备方法专利购买费用说明
![]()
Q:办理专利转让的流程及所需资料
A:专利权人变更需要办理著录项目变更手续,有代理机构的,变更手续应当由代理机构办理。
1:专利变更应当使用专利局统一制作的“著录项目变更申报书”提出。
2:按规定缴纳著录项目变更手续费。
3:同时提交相关证明文件原件。
4:专利权转移的,变更后的专利权人委托新专利代理机构的,应当提交变更后的全体专利申请人签字或者盖章的委托书。
Q:专利著录项目变更费用如何缴交
A:(1)直接到国家知识产权局受理大厅收费窗口缴纳,(2)通过代办处缴纳,(3)通过邮局或者银行汇款,更多缴纳方式
Q:专利转让变更,多久能出结果
A:著录项目变更请求书递交后,一般1-2个月左右就会收到通知,国家知识产权局会下达《转让手续合格通知书》。
动态评分
0.0