专利摘要
本发明提供了一种噻吩并四氢吡啶乙腈化合物(IV)的制备方法,包括如下步骤:式(II)化合物或其盐和式(III)化合物在碱性条件下在有机溶剂中于0-110℃反应,后处理得产物,所述的盐为式(II)化合物的盐酸盐或硫酸盐;本发明采用一步法合成噻吩并四氢吡啶乙腈化合物,工艺简单,收率高。
权利要求
1、一种如式(IV)的噻吩并四氢吡啶乙腈化合物的制备方法,包括如下步骤:式(II)化合物或其盐和式(III)化合物在碱性条件下在有机溶剂中于0-110℃反应,后处理得式(IV)化合物,所述的盐为式(II)化合物的盐酸盐或硫酸盐;
其中式(III)中X为氢、氟、氯、溴或碘原子,Y为Br、Cl或酯基。
2、如权利要求1所述的制备方法,其特征在于所述的X为2-氯。
3、如权利要求1所述的制备方法,其特征在于所述的Y为Br或Cl。
4、如权利要求1所述的制备方法,其特征在于所述的酯基为下列之一:乙酸酯基、对甲苯磺酰基、甲磺酰基。
5、如权利要求1所述的制备方法,其特征在于所述的有机溶剂为下式之一或一种以上的任意组合:乙酸乙酯、乙酸丁酯、丙酮、丁酮、甲基异丁基甲酮、甲苯、二甲苯、氯代苯、二氯甲烷、二氯乙烷、氯仿,DMF、DEF、DMSO、THF、DME、二氧六环、乙腈、甲醇、正丁醇,所述有机溶剂的用量按每1g式(III)化合物计算为1~5ml。
6、如权利要求5所述的制备方法,其特征在于所述的有机溶剂为甲醇或正丁醇或它们任意比例的混合液。
7、如权利要求1所述的制备方法,其特征在于所述碱性条件为加入下列之一或一种以上的任意组合的碱∶氢氧化钠、氢氧化钾、碳酸氢钠、碳酸钠、碳酸氢钾、碳酸钾、三乙胺、吡啶、N,N-二烷基苯胺、醇钠,碱与式(III)化合物的当量比为1-5∶1。
8、如权利要求7所述的制备方法,其特征在于采用的碱为碳酸氢钠。
9、如权利要求1-8之一所述的制备方法,其特征在于所述的反应在50-80℃下进行。
10、如权利要求1所述的制备方法,其特征在于式(III)化合物由式(VIII)化合物于80-150℃与卤素经卤代反应而得;
其中式(III)和(VIII)中X代表氢、氟、氯、溴或碘原子,Y为Br或Cl。
11、如权利要求10所述的制备方法,其特征在于所述的X为2-氯。
12、如权利要求10所述的制备方法,其特征在于卤代反应中卤素为溴素或氯气。
13、如权利要求10所述的制备方法,其特征在于所述卤代反应的温度为100-130℃。
14、如权利要求10~13之一所述的制备方法,其特征在于所述卤代反应中卤素与式(VIII)化合物的当量比为0.5-1.5∶1。
15、如权利要求14所述的制备方法,其特征在于卤代反应中卤素与式(VIII)化合物的当量比为0.9-1.2∶1。
16、如权利要求1所述的制备方法,其特征在于所述的式(III)化合物中Y为酯基,化合物(III)由下述步骤制备而得:式(IX)化合物和酯化试剂在碱性条件下在有机溶剂中于0-100℃进行酯化反应,后处理得产物;所述的酯化试剂为酰氯或酸酐或有机酸;
其中式(IX)中所述的X代表氢、氟、氯、溴或碘原子。
17、如权利要求16所述的制备方法,其特征在于所述的酯化试剂为对甲苯磺酰氯或甲磺酰氯。
18、如权利要求16所述的制备方法,其特征在于式(III)化合物制备方法中所述的有机溶剂为下列之一或一种以上的任意组合:乙酸丁酯、甲苯、二甲苯、氯代苯、乙腈,所述有机溶剂的用量按每1g式(IX)化合物计算为1~5ml。
19、如权利要求16所述的制备方法,其特征在于所述的碱性条件下采用下列之一的碱或一种以上的任意组合:氢氧化钠、氢氧化钾、三乙胺、N,N-二甲基苯胺。
20、如权利要求16~19之一所述的制备方法,其特征在于所述的碱与式(IX)化合物的当量比为1-5∶1,所述的酯化反应温度为0-30℃。
说明书
技术领域(一)技术领域
本发明涉及一种噻吩并四氢吡啶乙腈化合物的合成方法,属于化学制药领域。
技术背景(二)背景技术
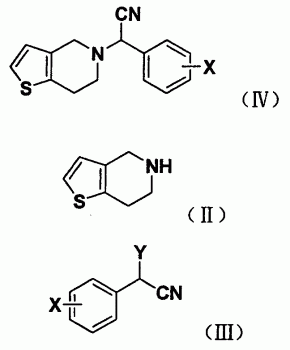
如式(IV)的噻吩并四氢吡啶乙腈化合物是制备噻吩并四氢吡啶乙酸甲酯化合物如氯吡格雷等的重要中间体。中国专利申请CN1487943A公开了一种制备所述噻吩并四氢吡啶腈化合物的方法:通过使式(II)化合物或其盐与通式氰化物MCN反应,然后加入芳基醛化合物(X代表氢、氟、氯、溴或碘原子,M代表碱金属、三甲代甲硅烷基、Cu或氢)发生Strecker反应得到通式(IV)的外消旋化合物。
该方法存在选择性较低,产物收率低的缺点,而且该方法必须采用氰化合物,在运输、贮存、操作安全、环保等方面存在诸多不利。
发明内容(三)发明内容
本发明提供了一种反应工艺简单、收率高的合成如式(IV)的噻吩并四氢吡啶乙腈化合物的方法。
所述的合成方法包括如下步骤:式(II)化合物或其盐和式(III)化合物在碱性条件下在有机溶剂中于0-110℃反应,后处理得式(IV)化合物,所述的盐为式(II)化合物的盐酸盐或硫酸盐;
其中式(III)中X为氢、氟、氯、溴或碘原子,优选为2-氯;Y为Br、Cl或酯基,优选为Br或Cl,更优选为Br;所述的酯基优选为下列之一:乙酸酯基、对甲苯磺酰基、甲磺酰基。
所述有机溶剂的用量按每1g式(III)化合物计算通常为1~5ml。
所述的有机溶剂如:乙酸乙酯、乙酸丁酯等酯类溶剂;丙酮、丁酮、甲基异丁基甲酮等酮类溶剂;甲苯、二甲苯、(多)氯(取)代苯等或者二氯甲烷、二氯乙烷、氯仿等卤代溶剂,DMF,DEF,DMSO,THF,DME,二氧六环、乙腈,C1~C4的醇如甲醇、乙醇、正丁醇等或者它们的混合溶剂等;所述的有机溶剂优选为甲醇或正丁醇或它们的混合液。
所述的合成反应在碱性条件下进行,采用的碱可为下列之一或一种以上的任意组合:氢氧化钠、氢氧化钾、碳酸氢钠、碳酸钠、碳酸氢钾、碳酸钾、三乙胺、吡啶、N,N-二烷基苯胺、醇钠,碱与式(III)化合物的当量比一般为1-5∶1。
所述的反应优选在50-80℃下进行,反应收率达到85%以上。
上述的式(III)中若Y为Br或Cl,则式(III)化合物可由式(VIII)化合物于80-150℃与卤素经卤代反应而得;
其中式(III)和(VIII)中X代表氢、氟、氯、溴或碘原子,优选为2-氯;Y为Br或Cl。
所述卤代反应的温度优选为100-130℃。
所述卤代反应中卤素与式(VIII)化合物的当量比优选为0.5-1.5∶1,更优选为0.9-1.2∶1。
本发明所述的卤代反应反应完毕,只需经过洗涤、分层等常规的后处理步骤即得取代芳香腈化合物纯品。
上述的式(III)中若Y为酯基,则式(III)化合物可由下述步骤制备而得:式(IX)化合物和酯化试剂在碱性条件下在有机溶剂中于0-100℃进行酯化反应,后处理得式(III)化合物;所述的酯化试剂为酰氯或酸酐或有机酸;
其中式(III)和(IX)中所述的X代表氢、氟、氯、溴或碘原子,优选为2-氯;Y为酯基,优选为下列之一:乙酸酯基、对甲苯磺酰基、甲磺酰基。
所述的酯化试剂如对甲苯磺酰氯、甲磺酰氯、酸酐、醋酸、乙酰氯等,优选为对甲苯磺酰氯或甲磺酰氯。酯化试剂与式(IX)化合物的当量比优选为1-1.2∶1。
化合物(IX)制备化合物(III)中所用的有机溶剂如下列之一或一种以上的任意组合:乙酸乙酯、乙酸丁酯、丙酮、丁酮、甲基异丁基甲酮、甲苯、二甲苯、氯代苯、二氯甲烷、二氯乙烷、氯仿、DMF、DEF、DMSO、THF、DME、二氧六环、乙腈。有机溶剂优选为下列之一或一种以上的任意组合:乙酸丁酯、甲苯、二甲苯、氯代苯、乙腈。所述有机溶剂的用量按每1g式(IX)化合物计算一般为1~5ml。
所述反应在碱性条件下进行,可采用下列之一的碱或一种以上的任意组合:氢氧化钠、氢氧化钾、碳酸氢钠、碳酸钠、碳酸氢钾、碳酸钾、三乙胺、吡啶,N,N-二烷基苯胺,优选采用下列之一的碱或一种以上的任意组合:氢氧化钠、氢氧化钾、三乙胺、N,N-二甲基苯胺。所述的碱与式(IX)化合物的当量比一般为1-5∶1。
所述的酯化反应温度优选为0-30℃。
通过控制合成原料,本发明所述的合成方法可以用来合成关键中间体式(IV)化合物及式(III)化合物的光学(手性)异构体及其外消旋体。
本发明采用一步法合成噻吩并四氢吡啶乙腈化合物,工艺简单,收率高。
附图说明具体实施方式(四)具体实施方式
下面结合实施例对本发明作进一步说明,但本发明的保护范围并不限于此。
实施例1(±)-(2-氯苯基)-(4,5,6,7-四氢噻吩并[3,2-c]吡啶-5-基)乙腈的合成
将98.65g(0.428mol)的α-溴代邻氯苯乙腈,300ml甲醇,84g(1.0mol)碳酸氢钠和4,5,6,7-四氢噻吩并[3,2-c]吡啶盐酸盐70.2g(0.4mol)投入到合适的反应瓶中,然后将体系回流反应3个小时以上直到TLC检测主原料点消失。将体系冷却至0-5℃,过滤,滤饼用水充分搅拌洗涤,然后再用冷甲醇洗涤,干燥得浅黄色细颗粒状固体98g(收率85%)。
所得产物用IR光谱、质谱、13C-NMR和1H-NMR鉴别如下:
IR光谱(cm-1):2227(w,-CN)
质谱(m/z):289.1(M+H)+
13C-NMR(CDCl3):δ136.46,132.78,132.38,130.69,130.46,130.38,129.90,126.73,124.96,123.01,115.09,59.12,49.30,47.66,25.47
1H-NMR(CDCl3):δ7.2-7.7(4H,m),7.0(1H,d),6.69(1H,d),5.32(1H,s),3.78(1H,d),3.65(1H,d),2.8-3.0(4H,m)
实施例2(±)-(2-氯苯基)-(4,5,6,7-四氢噻吩并[3,2-c]吡啶-5-基)乙腈的合成
以正丁醇替代甲醇,其它反应步骤同实施例1,反应完毕,将体系冷却0-5℃,过滤,滤饼用水充分搅拌洗涤,然后再用冷丁醇洗涤,干燥得浅黄色细颗粒状固体99.2g(收率86%)。
实施例3(±)-(2-氯苯基)-(4,5,6,7-四氢噻吩并[3,2-c]吡啶-5-基)乙腈的合成
以α-氯代邻氯苯乙腈替代α-溴代邻氯苯乙腈,其它反应步骤同实施例1。反应完毕,将体系冷却至0-5℃,过滤,滤饼用水充分搅拌洗涤,然后再用冷甲醇洗涤,干燥得浅黄色细颗粒状固体94.5g(收率82%)。可达到一般的合成要求。
实施例4(±)-(2-氯苯基)-(4,5,6,7-四氢噻吩并[3,2-c]吡啶-5-基)乙腈的合成
以α-氯代邻氯苯乙腈替代α-溴代邻氯苯乙腈,其它反应步骤同实施例2。反应完毕,将体系冷却至0-5℃,过滤,滤饼用水充分搅拌洗涤,然后再用冷丁醇洗涤,干燥得浅黄色细颗粒状固体94.5g(收率82%)。
实施例5(±)-(2-氯苯基)-(4,5,6,7-四氢噻吩并[3,2-c]吡啶-5-基)乙腈的合成
以(±)邻氯扁桃腈对甲苯磺酸酯替代α-溴代邻氯苯乙腈,其它反应步骤同实施例1。反应完毕,将体系冷却0-5℃,过滤,滤饼用冷水充分搅拌洗涤,然后再用冷甲醇洗涤,干燥得浅黄色细颗粒状固体102.5g(收率89%)。
实施例6(±)-(2-氯苯基)-(4,5,6,7-四氢噻吩并[3,2-c]吡啶-5-基)乙腈的合成
以(±)邻氯扁桃腈甲磺酸酯替代α-溴代邻氯苯乙腈,其它反应步骤同实施例1。反应完毕,将体系冷却0-5℃,过滤,滤饼用冷水充分搅拌洗涤,然后再用冷甲醇洗涤,干燥得浅黄色细颗粒状固体104.1g(收率90.3%)。
实施例7(S)-(2-氯苯基)-(4,5,6,7-四氢噻吩并[3,2-c]吡啶-5-基)乙腈的合成
以(S)-邻氯扁桃腈对甲苯磺酸酯替代(±)邻氯扁桃腈对甲苯磺酸酯,其它同实施例5。得浅黄色细颗粒状固体102.5g(收率89%)。ee.>99%。
实施例8(S)-(2-氯苯基)-(4,5,6,7-四氢噻吩并[3,2-c]吡啶-5-基)乙腈的合成
以(S)-邻氯扁桃腈甲磺酸酯替代(±)邻氯扁桃腈甲磺酸酯,其它同实施例6。得浅黄色细颗粒状固体104.1g(收率90.3%)。ee.>99%。
实施例9(R)-(2-氯苯基)-(4,5,6,7-四氢噻吩并[3,2-c]吡啶-5-基)乙腈的合成
以(R)-邻氯扁桃腈对甲苯磺酸酯替代(±)邻氯扁桃腈对甲苯磺酸酯,其它同实施例5。得浅黄色细颗粒状固体102.5g(收率89%)。ee.>99%。
实施例10(R)-(2-氯苯基)-(4,5,6,7-四氢噻吩并[3,2-c]吡啶-5-基)乙腈的合成
以(R)-邻氯扁桃腈甲磺酸酯替代(±)邻氯扁桃腈甲磺酸酯,其它同实施例6。得浅黄色细颗粒状固体104.1g(收率90.3%)。ee.>99%。
实施例11(±)-(2-氯苯基)-(4,5,6,7-四氢噻吩并[3,2-c]吡啶-5-基)乙腈的合成
以丙酮代替甲醇,以40g(1.0mol)氢氧化钠代替碳酸氢钠,其它反应步骤同实施例1,反应完毕,将体系冷却0-5℃,过滤,滤饼用水充分搅拌洗涤,然后再用冷丁醇洗涤,干燥得浅黄色细颗粒状固体99.2g(收率86%)。
实施例12(±)-(2-氯苯基)-(4,5,6,7-四氢噻吩并[3,2-c]吡啶-5-基)乙腈的合成
以氯仿替代甲醇,以40g(1.0mol)氢氧化钠代替碳酸氢钠,其它反应步骤同实施例1,反应完毕,将体系冷却0-5℃,过滤,滤饼用水充分搅拌洗涤,然后再用冷丁醇洗涤,干燥得浅黄色细颗粒状固体99.2g(收率86%)。
实施例13(±)-(2-氯苯基)-(4,5,6,7-四氢噻吩并[3,2-c]吡啶-5-基)乙腈的合成
以54g(1.0mol)甲醇钠代替碳酸氢钠,其它反应步骤同实施例1,反应完毕,将体系冷却0-5℃,过滤,滤饼用水充分搅拌洗涤,然后再用冷丁醇洗涤,干燥得浅黄色细颗粒状固体94.5g(收率82%)。
实施例14(±)-(2-氯苯基)-(4,5,6,7-四氢噻吩并[3,2-c]吡啶-5-基)乙腈的合成
以甲苯替代甲醇,以40g(1.0mol)氢氧化钠代替碳酸氢钠,其它反应步骤同实施例1,反应完毕,将体系冷却0-5℃,过滤,滤饼用水充分搅拌洗涤,然后再用冷丁醇洗涤,干燥得浅黄色细颗粒状固体98g(收率85%)。
实施例15(±)-(2-氯苯基)-(4,5,6,7-四氢噻吩并[3,2-c]吡啶-5-基)乙腈的合成
以乙腈替代甲醇,其它反应步骤同实施例1,反应完毕,将体系冷却0-5℃,过滤,滤饼用水充分搅拌洗涤,然后再用冷丁醇洗涤,干燥得浅黄色细颗粒状固体95.7g(收率83%)。
实施例16(±)-(2-氯苯基)-(4,5,6,7-四氢噻吩并[3,2-c]吡啶-5-基)乙腈的合成
以THF替代甲醇,以40g(1.0mol)氢氧化钠代替碳酸氢钠,其它反应步骤同实施例1,反应完毕,将体系冷却0-5℃,过滤,滤饼用水充分搅拌洗涤,然后再用冷丁醇洗涤,干燥得浅黄色细颗粒状固体94.5g(收率82%)。
实施例17(±)-(2-氯苯基)-(4,5,6,7-四氢噻吩并[3,2-c]吡啶-5-基)乙腈的合成
以乙酸丁酯替代甲醇,以101g(1.0mol)三乙胺代替碳酸氢钠,其它反应步骤同实施例1,反应完毕,将体系冷却0-5℃,过滤,滤饼用水充分搅拌洗涤,然后再用冷丁醇洗涤,干燥得浅黄色细颗粒状固体98g(收率85%)。
实施例18(±)-(2-氯苯基)-(4,5,6,7-四氢噻吩并[3,2-c]吡啶-5-基)乙腈的合成
将98.65g(0.428mol,107%)的α-溴代邻氯苯乙腈,300mlDMF,84g(1.0mol)碳酸氢钠和4,5,6,7-四氢噻吩并[3,2-c]吡啶盐酸盐70.2g(0.4mol)投入到合适的反应瓶中,然后将体系升温至100℃反应3个小时以上直到TLC检测主原料点消失。将体系冷却至0-5℃,过滤,滤饼用水充分搅拌洗涤,然后再用冷甲醇洗涤,干燥得浅黄色细颗粒状固体99.2g(收率86%)。
实施例19(±)α-溴代邻氯苯乙腈的合成
将151.5g(1mol)的邻氯苯乙腈置于500ml的三口烧瓶中,体系升温至110℃,维持温度开始滴加176g(1.1mol)溴素,在三个小时内滴加完毕。继续保持在此条件下搅拌反应三个小时,然后将反应体系冷却到30℃以下,加入水400毫升,充分搅拌洗涤(HBr)5分钟,静置,分层,有机层加入5%左右的亚硫酸氢钠溶液少许洗涤,搅拌15分钟,然后静置分层。有机层用水洗涤至近中性,得红棕色油状物225g,(沸点:-110℃/15mmHg;IR:2969,2253,1472;1HNMR:5.87s,7.42m;7.83t),收率96%。经过简单蒸(精)馏得产品200g,收率86%。
实施例20(±)α-氯代邻氯苯乙腈的合成
将151.5g(1mol)的邻氯苯乙腈置于500ml的三口烧瓶中,体系升温至120℃,维持温度开始通80g氯气,通气时间6个小时。通气后继续保持在此条件下搅拌反应三个小时,然后将反应体系冷却到30℃以下,加入水400毫升,充分搅拌洗涤5分钟,静置,分层,有机层加入5%左右的亚硫酸氢钠溶液少许洗涤,搅拌15分钟,然后静置分层。有机层用水洗涤至近中性,得粗品172g,收率92.5%,粗品经过蒸馏得产品159g,收率85.5%。
实施例21(±)α-氯代邻氯苯乙腈的合成
将151.5g(1mol)的邻氯苯乙腈置于500ml的三口烧瓶中,体系升温至100℃,维持温度开始通100g氯气,通气时间6个小时。通气后继续保持在此条件下搅拌反应三个小时,然后将反应体系冷却到30℃以下,加入水400毫升,充分搅拌洗涤5分钟,静置,分层,有机层加入5%左右的亚硫酸氢钠溶液少许洗涤,搅拌15分钟,然后静置分层。有机层用水洗涤至近中性,得粗品172g,收率92.5%,粗品经过蒸馏得产品159g,收率85.5%。
实施例22(±)邻氯扁桃腈对甲苯磺酸酯的合成
将16.8g(0.1mol)的邻氯扁桃腈,21g(0.11mol)的对甲苯磺酰氯,80ml的乙腈混合加入合适的反应瓶中,0-25℃滴加20g(0.2mol)的三乙胺,室温反应5小时后,将体系回流,用薄层层析板跟踪反应。反应完成后,回收乙腈。然后向反应体系中加入乙酸丁酯萃取,并用水多次洗涤,减压脱除乙酸丁酯,得目标产物30g(93.75%)。
实施例23(±)邻氯扁桃腈对甲苯磺酸酯的制备
将16.8g(0.1mol)的邻氯扁桃腈,21g(0.11mol)的对甲苯磺酰氯,100ml的甲苯混合加入合适的反应瓶中,0-5℃滴加100g 5%NaOH(0.125mol)溶液,10-15℃继续反应,用薄层层析板跟踪反应,反应完成后,分离甲苯层,50×2ml(萃取两次,每次50ml)甲苯萃取碱层。水洗甲苯层,减压脱除甲苯,得目标产物29g(90.6%)。
实施例24(S)-邻氯扁桃腈对甲苯磺酸酯的制备
将16.8g(0.1mol)的(S)-邻氯扁桃腈,21g(0.11mol)的对甲苯磺酰氯,100ml的乙酸丁酯混合加入合适的反应瓶中,0-5℃滴加10ml N,N-二甲基苯胺,20-25℃继续反应3小时,将体系回流,用薄层层析板跟踪反应,反应完成后,冷却,加5%稀盐酸50ml,室温搅拌,分出乙酸丁酯层,50X2ml水洗乙酸丁酯层,减压脱除乙酸丁酯,得目标产物31g(96.9%)。ee99%min.
实施例25(R)-邻氯扁桃腈对甲苯磺酸酯
以(R)邻氯扁桃腈代替邻氯扁桃腈,其它同实施例22,得目标产物(R)-邻氯扁桃腈对甲苯磺酸酯160g。ee,99%min.
实施例26(±)邻氯扁桃腈甲磺酸酯的制备
将21g对甲苯磺酰氯替换为13g甲磺酰氯,其它步骤同实施例23,得目标产物24g(97.6%)。
一种噻吩并四氢吡啶乙腈化合物的合成方法专利购买费用说明
![]()
Q:办理专利转让的流程及所需资料
A:专利权人变更需要办理著录项目变更手续,有代理机构的,变更手续应当由代理机构办理。
1:专利变更应当使用专利局统一制作的“著录项目变更申报书”提出。
2:按规定缴纳著录项目变更手续费。
3:同时提交相关证明文件原件。
4:专利权转移的,变更后的专利权人委托新专利代理机构的,应当提交变更后的全体专利申请人签字或者盖章的委托书。
Q:专利著录项目变更费用如何缴交
A:(1)直接到国家知识产权局受理大厅收费窗口缴纳,(2)通过代办处缴纳,(3)通过邮局或者银行汇款,更多缴纳方式
Q:专利转让变更,多久能出结果
A:著录项目变更请求书递交后,一般1-2个月左右就会收到通知,国家知识产权局会下达《转让手续合格通知书》。
动态评分
0.0