专利摘要
本发明公开了一类双联苄Mannich碱衍生物,是指结构式如通式(I)或(II)所示的化合物,或通式(I)所示的化合物的药用盐: 其中,所述NR1R2为二甲胺、二乙胺、二丙胺、二异丙胺、四氢吡咯、哌啶、吗啉或取代的哌嗪中的任一种;所述R3为H或NR1R2。其制备方法为:将片叶苔素D或异片叶苔素C与二级胺及福尔马林溶液或多聚甲醛,在常见的溶剂中,发生Mannich反应,常规浓缩、硅胶柱层析,即制得双联苄Mannich碱衍生物。本发明的双联苄Mannich碱衍生物在制备治疗人类成骨肉瘤、宫颈癌、前列腺癌等肿瘤的药物中具有较好的应用前景。
说明书
技术领域技术领域
本发明涉及一种双联苄Mannich碱衍生物及其制备方法与应用。
技术背景背景技术
双联苄类化合物多见于苔藓植物中,在结构上以C6-C2-C6母核的二聚体存在,以苯环之间连接方式不同而分为不同结构类型,通常根据植物来源命名;因苯环取代基的不同而产生众多化合物,根据所属的结构类型依次命名,如地钱素B-H,J-L,片叶苔素D,异片叶苔素C等(曲建博,娄红祥.四种苔类植物的化学成分及其生物活性.山东大学博士学位论文,2008),(Susanne F,Ulrich HM,Brigirle DN,et al.Biosynthesis of Cyclic Bisbibenzyls inMarchantia polymorpha.Phytochemistry,2001,50(4):589-598.)。到目前为至,已从苔类植物中获得100多个联苄类化合物,表现出各种各样的生物学活性,包括细胞毒、细胞生长抑制、细胞凋亡诱导、抗微生物、昆虫拒食、致敏、植物生长调节、强心、肌肉松弛、酶抑制等活性。
其中一些双联苄类化合物表现出的抗肿瘤活性。在地钱科植物中含量非常丰富的地钱素A具有细胞毒,抗微生物,昆虫拒食,肌肉松弛,5-脂氧酶,环氧合酶和钙调节蛋白抑制以及强心等广泛的生物活性(Asakawa Y.Recent advances in phytochemistry ofbryophytes-acetogenins,terpenoids and bis(bibenzyl)s from selected Japanese,Taiwanese,NewZealand,Argentinean and European liverworts.Phytochemistry,2001,56:297-312.),(Schwartner C.Effect of Marchantins and related compounds on 5-lipoxygenase and cyclooxygenase and theirantioxidant properties:A structure activity relationship study.Phytomedicine,1995,2:113-117.),地钱素A对KB肿瘤细胞株有细胞毒活性(IC50为8.39μg/ml)。Scher等(Scher JM,Burgess EJ,Lorimerb SD.et al.Acytotoxic sesquiterpene and unprecedented sesquiterpene-bisbibenzylcompounds from the liverwort Schistochila glaucescens,Tetrahedron,2002,58:7875-7882.)从歧舌苔属植物Schistochila glaucescens中分离得到了新地钱素A和B及地钱素C等几个常见的双联苄类化合物,活性筛选发现对P-388细胞株都有中等细胞毒活性(IC50为8-18μg/ml),并对枯草杆菌有抑制作用。
双联苄类化合物具有抗真菌的活性。地钱素A、地钱素B、新地钱素A、羽苔素E、13,13′-O-异丙叉基片叶苔素D和地钱素E(牛冲,娄红祥.苔类植物地钱中活性天然产物的筛选及分离.山东大学硕士学位论文,2004),TLC生物自显影测定对白色念珠菌的最低检出抑菌量(MID) 分别为2.5μg、4μg、0.2μg、0.25μg、0.4μg和4μg,硝酸咪康唑为对照(MID为0.01μg)。
苔类植物中常见的双联苄类化合物地钱素A,地钱素B,地钱素E,异片叶苔素C,片叶苔素C还具有弱的环氧合酶活性,IC50为45.2-58.0μM;此外,地钱素A,地钱素E,片叶苔素A,地钱素D对15-脂氧合酶也表现出抑制活性(Asakawa Y,Toyota M,Tori M,et al.Chemical structures of macrocyclic bis(bibenzyls)isolated from liverworts(Hepaticae).Spectroscopy.2000,14:149-175.)。
地钱中的地钱素A三甲醚可以对抗尼古丁引起的蛙腹直肌收缩,其肌松作用比筒箭毒碱弱3.5倍(Taira Z,Takei M,Endo K,et al.Marchantin A trimethyl ether:its molecular structure andtubocurarine-like skeletal muscle relaxation activity.Chem.Pharm.Bull.1994,42:52-56.)
正因为双联苄类化合物具有上述多种生物活性,引起人们对双联苄及其衍生物、类似物的研究。山东大学娄红祥教授课题组对一些双联苄类进行了全合成及修饰并对生物活性的研究。山东大学娄红祥教授课题组(Shi YQ.Zhu QJ.Yuan HQ.et al.Marchantin C,a macrocyclicbisbibenzyl,induces apoptosis of human glioma A172 cells.Cancer Letters,2008,262:173-182)对从苔藓植物中得到地钱素C进行了抗肿瘤活性筛选,发现对A172胶质瘤细胞有明显的抑制增殖和诱导凋亡作用。山东大学娄红祥教授课题组(Shi,YQ.,Zhu QJ,et al.Marchantin C,anovel microtubule inhibitor from liverwort with anti-tumor activity both in vivo and in vitro.Cancer Letters,2009,276:160-170)报到了无论是体内实验和还是体外实验,地钱素C是一种有效的微管抑制剂。同年,山东大学娄红祥教授课题组(Sun,B,Yan HQ,et al. Synthesis andmultidrug resistance reversal activity of dihydroptychantol A and its novel derivatives.Bioorganic& Medicinal Chemistry 2009,17:4981-4989.)又合成了一批能逆转多药耐药活性比dihydroptychantol A高3.2-4.3倍的双联苄化合物。2010年山东大学娄红祥课题组(Xi,GM.,Sun B,et al.Bisbibenzyl derivatives sensitize vincristine-resistant KB/VCR cells tochemotherapeutic agents by retarding P-gp activity.″Bioorganic & Medicinal Chemistry,2010,18:6725-6733.)又完成了Marchantin C全合成及衍生化的工作,活性实验表明,其衍生物与长春新碱联用对化疗药物的能抑制P-糖蛋白过度表达。
目前对双联苄类Mannich碱衍生物尚未见报道。
发明内容发明内容
针对上述现有技术,本发明提供了一种以双联苄化合物为先导化合物而合成的Mannich碱衍生物的方法,其与先导化合物一样,对肿瘤疾病等疾病具有良好的预防与治疗作用,但其活性明显强于先导化合物本身。
本发明是通过以下技术方案实现的:
双联苄Mannich碱衍生物,是指结构式如通式(I)或(II)所示的化合物,或通式(I)所示的化合物的药用盐:
其中,B环和D环可以通过为C-C键相接形成片叶苔素型(I)双联苄,异片叶苔素型(II)双联苄;
所述NR1R2为二甲胺、二乙胺、二丙胺、二异丙胺、四氢吡咯、哌啶、吗啉或取代的哌嗪等常见胺甲基基团任一种;
所述R3为H或NR1R2。
一种双联苄Mannich碱衍生物的制备方法:将如片叶苔素D(III)或异片叶苔素C(IV)所示的双联苄类化合物与二级胺及福尔马林溶液或多聚甲醛,在常见的溶剂中,发生Mannich反应,常规浓缩、硅胶柱层析,即制得双联苄Mannich碱衍生物;
所述二级胺为二甲胺、二乙胺、二丙胺、二异丙胺、四氢吡咯、哌啶、吗啉或取代的哌嗪中的任一种。
所述溶剂为甲醇、无水乙醇、95%乙醇或乙酸中的任一种。
所述反应温度为50~70℃。
所述反应物片叶苔素或异片叶苔素与二级胺,醛的摩尔比为(1∶1∶1)~(2∶2∶1)。
所述反应时间为3~15h。
合成示意图如下:
所述双联苄Mannich碱衍生物在制备治疗人类成骨肉瘤、宫颈癌、前列腺癌等肿瘤的药物中的应用。
本发明的双联苄Mannich碱衍生物是以双联苄化合物为先导化合物而合成的,经实验证明,其与先导化合物一样,对肿瘤等疾病具有良好的预防与治疗作用,但其活性药明显强于先导化合物本身,且双联苄Mannich碱衍生物结构中存在叔胺基团,能够成盐以提高其稳定及改善其药代动力学参数。
本发明的合成方法,路线十分简单,成本较低,产物的收率较高,适合于工业化生产。
附图说明附图说明
图1为实验例2(一)中目标化合物的抑瘤率示意图;
图2为实验例2(二)中化合物1及3对KB肿瘤的抑制率示意图。
具体实施方式具体实施方式
下面结合实施例对本发明作进一步的说明。
实施例1:片叶苔素D的二甲胺基衍生物的制备
步骤为:将片叶苔素D溶于甲醇中,加入37%甲醛水溶液和二甲胺,回流反应4至5小时后,将溶剂减压蒸干,残留物柱层析分离(洗脱剂为二氯甲烷-甲醇20∶1~1∶1),得其Mannich碱衍生物,将Mannich碱衍生物衍生物溶于干燥的乙酸乙酯中,通氯化氢,析出沉淀,过滤,得到相应的Mannich碱盐酸盐。
其合成反应示意如下:
实施例2:片叶苔素D的二乙胺基衍生物的制备
步骤为:将片叶苔素D溶于乙醇中,加入37%甲醛水溶液和二甲胺,回流反应10至15小时后,将溶剂减压蒸干,残留物柱层析分离(洗脱剂为二氯甲烷-甲醇40∶1~1∶1),得其Mannich碱衍生物,将Mannich碱衍生物衍生物溶于干燥的乙酸乙酯中,通氯化氢,析出沉淀,过滤,得到相应的Mannich碱盐酸盐。
其合成反应示意如下:
实施例3:异片叶苔素C的二甲胺基衍生物的制备
步骤为:将异片叶苔素C溶于乙醇中,加入37%甲醛水溶液和二乙胺,回流反应10至15小时后,将溶剂减压蒸干,残留物柱层析分离(洗脱剂为二氯甲烷-甲醇40∶1~1∶1),得其Mannich碱衍生物,将Mannich碱衍生物衍生物溶于干燥的乙酸乙酯中,通氯化氢,析出沉淀,过滤,得到相应的Mannich碱盐酸盐。
其合成反应示意如下:
实施例4:异片叶苔素C的二乙胺基衍生物的制备
步骤为:将异片叶苔素C溶于甲醇中,加入37%甲醛水溶液和二乙胺,回流反应10至15小时后,将溶剂减压蒸干,残留物柱层析分离(洗脱剂为二氯甲烷-甲醇40∶1~1∶1),得 其Mannich碱衍生物,将Mannich碱衍生物衍生物溶于干燥的乙酸乙酯中,通氯化氢,析出沉淀,过滤,得到相应的Mannich碱盐酸盐。
其合成反应示意如下:
片叶苔素D,异片叶苔素C,可以从苔藓植物中提取分离得到,也可以通过全合成得到。同法合成片叶苔素D、异地钱素C的其它Mannich碱衍生物。
(化合物1),白色固体,0.12g,产率61%,m.p.118~121℃;1HNMR(CDCl3,600MHz)δ(ppm):7.03(d,J=7.8Hz,1H),6.94(d,J=7.8Hz,1H),6.89(d,J=8.0Hz,2H),6.86(d,J=8.7Hz,1H),6.86(d,J=8.7Hz,1H),6.79(d,J=9.1Hz,1H),6.79(d,J=9.1Hz,1H),6.71(d,J=8.0Hz,1H),6.52(d,J=7.5Hz,1H),6.25(s,1H),5.33(s,1H),5.28(s,1H),3.83(d,J=13.9Hz,1H,PhCH2aN),3.61(d,J=13.9Hz,1H,PhCH2bN),2.98-2.86(m,3H),2.85-2.76(m,3H),2.62-2.54(m,1H),2.53-2.45(m,1H),2.32(s,6H,N(CH3)2).;ESI-MS:483.2.
(化合物2),白色固体,3.5g产率83%,m.p.129~133℃;1HNMR(CDCl3,600MHz)δ(ppm):7.05(d,J=7.8Hz,1H),6.96(d,J=7.8Hz,1H),6.92(d,J=7.7Hz,1H),6.90(m,4H),6.55(d,J=8.9Hz,1H),6.47(s,1H),6.34(s,1H),5.35(s,1H),3.85(d,J=13.9Hz,1H),3.75(d,J=13.7Hz,1H),3.71-3.61(m,2H),2.95(m,11.4Hz,3H),2.87-2.74(m,3H),2.57(m,11.7Hz,2H),2.41(s,6H),2.35(s,6H),2.19(s,3H).;ESI-MS:538.6.
(化合物4),白色固体,0.13g产率63%,m.p.119~122℃;1HNMR(CDCl3,600MHz) δ(ppm):1H NMR(600MHz,CDCl3)δ7.02(d,J=7.8Hz,1H),6.91(d,J=7.8Hz,1H),6.88(d,J=7.7Hz,1H),6.54-6.50(m,1H),3.85(t,J=14.9Hz,2H),3.77(t,J=14.7Hz,2H),2.98-2.83(m,3H),2.82-2.71(m,3H),2.65(t,J=12.0Hz,6H),2.55(t,J=12.0Hz,1H),2.49(t,J=11.6Hz,1H),1.15(t,J=7.1Hz,5H),1.06(t,J=7.1Hz,5H).;ESI-MS:511.3.
(化合物5),白色固体,0.32g产率81%,m.p.131~134℃;1H NMR(600MHz,CDCl3)δ7.06(d,J=15.3Hz,1H),7.01-6.91(m,4H),6.90-6.79(m,4H),6.76(t,J=9.5Hz,2H),6.61-6.53(m,2H),6.28(s,1H),5.37(s,1H),3.92(d,J=14.3Hz,1H),3.82(d,J=14.4Hz,1H),2.96(m,4H),2.84(m,4H),2.68(t,J=14.1Hz,6H),2.61(t,J=10.0Hz,2H),2.53(t,J=10.8Hz,1H),1.11(t,J=7.1Hz,6H);ESI-MS:596.4.
实验例1:化合物1,2,7对抗肿瘤活性实验
方法:人类成骨肉瘤细胞株U20S,宫颈癌细胞株Hela,前列腺癌细胞株PC3及其耐药株PC3PR细胞培养在5%CO2,饱和湿度的37℃培养箱中。耐药株PC3PR细胞是本实验室构建的对紫杉醇耐药的前列腺癌耐药株。U2OS细胞所用的培养基为Mc Coy′s 5A,Hela为DMEM,其余两种前列腺癌细胞株为RPMI-1640,所有用来培养细胞的培养基都含有10%胎牛血清,100μg/ml青霉素和100μg/ml的链霉素。
本实验用MTT方法来测定各种化合物的抗肿瘤活性,具体方法为:收集对数生长期细胞,0.25%胰蛋白酶消化接种,用含10%胎牛血清的细胞培养液制成细胞悬液,调整细胞悬液浓度加入96孔培养板中,每孔加入100μl,铺板使待测细胞调密度至5000个每孔,5%CO2,37℃孵育,至细胞单层铺满孔底。然后加入浓度梯度的药物,设置5个浓度梯度(2.5,5,10,20,40μM),每孔100μl,设3个复孔。于5%CO2,37℃培养箱中继续孵育。加药24h后,每孔加入10ul MTT溶液(5mg/ml,即0.5%MTT),继续培养4h之后,终止培养,小心吸去孔内培养液,每孔加入100μl二甲基亚砜,置摇床上低速振荡10min,使结晶物充分溶解。在酶联免疫检测仪OD570nm处测量各孔的吸光值。
结果:如表1所示:
表1双联苄类化合物的抗肿瘤作用研究
经试验证明,片叶苔素D的Mannich碱衍生物1,2对人骨肉瘤、子宫颈癌、人前列腺癌等肿瘤细胞及其耐药株细胞毒活性明显高于片叶苔素D本身;异片叶苔素C的Mannich碱衍生物7对人骨肉瘤、子宫颈癌活性明显高于异片叶苔素C本身;所以片叶苔素D和异片叶苔素C的Mannich碱衍生化为开发应用新一代抗肿瘤药物和多药耐药逆转药物开拓了新途径。
实验例2:化合物1,2对抗肿瘤体内实验
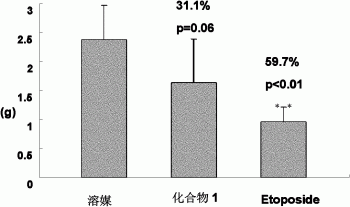
(一)取对数生长期的H460细胞,PBS洗涤后,以0.25%胰蛋白酶孵育消化成单个细胞,用加10%血清的1640培养基终止消化后,调整细胞浓度为3.5×107/ml,裸鼠腋下皮下注射瘤液,0.2ml/只,待腋下肿瘤长至100-300mm3后,随机分为三组:溶媒组,化合物1组(iv,20mg/kg)和阳性对照组(iv,给予Etoposide,20mg/kg),每组5只。每三天给药1次,给药三周后,处死裸鼠,称瘤重,计算抑瘤率%=(溶媒组瘤重-给药组瘤重)/溶媒组瘤重×100%,结果显示化合物1组,Etoposide组抑瘤率分别为311%,59.7%。
(二)取对数生长期的KB细胞,PBS洗涤后,以0.25%胰蛋白酶孵育消化成单个细胞,用加10%血清的1640培养基终止消化后,调整细胞浓度为1.5×107/ml,裸鼠腋下皮下注射瘤液,0.2ml/只,待腋下肿瘤生长至1g后,解剖取出瘤块,剪成30mg瘤块,分别接种裸鼠腋下皮下用于实验,待肿瘤生长至100~150mg后,按肿瘤大小随机分为8组:溶媒组,化合物1三个剂量组(200mg/kg,100mg/kg,50mg/kg),化合物2三个剂量(100mg/kg,50mg/kg,25mg/kg)组和依托泊苷阳性对照组(50mg/kg),每组6只。除阳性对照组每天给药1次,连续给药7天后停药14天再连续给药7天,化合物3100mg/kg连续给药21天停药7天外,其它组每天给药1次,连续给药四周,处死裸鼠,称瘤重,计算抑瘤率%=(溶媒组瘤重-给药组瘤重)/溶媒组瘤重×100%。结果如表2,化合物3在100mg/kg,50mg/kg,剂量组抑瘤率分别为62.02%,51.61%。与空白对照比较,有显著性差异,**P<0.01。该实验表明片叶苔素D的Mannich碱衍生物2抑瘤率明显高于片叶苔素D本身。
表2化合物2对抗肿瘤体内实验
一种双联苄Mannich碱衍生物及其制备方法与应用专利购买费用说明
![]()
Q:办理专利转让的流程及所需资料
A:专利权人变更需要办理著录项目变更手续,有代理机构的,变更手续应当由代理机构办理。
1:专利变更应当使用专利局统一制作的“著录项目变更申报书”提出。
2:按规定缴纳著录项目变更手续费。
3:同时提交相关证明文件原件。
4:专利权转移的,变更后的专利权人委托新专利代理机构的,应当提交变更后的全体专利申请人签字或者盖章的委托书。
Q:专利著录项目变更费用如何缴交
A:(1)直接到国家知识产权局受理大厅收费窗口缴纳,(2)通过代办处缴纳,(3)通过邮局或者银行汇款,更多缴纳方式
Q:专利转让变更,多久能出结果
A:著录项目变更请求书递交后,一般1-2个月左右就会收到通知,国家知识产权局会下达《转让手续合格通知书》。
动态评分
0.0