专利摘要
本发明公开了一种1-O-烷基-2,3-二脱氧-2,3-二脱氢-5-O-(烷基硅基)-呋喃糖的制备方法及其在制备核苷类药物中的应用,所述1-O-烷基-2,3-二脱氧-2,3-二脱氢-5-O-(烷基硅基)-呋喃糖为式Ⅰ所示结构的化合物,其特征在于,该方法包括如下步骤:在碱性化合物存在下,将式II所示结构的糖苷化合物与磺酰化试剂进行接触,得到式Ⅰ所示结构的化合物。根据本发明的制备方法,具有步骤简单、成本低、收率高且对环境友好的优点。
权利要求
1.1-O-烷基-2,3-二脱氧-2,3-二脱氢-5-O-(烷基硅基)-呋喃糖的制备方法,所述1-O-烷基-2,3-二脱氧-2,3-二脱氢-5-O-(烷基硅基)-呋喃糖为式Ⅰ所示结构的化合物,其特征在于,该方法包括如下步骤:
在碱性化合物存在下,将式II所示结构的糖苷化合物与磺酰化试剂进行接触,得到式Ⅰ所示结构的化合物,
式Ⅰ 式II
式Ⅲ
其中,在式Ⅰ和式II中,R1为碳原子数为1-6的直链或支链烷基;R2为式Ⅲ所示的基团;
式Ⅲ中,R3、R4和R5各自选自碳原子数为1-6的直链或支链烷基或任意取代的苯基。
2.根据权利要求1所述的方法,其中,在式Ⅰ和式II中,R1为甲基、乙基、丙基、丁基、异丙基或叔丁基;R2为叔丁基二甲基硅基、三甲基硅基、三乙基硅基或叔丁基二苯基硅基。
3.根据权利要求1或2所述的方法,其中,式II所示结构的糖苷化合物、碱性化合物与磺酰化试剂的摩尔比为1:1-5:1-5。
4.根据权利要求1或2所述的方法,其中,所述接触的条件包括:接触的温度为-40~50℃,接触的时间为0.5-48小时。
5.根据权利要求1或2所述的方法,其中,所述磺酰化试剂为双咪唑磺酸、三氟甲磺酸酐、三氟乙酸酐、咪唑磺酰氯和甲磺酰氯中的一种或多种。
6.根据权利要求5所述的方法,其中,所述磺酰化试剂为双咪唑磺酸。
7.根据权利要求1或2所述的方法,其中,所述碱性化合物为1,8-二氮杂环[5,4,0]十一烯-7、甲醇钠、二乙胺、三乙胺、二异丙基胺、二异丙基乙基胺、四甲基乙二胺、吡啶、2,4,6-三甲基吡啶、咪唑、氢化钠、碳酸氢钠、碳酸钠、碳酸钾、碳酸氢钾、氢氧化钠和氢氧化钾中的一种或多种。
8.根据权利要求1所述的方法,其中,所述接触的条件包括:接触的温度为-40~50℃,接触的时间为0.5-48小时;所述磺酰化试剂为双咪唑磺酸;所述碱性化合物为氢化钠。
9.权利要求1-8中任意一项所述方法在制备核苷类药物中的应用。
10.根据权利要求9所述的应用,其中,所述核苷药物为2,3-二脱氧肌苷、2,3-二脱氧胞苷、司他夫定、依夫他滨或RVT。
说明书
技术领域
本发明涉及1-O-烷基-2,3-二脱氧-2,3-二脱氢-5-O-(烷基硅基)-呋喃糖的制备方法和应用。
背景技术
20世纪80年代开始,随着研究的不断深入,核苷类药物已成为抗艾滋病(HIV)、肝炎(HBV/HCV)、SARS(HCoV)等病毒性疾病的主流药物。
2′,3′-二脱氢-2′,3′-二脱氧及2′,3′-二脱氧核苷类药物因其具有更高的抗病毒活性和更低细胞毒性而备受关注,如抗HIV的司他夫定(Stavudine,d4T)、对HIV具有良好的抑制作用的同时又具有高效抗HBV活性的依夫他滨(Elvucitabine,β-L-Fd4C)、对拉米夫定(Lamivudine,3TC;系统命名:(2R-顺式)-4-氨基-1-(2-羟甲基-1,3-氧硫杂环戊-5-基)-1H-嘧啶-2-酮)和齐多夫定(Zidovudine,AZT;系统命名:1-(3-叠氮基-2,3-二脱氧-β-D-呋喃核糖基)胸腺嘧啶)的突变株都具有良好的抑制作用的Reverset(RVT)、治疗HIV的一线药物2′,3′-二脱氧肌苷(Didanosine,ddI)等。而此类核苷类药物均是由相同的或结构相同而构型不同的糖基部分和碱基部分组成,其生产难度和生产成本主要取决于糖基部分。传统的合成方法是先合成核苷,之后选择性对糖基部分2′,3′位脱氢脱氧,这类方法合成路线长、总收率低、成本昂贵且使用到毒性极大的化合物(如三丁基锡化合物、苯硒等),使得2′,3′-二脱氢-2′,3′-二脱氧及2′,3′-二脱氧核苷类药物的成本较高,加重患者的负担。另外,该方法不利于分子多样性合成,极大的限制了2′,3′-二脱氢-2′,3′-二脱氧及2′,3′-二脱氧核苷类药物的研发及制备。
如果以1-O-烷基(或乙酰基)-2,3-二脱氧-2,3-二脱氢呋喃糖或1-O-烷基(或乙酰基)-2,3-二脱氧呋喃糖与碱基反应,则能大大优化反应的路线,简化反应的操作,提高反应的效率且不需要使用到上述所述的毒性大的化合物,既能降低药物的成本,又能加速2′,3′-二脱氢-2′,3′-二脱氧及2′,3′-二脱氧核苷类药物的研发。但是,由于1-O-乙酰基2,3-二脱氧-2,3-二脱氢呋喃糖非常不稳定,极易生成呋喃衍生物,因此实用价值不大。而1-O-烷基-2,3-二脱氧-2,3-二脱氢呋喃糖比较稳定,使其成为2′,3′-二脱氢-2′,3′-二脱氧及2′,3′-二脱氧核苷类药物的重要合成中间体。然而,现有技术中合成1-O-烷基-2,3-二脱氧-2,3-二脱氢呋喃糖或1-O-烷基-2,3-二脱氧呋喃糖的方法较少,例如,以2-脱氧-D-核糖为原料经过碘代、消除合成1-O-烷基-2,3-二脱氧-2,3-二脱氢-5-O-(烷基硅基)-呋喃糖(化合物22)的路线:
但是,通过该路线进行合成时,存在步骤复杂、产率低、同时生成副产物硫醚21以及使用剧毒试剂碘甲烷等缺点。
因此,发展一种新的步骤简单、成本低、收率高且对环境友好的合成1-O-烷基-2,3-二脱氧-2,3-二脱氢-5-O-(烷基硅基)-呋喃糖的方法变得尤为重要。
发明内容
本发明的目的在于解决上述现有技术合成1-O-烷基-2,3-二脱氧-2,3-二脱氢-5-O-(烷基硅基)-呋喃糖时存在的步骤复杂、成本高、收率低,对环境不友好等问题,提供一种制备1-O-烷基-2,3-二脱氧-2,3-二脱氢-5-O-(烷基硅基)-呋喃糖的新的方法,该方法具有步骤简单、成本低、收率高且对环境友好的优点。
本发明的目的还在于提供上述方法在制备核苷类药物中的应用。
本发明的发明人经过深入的研究发现,通过在碱性化合物存在下,将特定的式II所示结构的糖苷化合物与磺酰化试剂进行接触,能够以简单的步骤、低成本、高收率且对环境友好地得到1-O-烷基-2,3-二脱氧-2,3-二脱氢-5-O-(烷基硅基)-呋喃糖,从而完成了本发明。
既,本发明提供一种1-O-烷基-2,3-二脱氧-2,3-二脱氢-5-O-(烷基硅基)-呋喃糖的制备方法,所述1-O-烷基-2,3-二脱氧-2,3-二脱氢-5-O-(烷基硅基)-呋喃糖的结构为式Ⅰ所示结构的化合物,其中,该方法包括如下步骤:
在碱性化合物存在下,将式II所示结构的糖苷化合物与磺酰化试剂进行接触,得到式Ⅰ所示结构的化合物,
式Ⅰ 式II
式Ⅲ
其中,在式Ⅰ和式II中,R1为碳原子数为1-6的直链或支链烷基;R2为式Ⅲ所示的基团;
式Ⅲ中,R3、R4和R5各自选自碳原子数为1-6的直链或支链烷基或任意取得的苯基。
本发明还提供上述方法在制备核苷类药物中的应用。
根据本发明的1-O-烷基-2,3-二脱氧-2,3-二脱氢-5-O-(烷基硅基)-呋喃糖的制备方法,通过使用特定的式II所示结构的糖苷化合物与磺酰化试剂简单地一步合成1-O-烷基-2,3-二脱氧-2,3-二脱氢-5-O-(烷基硅基)-呋喃糖,具有步骤简单,成本低且收率高的优点;并且在制备过程中不使用或不产生对环境不友好的化合物(例如:三丁基锡化合物、苯硒、硫醚和碘甲烷等),因此能够对环境友好地制备1-O-烷基-2,3-二脱氧-2,3-二脱氢-5-O-(烷基硅基)-呋喃糖。
附图说明
图1为实施例1制备的式(5)所示化合物的核磁共振氢谱;
图2为实施例1制备的式(5)所示化合物的核磁共振碳谱图;
图3为实施例5制备的式(6)所示化合物的核磁共振氢谱;
图4为实施例5制备的式(6)所示化合物的核磁共振碳谱图;
图5为实施例8制备的式(7)所示化合物的核磁共振氢谱;
图6为实施例8制备的式(7)所示化合物的核磁共振碳谱图;
图7为实施例9制备的2′,3′-二脱氧-2′,3′-二脱氢-5′-O-(叔丁基二甲基硅基)-α-D-核糖尿苷的核磁共振氢谱;
图8为实施例9制备的2′,3′-二脱氧-2′,3′-二脱氢-5′-O-(叔丁基二甲基硅基)-α-D-核糖尿苷的核磁共振碳谱图;
图9为实施例9制备的2′,3′-二脱氧-2′,3′-二脱氢-5′-O-(叔丁基二甲基硅基)-β-D-核糖尿苷的核磁共振氢谱;
图10为实施例9制备的2′,3′-二脱氧-2′,3′-二脱氢-5′-O-(叔丁基二甲基硅基)-β-D-核糖尿苷的核磁共振碳谱图。
具体实施方式
以下对本发明的具体实施方式进行详细说明。应当理解的是,此处所描述的具体实施方式仅用于说明和解释本发明,并不用于限制本发明。
本发明提供一种1-O-烷基-2,3-二脱氧-2,3-二脱氢-5-O-(烷基硅基)-呋喃糖的制备方法,所述1-O-烷基-2,3-二脱氧-2,3-二脱氢-5-O-(烷基硅基)-呋喃糖的结构为式Ⅰ所示结构的化合物,其中,该方法包括如下步骤:
在碱性化合物存在下,将式II所示结构的糖苷化合物与磺酰化试剂进行接触,得到式Ⅰ所示结构的化合物,
式Ⅰ 式II
式Ⅲ
其中,在式Ⅰ和式II中,R1为碳原子数为1-6的直链或支链烷基;R2为式Ⅲ所示的基团;
式Ⅲ中,R3、R4和R5各自选自碳原子数为1-6的直链或支链烷基或任意取代的苯基。
优选地,在式Ⅰ和式II中,R1为碳原子数为1-4的直链或支链烷基。作为这样的基团可以举出:甲基、乙基、丙基、异丙基、正丁基、异丁基或叔丁基。其中,优选为甲基、乙基、丙基、正丁基、异丙基或叔丁基;更优选为甲基、乙基、异丙基、叔丁基;特别优选为甲基。
优选地,在式Ⅲ中,R3、R4和R5各自选自碳原子数为1-4的直链或支链烷基或任意取代的苯基(在此,取代基可以为甲基、甲氧基、卤代基、氨基或硝基)。作为这样的基团可以举出:甲基、乙基、丙基、异丙基、正丁基、异丁基、叔丁基、苯基、对甲基苯基、对甲氧基苯基。其中,优选为甲基、乙基或叔丁基。
根据本发明,作为所述R2基团可以举出但不限于:叔丁基二甲基硅基、叔丁基甲基乙基硅基、二甲基乙基硅基、二乙基甲基硅基、三乙基硅基、叔丁基二苯基硅基、甲基二苯基硅基、乙基二苯基硅基、二甲基苯基硅基、二乙基苯基硅基、甲基乙基苯基硅基、甲基叔丁基苯基硅基、乙基叔丁基苯基硅基。其中,优选为叔丁基二甲基硅基、三甲基硅基、三乙基硅基或叔丁基二苯基硅基。
在本发明中,作为具体的所述式II所示结构的糖苷化合物可以举出1-O-甲基-5-O-三甲基硅基-2-脱氧-D-核糖、1-O-甲基-5-O-叔丁基二甲基硅基-2-脱氧-D-核糖、1-O-甲基-5-O-三乙基硅基-2-脱氧-D-核糖、1-O-甲基-5-O-叔丁基二苯基硅基-2-脱氧-D-核糖、1-O-甲基-5-O-三甲基硅基-2-脱氧-L-核糖、1-O-甲基-5-O-叔丁基二甲基硅基-2-脱氧-L-核糖、1-O-甲基-5-O-三乙基硅基-2-脱氧-L-核糖、1-O-甲基-5-O-叔丁基二苯基硅基-2-脱氧-L-核糖。1-O-甲基-5-O-三甲基硅基-2-脱氧-D-木糖、1-O-甲基-5-O-叔丁基二甲基硅基-2-脱氧-D-木糖、1-O-甲基-5-O-三乙基硅基-2-脱氧-D-木糖、1-O-甲基-5-O-叔丁基二苯基硅基-2-脱氧-D-木糖、1-O-甲基-5-O-三甲基硅基-2-脱氧-L-木糖、1-O-甲基-5-O-叔丁基二甲基硅基-2-脱氧-L-木糖、1-O-甲基-5-O-三乙基硅基-2-脱氧-L-木糖、1-O-甲基-5-O-叔丁基二苯基硅基-2-脱氧-L-木糖。作为具体的所述式II所示结构的糖苷化合物优选为R1为甲基,叔丁基,R2为叔丁基二甲基硅基、三甲基硅基、叔丁基二苯基硅基的化合物。
对于所述式II所示结构的糖苷化合物可以通过本领域所公知的各种方法来制备。例如可以以2-脱氧-D(L)-核糖、2-脱氧-D(L)-木糖为原料,选择适当的保护基团对1位的羟基以及5位的羟基进行保护,来得到所述式II所示结构的糖苷化合物。对上述羟基进行保护的方法可以采用本领域所公知的方法,例如B.Chem.Soc.Jpn,1989,62,845-852中记载的方法。
根据本发明,所述碱性化合物可以为本领域所常用的各种有机碱或无机碱。优选情况下,所述碱性化合物为1,8-二氮杂环[5,4,0]十一烯-7、甲醇钠、二乙胺、三乙胺、二异丙基胺、二异丙基乙基胺、四甲基乙二胺、吡啶、2,4,6-三甲基吡啶、咪唑、氢化钠,碳酸氢钠、碳酸钠、碳酸钾、碳酸氢钾、氢氧化钠和氢氧化钾中的一种或多种;更优选所述碱性化合物为氢化钠、1,8-二氮杂环[5,4,0]十一烯-7和甲醇钠中的一种或多种。
根据本发明,所述式II所示结构的糖苷化合物、碱性化合物与磺酰化试剂的摩尔比可以在宽的范围内变动,但优选为1:1-5:1-5。从成本上以及产率、反应时间上来考虑,更优选为1:1-3:1-3;进一步优选为1:1.5-3:1.5-3。
此外,对所述接触的条件没有特别的限定,可以采用本领域的常规条件。但优选情况下,所述接触的条件包括:接触的温度为-40~50℃,接触的时间为0.5-48小时;更优选所述接触的条件包括:接触的温度为-20~40℃,接触的时间为0.5-12小时。
优选情况下,所述接触在惰性气体氛围下进行,所述惰性气体可以为本领域所常用的各种惰性气体。优选为氮气或氩气。
根据本发明,所述接触在溶剂存在下进行,所述溶液可以本领域所常用的各种能够溶解反应物且几乎不与反应物及反应产物反应的有机溶液。优选情况下,所述有机溶剂为二氯甲烷、二甲基甲酰胺、四氢呋喃和乙腈中的一种或多种。更优选上述溶剂为无水溶剂。
根据本发明,所述磺酰化试剂可以为双咪唑磺酸、三氟甲磺酸酐、三氟乙酸酐、双咪唑磺酸、咪唑磺酰氯和甲磺酰氯中的一种或多种;优选为双咪唑磺酸和咪唑磺酰氯。
并且,本发明的发明人意外的发现,在本发明中,当所述磺酰化试剂为双咪唑磺酸时,能够进一步显著地提高式Ⅰ所示结构的化合物的产率。因此,在本发明中,特别优选所述磺酰化试剂为双咪唑磺酸。
在此,作为本发明的一个特别的优选方式为:所述式II所示结构的糖苷化合物为R1为甲基,R2为叔丁基二甲基硅基,所述接触的条件包括:接触的温度为-40~50℃,接触的时间为0.5-48小时,所述磺酰化试剂为双咪唑磺酸,所述碱性化合物为DBU或氢化钠。通过该优选方式能够显著地提高式Ⅰ所示结构的化合物的产率。
根据本发明,在将式II所示结构的糖苷化合物与磺酰化试剂进行接触后,可通过本领域的常规方法对接触后的产物进行纯化,来得到式Ⅰ所示结构的化合物。所述纯化的方法可以根据具体情况来选择。例如可以通过在接触后的产物中加入水和有机溶剂进行萃取得到含有式Ⅰ所示结构的化合物的有机相,然后将有机相进行浓缩后通过柱层析得到式Ⅰ所示结构的化合物。
本发明还提供上述方法在制备核苷类药物中的应用。
根据本发明,所述核苷为2′,3′-二脱氧核苷及2′,3′-二脱氧-2′,3′-二脱氢核苷。作为这样的核苷可举出2,3-二脱氧肌苷、2,3-二脱氧胞苷、司他夫定、依夫他滨或RVT(Reverset)。
本发明还包括采用上述的方法制备1-O-烷基-2,3-二脱氧-2,3-二脱氢-5-O-(烷基硅基)-呋喃糖,再将1-O-烷基-2,3-二脱氧-2,3-二脱氢-5-O-(烷基硅基)-呋喃糖进行氢化,或者与碱基进行连接。
根据本发明所述氢化以及与碱基连接的方法可以采用本领域所常用的各种方法。
以下将通过实施例对本发明进行详细描述,但本发明并不仅限于下述实施例。
制备例1
(1) (2)
向盛有无水甲醇(200ml)的500ml单口瓶内加入2-脱氧-D-核糖(式(2)、20g),冰浴搅拌至溶解,滴加新制备的甲醇酸性溶液(制备方法:冰浴条件下向无水甲醇(40ml)中滴加乙酰氯(0.71ml))。冰浴反应80min结束。反应完成后加入NaHCO3固体中和至反应液弱碱性,过滤,浓缩得淡黄色油状物22.9g。将油状物置于250ml单口瓶内,依次加入干燥DMF(100ml),干燥三乙胺(35.5ml,0.254mol),TBSCl(31.6g,0.21mmol),冰浴搅拌反应4h后,向反应液加入少量水,乙醚萃取(25ml×4),乙醚层水洗一次,无水MgSO4干燥,真空浓缩后柱层析纯化(PE:EA=6:1)得淡黄色油状物25g(纯度为95重量%,经核磁确定为式(2)所示化合物),两步总产率为64%。
制备例2
(3) (4)
向盛有无水甲醇(200ml)的500ml单口瓶内加入2-脱氧-L-核糖(式(3)、20g),冰浴搅拌至溶解,滴加新制备的甲醇酸性溶液(制备方法:冰浴条件下向无水甲醇(40ml)中滴加乙酰氯(0.71ml))。冰浴反应80min结束。反应完成后加入NaHCO3固体中和至反应液弱碱性,过滤,浓缩得淡黄色油状物23.96g。取淡黄色油状物(23g)置于250ml单口瓶内,依次加入干燥DMF(210ml),干燥三乙胺(35.2ml,0.25mol),TBSCl(31.5g,0.208mol),常温反应过夜,反应完成后向反应液加入少量水,乙醚萃取(100ml×4),乙醚层水洗一次,无水MgSO4干燥,真空浓缩后柱层析纯化(PE:EA=10:1)得淡黄色油状物29.01g(纯度为96重量%,经核磁确定为式(4)所示化合物),两步总产率为74%。
实施例1
(2) (5)
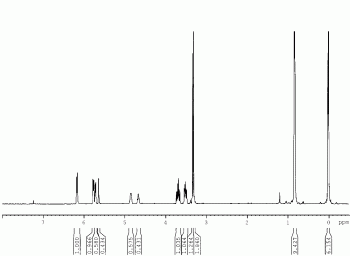
冰浴下将溶解有式(2)化合物(1g,3.82mmol)的干燥DMF溶液(15ml)滴加至氩气保护的装有NaH(60重量%,458mg,11.46mmol)的两口瓶中,0℃搅拌30min后滴加溶解有双咪唑磺酸(1.512g,11.4mmol)的干燥DMF(10ml)溶液,继续反应2h,25℃再反应12h。反应完成后加入水(10ml),乙醚萃取(50ml×4),乙醚层水洗一次,无水MgSO4干燥,真空浓缩后柱层析纯化(PE:EA=80:1)得淡黄色色油状物323mg(纯度为99重量%),产率为70%。经核磁及红外确定为式(5)所示化合物,其核磁及红外光谱数据如下(核磁图谱参见图1、图2)。
IR(cm-1)2954(s),2930(s),2890(s),1620(w),1473(m),1374(m),1230(m),1212(m),1119(s),1096(m),1050(s),967(m),840(s),811(m),778(s)。
1H NMR(300MHz,CDCl3)δ6.24–6.22(m,1H),5.84–5.82(m,1H),5.78–5.77(m,0.6H),5.70–5.69(m,0.4H),4.91–4.90(m,0.6H),4.74–4.70(m,0.4H),3.79–3.71(m,1H),3.60–3.54(m,1H),3.40(s,1H),3.38–3.33(m,2H),0.90–0.89(m,9H),0.08–0.06(m,6H)ppm。
13C NMR(75MHz,CDCl3)δ134.1,133.8,127.3,127.1,109.6,109.4,86.3,86.2,67.1,65.8,54.7,54.0,26.0,18.4,-5.1,-5.2,-5.2ppm。
实施例2
(2) (5)
冰浴下将溶解有式(2)化合物(0.6g,2.29mmol)的干燥DMF溶液(15ml)滴加至氩气保护的装有NaH(60重量%,137mg,3.44mmol)的两口瓶中,0℃搅拌30min后滴加溶解有双咪唑磺酸(0.454g,3.42mmol)的干燥DMF(10ml)溶液,继续反应2h,25℃再反应12h。反应完成后加入水(10ml),乙醚萃取(50ml×4),乙醚层水洗一次,无水MgSO4干燥,真空浓缩后柱层析纯化(PE:EA=80:1)得淡黄色色油状物212mg(纯度为98重量%),产率为68%。经核磁及红外确定为式(5)所示化合物。
实施例3
(2) (5)
冰浴下将溶解有式(2)化合物(0.5g,1.91mmol)的干燥DMF溶液(15ml)滴加至氩气保护的装有NaH(60重量%,382mg,9.55mmol)的两口瓶中,0℃搅拌30min后滴加溶有双咪唑磺酸(1.26g,9.5mmol)的干燥DMF(10ml)溶液,继续反应2h,25℃再反应12h。反应完成后加入水(10ml),乙醚萃取(50ml×4),乙醚层水洗一次,无水MgSO4干燥,真空浓缩后柱层析纯化(PE:EA=80:1)得淡黄色色油状物314mg(纯度为98重量%),产率为68%。
经核磁及红外确定为式(5)所示化合物。
实施例4
(2) (5)
将干燥吡啶(0.76ml)的二氯甲烷溶液(20ml)置于-15℃低温冷浴中,氩气保护,搅拌5min后逐滴加入Tf2O(1.3ml,7.6mmol),15min后逐滴加入式(2)化合物(1g,3.8mmol)的二氯甲烷溶液(5ml),继续反应40min后加入二氯甲烷稀释,水洗三次,二氯甲烷萃取,无水MgSO4干燥,35℃真空浓缩后溶于甲醇(6ml),逐滴甲醇钠(2ml,1N),氩气保护,常温反应2.5h,反应完成后加入水(10ml),35℃真空浓缩除去甲醇,加入二氯甲(100ml),水洗三次,二氯甲烷萃取,有机层无水MgSO4干燥,35℃真空浓缩后柱层析纯化(PE:EA=80:1)得淡黄色油状物204mg(纯度为98%重量%),产率为22%。
经核磁及红外确定为式(5)所示化合物。
实施例5
(4) (6)
冰浴下将溶解有式(4)化合物(500mg,1.91mmol)的干燥DMF溶液(15ml)滴加至氩气保护的装有NaH(60重量%,229mg,5.73mmol)的两口瓶中,0℃搅拌30min后滴加溶解有双咪唑磺酸(0.756g,5.7mmol)的干燥DMF(10ml)溶液,继续反应2h,25℃再反应12h。反应完成后加入水(10ml),乙醚萃取(50ml×4),乙醚层水洗一次,无水MgSO4干燥,真空浓缩后柱层析纯化(PE:EA=80:1)得淡黄色色油状物328mg(纯度为98重量%),产率为71%。经核磁及红外确定为式(6)所示化合物,其核磁及红外光谱数据如下(核磁图谱参见图3、图4)。
IR(cm-1):2954(s),2929(s),2887(s),2858(s),1625(w),1472(m),1373(m),1225(m),1212(m),1119(s),1095(m),1055(s),967(m),839(s),811(m),778(s)。
1H NMR(300MHz,CDCl3)δ6.24–6.22(m,1H),5.84–5.82(m,1H),5.78–5.77(m,0.6H),5.70–5.69(m,0.4H),4.91–4.90(m,0.6H),4.74–4.70(m,0.4H),3.79–3.71(m,1H),3.60–3.54(m,1H),3.40(s,1H),3.38–3.33(m,2H),0.90–0.89(m,9H),0.08–0.06(m,6H)ppm。
13C NMR(75MHz,CDCl3)δ134.1,133.8,127.3,127.1,109.6,109.4,86.3,86.2,67.1,65.8,54.7,54.0,26.0,18.4,-5.2,-5.2ppm。
实施例6
按照实施例5的方法进行,不同的是将双咪唑磺酸替换为三氟乙酸酐,得到淡黄色油状物100mg(纯度为98重量%),产率为21.6%。
经核磁及红外确定为式(6)所示化合物。
实施例7
将式(2)化合物(500mg,1.9mmol)溶解于干燥二氯甲烷(50ml)中,冰浴,依次加入干燥三乙胺(0.53ml,3.8mmol),甲基磺酰氯(0.24ml,2.85mmol),加料完毕后冰浴反应30min,然后常温反应,TLC显示反应完成后水洗三次,二氯甲烷萃取,有机相经无水MgSO4干燥后真空浓缩。将浓缩物溶于甲醇(10ml)中,逐滴甲醇钠(2ml,1N),氩气保护,常温反应3天。反应完成后加入水(10ml),35℃真空浓缩除去甲醇,加入二氯甲烷(100ml),水洗三次,二氯甲烷萃取,有机相无水MgSO4干燥,真空浓缩后柱层析纯化(PE:EA=80:1)得淡黄色油状物69mg(纯度为98重量%),产率为15%。经核磁及红外确定为式(5)所示化合物。
实施例8
(6) (7)
将式(6)所述化合物(200mg,0.82mmol)加入到25mL单口瓶中,加入甲醇(10mL),10%Pd/C(20mg),氢气氛中常温反应2h,反应完成后过滤掉Pd/C,滤液浓缩得无色油状物180mg,产率89%。
经核磁及红外确定为式(7)所示化合物,其核磁及红外光谱数据如下(核磁图谱参见图5、图6)。
IR(cm-1):2954(s),2928(s),2857(m),1463(m),1361(w),1254(m),1205(m),1098(s),1049(s),1005(w),838(s),776(m)。
1H NMR(300MHz,CDCl3)δ5.03–5.02(m,0.5H),4.98–4.97(m,0.5H),4.19–4.09(m,1H),3.70(dd,J=6,9Hz0.5H),3.63–3.60(m,1H),3.56(dd,J=6,9Hz0.5H),3.34(s,1.5H),3.32(s,1.5H),2.07–1.66(m,4H),0.90(s,4.5H),0.89(s,4.5H),0.07–0.06(m,6H)ppm。
13C NMR(75MHz,CDCl3)δ105.7,105.4,81.2,78.9,67.6,65.7,54.8,54.7,33.0,32.2,26.5,26.2,25.6,18.6,-5.0,-5.1ppm。
实施例9
(5) (8) (9) (10)
取100ml三口瓶,氩气保护后加入干燥乙腈(10ml)、三甲基硅基活化的尿嘧啶(式(8),1mmol)的乙腈溶液(1ml),-30℃滴加式(5)所示化合物(138mg,.57mmol)的乙腈溶液(5ml),10min后滴加TMSOTf(0.1ml)的乙腈溶液(5ml,分两次加入,间隔时间30min),继续反应,总时间为3h。反应完成后加入二氯甲烷稀释,反应液倒入饱和NaHCO3溶液(50ml)中,水相用二氯甲烷萃取三次,有机相再水洗至中性,有机层无水MgSO4干燥,真空浓缩后柱层析纯化(PE:EA=2:1),得到白色固体25mg(经核磁确定为式(9)所示化合物),产率为17%;白色固体28mg(经核磁确定为式(10)所示化合物),产率为18%。
2′,3′-二脱氧-2′,3′-二脱氢-5′-O-(叔丁基二甲基硅基)-α-D-核糖尿苷
1H NMR(300MHz,CDCl3)δ9.63(m,1H),7.28–7.11(m,1H),7.03–7.01(m,1H),6.40–6.37(m,1H),5.90(dd,J=1.5,6Hz1H),5.74(d,J=8.1Hz1H),5.09–5.05(m,1H),3.80–3.75(m,1H),3.68–3.62(m,1H),0.90-0.89(m,9H),0.07(s,6H)ppm。
13C NMR(75MHz,CDCl3)δ163.7,150.9,139.8,135.2,126.3,103.1,90.8,87.9,65.3,26.0,18.5,-5.2ppm.
2’,3’-二脱氧-2’,3’-二脱氢-5’-O-(叔丁基二甲基硅基)-β-D-核糖尿苷:
1H NMR(300MHz,CDCl3)δ9.36(m,1H),7.88–7.85(d,J=9Hz1H),7.03–7.02(m,1H),6.25(dd,J=1.5,6Hz1H),5.84(d,J=3Hz1H),5.68(d,J=7.1Hz1H),4.90(m,1H),3.96–3.82(m,2H),0.90(s,9H),0.08(s,6H)ppm。
13C NMR(75MHz,CDCl3)δ163.8,151.0,141.3,134.5,126.8,102.6,89.9,87.5,64.4,26.1,18.7,-5.2,-5.3ppm。
以上详细描述了本发明的优选实施方式,但是,本发明并不限于上述实施方式中的具体细节,在本发明的技术构思范围内,可以对本发明的技术方案进行多种简单变型,这些简单变型均属于本发明的保护范围。另外需要说明的是,在上述具体实施方式中所描述的各个具体技术特征,在不矛盾的情况下,可以通过任何合适的方式进行组合,为了避免不必要的重复,本发明对各种可能的组合方式不再另行说明。
此外,本发明的各种不同的实施方式之间也可以进行任意组合,只要其不违背本发明的思想,其同样应当视为本发明所公开的内容。
1-O-烷基专利购买费用说明
![]()
Q:办理专利转让的流程及所需资料
A:专利权人变更需要办理著录项目变更手续,有代理机构的,变更手续应当由代理机构办理。
1:专利变更应当使用专利局统一制作的“著录项目变更申报书”提出。
2:按规定缴纳著录项目变更手续费。
3:同时提交相关证明文件原件。
4:专利权转移的,变更后的专利权人委托新专利代理机构的,应当提交变更后的全体专利申请人签字或者盖章的委托书。
Q:专利著录项目变更费用如何缴交
A:(1)直接到国家知识产权局受理大厅收费窗口缴纳,(2)通过代办处缴纳,(3)通过邮局或者银行汇款,更多缴纳方式
Q:专利转让变更,多久能出结果
A:著录项目变更请求书递交后,一般1-2个月左右就会收到通知,国家知识产权局会下达《转让手续合格通知书》。
动态评分
0.0