IPC分类号 : C12N15/113,A61K31/712,A61K31/7125,C07H21/00
专利摘要
本发明涉及反义寡核苷酸和相关的组合物以及用于诱导的外显子纳入作为治疗II型糖原贮积病(GSD‑II)(也称为庞帕病、II型糖原病、酸麦芽糖酶缺乏(AMD)、酸性α‑葡糖苷酶缺乏,和溶酶体α‑葡糖苷酶缺乏)的方法,并且更具体地涉及诱导外显子2的纳入并由此恢复由GAA基因编码的酶促活性酸性α‑葡糖苷酶(GAA)蛋白的水平。
权利要求
1.10-40个核苷酸或核苷酸类似物的反义寡聚体化合物,所述化合物包含:
非天然化学主链,其选自氨基磷酸酯或磷二酰胺吗啉代寡聚体(PMO)、肽核酸(PNA)、锁核酸(LNA)、硫代磷酸酯寡聚体、三环-DNA寡聚体、三环-硫代磷酸酯寡聚体、2’O-Me-硫代磷酸酯寡聚体,或前述的任意组合;和
与人酸性α-葡糖苷酶(GAA)基因的前体mRNA的内含子1(SEQIDNO:1)、内含子2(SEQIDNO:2)、或外显子2(SEQIDNO:3)内的区互补的靶向序列。
2.如权利要求1所述的化合物,其特征在于,所述靶向序列选自SEQIDNO:4-120,其中X选自尿嘧啶(U)或胸腺嘧啶(T)。
3.一种式(I)的化合物:
或其药学上可接受的盐,其中:
各Nu是核碱基,其一起形成靶向序列;
x是8-38的整数;
各Y独立地选自O或-NRa,其中Ra选自氢、-T1-NRcRdRe和-[(C(O)CHR′NH)m]R″,其中:
R′是天然产生的氨基酸或其一个或两个碳的同系物的侧链,
R″选自氢或酰基,
m是1-60的整数,
Rc选自氢、C1-C6烷基、芳烷基和-C(=NH)NH2,
Rd选自氢、芳烷基和C1-C6烷基,或者
当RC和Rd各自独立地是C1-C6烷基或芳烷基时,Rc和Rd与其附连的氮原子一起形成5-7元环,其中所述环任选地被选自C1-C6烷基、苯基、卤素和芳烷基的取代基取代,并且
Re选自电子对、氢、C1-C6烷基和芳烷基;
各L独立地选自-P(O)2OH-、-P(O)2R1-、-P(O)2(N(CH3)3-N(CH3)CH2C(O)NH2、哌嗪基、羰基、H(O(CH2)sO)w-、-(OCH2CH2O)w和-[(C(O)CHR′NH)m]R",其中w是3-20的整数,并且S是1-8的整数;
n是0-3的整数;
各R1独立地选自-N(CH3)2、-NR5R6、-OR7、
式(II)的部分:
其中:
R8选自氢、甲基、-C(=NH)NH2、-Z-T2-NHC(=NH)NH2和-[(C(O)CHR′NH)m]R″,其中Z是羰基或直接键,
R9选自电子对、氢、C1-C6烷基和芳烷基;
各R10独立地选自氢或甲基;和
式(III)的部分:
其中:
q是0-2的整数,
R11选自氢、C1-C6烷基、芳烷基和-C(=NH)NH2,
R12选自氢、芳烷基和C1-C6烷基,或者
R11和R12与其附连的氮原子一起形成5-7元环,其中所述环任选地被选自C1-C6烷基、苯基、卤素和芳烷基的取代基取代,并且
R13选自电子对、氢、C1-C6烷基和芳烷基;
R2选自氢、OH、核苷酸、-(CH2)mC(O)NRfRg,其中Rf和Rg独立地选自H、酰基、C1-C6烷基、和-[(C(O)CHR′NH)m]R″、-[(C(O)CHR′NH)m]R″、H(O(CH2)sO)w-、H(OCH2CH2O)w-、三苯甲基、-C(=O)ORf和酰基,其中Rf是C1-C30烷基,其包含一个或多个氧或羟基部分或其组合,或R2不存在;
R3选自氢、C1-C6烷基、核苷酸、-[(C(O)CHR′NH)m]R″、-C(=NH)NH2、三苯甲基、-C(=O)ORg、酰基、-C(O)(CH2)mC(O)和T4-(4-(4,6-(NR2)-1,3,5-三嗪-2-基)哌嗪-1-基,其中
Rg是包含一个或多个氧或羟基部分或其组合的C1-C30烷基,
T4选自-C(O)(CH2)6C(O)-或-C(O)(CH2)2S2(CH2)2C(O)-,并且
R是-(CH2)OC(O)NH(CH2)6NHC(NH)NH2;
R4选自电子对、氢、C1-C6烷基和酰基,并且
各R5独立地选自氢或甲基;
各R6和各R7独立地选自氢或-T3-NRcRdRe;并且
各T1、T2、和T3独立地是长度至多为18个原子的任选接头,包括烷基、烷氧基或烷氨基,或其组合,
其中,所述靶向序列与人酸性α-葡糖苷酶(GAA)基因的前体mRNA的内含子1(SEQIDNO:1)、内含子2(SEQIDNO:2)或外显子2(SEQIDNO:3)内的区互补。
4.如权利要求3所述的化合物,其特征在于,各Nu独立地选自腺嘌呤、鸟嘌呤、胸腺嘧啶、尿嘧啶、胞嘧啶、次黄嘌呤、2,6-二氨基嘌呤、5-甲基胞嘧啶、C5-丙炔基-修饰的嘧啶,和9-(氨基乙氧基)吩噁嗪。
5.如权利要求3所述的化合物,其特征在于,各R1是-N(CH3)2。
6.如权利要求5所述的化合物,其特征在于,所述靶向序列选自SEQIDNO:4-120,其中X选自尿嘧啶(U)或胸腺嘧啶(T)。
7.如权利要求3所述的化合物,其特征在于,所述至少一个R1选自下组:
8.如权利要求3所述的化合物,其特征在于,50-90%的所述R1基团是-N(CH2)3。
9.如权利要求3所述的化合物,其特征在于,66%的所述R1基团是-N(CH2)3。
10.如权利要求3所述的化合物,其特征在于:
n是2;
R2和L一起是下式:
以及
每次出现的Y是O。
11.一种式(IV)的化合物:
或其药学上可接受的盐,其中:
各Nu是核碱基,其一起形成靶向序列;
x是15-25的整数;
各Y是O;
各R1独立地选自下组:
其中,至少一个R1是-N(CH3)2,并且
其中,所述靶向序列选自SEQIDNO:4-120,其中X选自尿嘧啶(U)或胸腺嘧啶(T)。
12.一种药物组合物,其包含10-40个核苷酸或核苷酸类似物的反义寡聚体化合物和药学上可接受的运载体,所述化合物包含:
非天然化学主链,其选自氨基磷酸酯或磷二酰胺吗啉代寡聚体(PMO)、肽核酸(PNA)、锁核酸(LNA)、硫代磷酸酯寡聚体、三环-DNA寡聚体、三环-硫代磷酸酯寡聚体、2’O-Me-硫代磷酸酯寡聚体,或前述的任意组合;和
与人酸性α-葡糖苷酶(GAA)基因的前体mRNA的内含子1(SEQIDNO:1)、内含子2(SEQIDNO:2)或外显子2(SEQIDNO:3)内的区互补的靶向序列。
13.如权利要求12所述的药物组合物,其特征在于,所述靶向序列选自SEQIDNO:4-120,其中X选自尿嘧啶(U)或胸腺嘧啶(T)。
14.一种药物组合物,其包含式(I)的化合物:
或其药学上可接受的盐,其中:
各Nu是核碱基,其一起形成靶向序列;
x是8-38的整数;
各Y独立地选自O或-NRa,其中Ra选自氢、-T1-NRcRdRe和-[(C(O)CHR′NH)m]R″,其中:
R′是天然产生的氨基酸或其一个或两个碳的同系物的侧链,
R″选自氢或酰基,
m是1-60的整数,
Rc选自氢、C1-C6烷基、芳烷基和-C(=NH)NH2,
Rd选自氢、芳烷基和C1-C6烷基,或者
当Rc和Rd各自独立地是C1-C6烷基或芳烷基时,Rc和Rd与其附连的氮原子一起形成5-7元环,其中所述环任选地被选自C1-C6烷基、苯基、卤素和芳烷基的取代基取代,并且
Re选自电子对、氢、C1-C6烷基和芳烷基;
各L独立地选自-P(O)2OH-、-P(O)2R1-、-P(O)2(N(CH3)3-N(CH3)CH2C(O)NH2、哌嗪基、羰基、H(O(CH2)sO)w-、-(OCH2CH2O)w和-[(C(O)CHR′NH)m]R″,其中w是3-20的整数,S是1-8的整数;
n是0-3的整数;
各R1独立地选自-N(CH3)2、-NR5R6、-OR7,
式(II)的部分:
其中:
R8选自氢、甲基、-C(=NH)NH2、-Z-T2-NHC(=NH)NH2和-[(C(O)CHR′NH)m]R″,其中Z是羰基或直接键,并且
R9选自电子对、氢、C1-C6烷基和芳烷基;
各R10独立地选自氢或甲基;和
式(III)的部分:
其中:
q是0-2的整数;
R11选自氢、C1-C6烷基、芳烷基和-C(=NH)NH2,
R12选自氢、芳烷基和C1-C6烷基,或者
R11和R12与其附连的氮原子一起形成5-7元环,其中所述环任选地被选自C1-C6烷基、苯基、卤素和芳烷基的取代基取代;并且
R13选自电子对、氢、C1-C6烷基和芳烷基;
R2选自氢、OH、核苷酸、-(CH2)mC(O)NRfRg,其中Rf和Rg独立地选自H、酰基、C1-C6烷基和-[(C(O)CHR′NH)m]R″、-[(C(O)CHR′NH)m]R″、H(O(CH2)sO)w-、H(OCH2CH2O)w-、三苯甲基、-C(=O)ORf和酰基,其中Rf是C1-C30烷基,其包含一个或多个氧或羟基部分或其组合,或R2不存在;
R3选自氢、C1-C6烷基、核苷酸、-[(C(O)CHR′NH)m]R″、-C(=NH)NH2、三苯甲基、-C(=O)ORg、酰基、-C(O)(CH2)mC(O)和T4-(4-(4,6-(NR2)-1,3,5-三嗪-2-基)哌嗪-1-基,其中
Rg是包含一个或多个氧或羟基部分或其组合的C1-C30烷基;
T4选自-C(O)(CH2)6C(O)-或-C(O)(CH2)2S2(CH2)2C(O)-;并且
R是-(CH2)OC(O)NH(CH2)6NHC(NH)NH2;
R4选自电子对、氢、C1-C6烷基和酰基,并且
各R5独立地选自氢或甲基;
各R6和各R7独立地选自氢或-T3-NRcRdRe;并且
各T1、T2、和T3独立地是长度至多为18个原子的任选接头,包括烷基、烷氧基或烷氨基,或其组合;
其中,所述靶向序列与人酸性α-葡糖苷酶(GAA)基因的前体mRNA的内含子1(SEQIDNO:1)、内含子2(SEQIDNO:2),或外显子2(SEQIDNO:3)内的区互补,和
药学上可接受的运载体。
15.如权利要求14所述的药物组合物,其特征在于,各R1是-N(CH3)2。
16.如权利要求15所述的药物组合物,其特征在于,所述靶向序列选自SEQIDNO:4-120,其中X选自尿嘧啶(U)或胸腺嘧啶(T)。
17.如权利要求14所述的药物组合物,其特征在于:
n是2;
R2和L一起是下式:
以及
每次出现的Y是O。
18.一种治疗有此需要的对象中的II型糖原贮积病的方法,包括向所述对象给予有效量的10-40个核苷酸或核苷酸类似物的反义寡聚体化合物,所述化合物包含:
非天然化学主链,其选自氨基磷酸酯或磷二酰胺吗啉代寡聚体(PMO)、肽核酸(PNA)、锁核酸(LNA)、硫代磷酸酯寡聚体、三环-DNA寡聚体、三环-硫代磷酸酯寡聚体、2’O-Me-硫代磷酸酯寡聚体,或前述的任意组合;和
与人酸性α-葡糖苷酶(GAA)基因的前体mRNA的内含子1(SEQIDNO:1)、内含子2(SEQIDNO:2),或外显子2(SEQIDNO:3)内的区互补的靶向序列。
19.如权利要求18所述的方法,其特征在于,所述靶向序列选自SEQIDNO:4-120,其中X选自尿嘧啶(U)或胸腺嘧啶(T)。
20.一种治疗有此需要的对象中的II型糖原贮积病的方法,包括向所述对象给予有效量的式(I)的反义寡聚体化合物:
或其药学上可接受的盐,其中:
各Nu是核碱基,其一起形成靶向序列;
x是8-38的整数;
各Y独立地选自O或-NRa,其中Ra选自氢、-T1-NRcRdRe和-[(C(O)CHR′NH)m]R″,其中:
R′是天然产生的氨基酸或其一个或两个碳的同系物的侧链,
R″选自氢或酰基,
m是1-60的整数,
Rc选自氢、C1-C6烷基、芳烷基和-C(=NH)NH2,
Rd选自氢、芳烷基和C1-C6烷基,或者
当Rc和Rd各自独立地是C1-C6烷基或芳烷基时Rc和Rd与其附连的氮原子一起形成5-7元环,其中所述环任选地被选自C1-C6烷基、苯基、卤素和芳烷基的取代基取代,并且
Re选自电子对、氢、C1-C6烷基和芳烷基;
各L独立地选自-P(O)2OH-、-P(O)2R1-、-P(O)2(N(CH3)3-N(CH3)CH2C(O)NH2、哌嗪基、羰基、H(O(CH2)sO)w-、-(OCH2CH2O)w和-[(C(O)CHR′NH)m]R″;
n是0-3的整数;
各R1独立地选自-N(CH3)2、-NR5R6、-OR7,
式(II)的部分:
其中:
R8选自氢、甲基、-C(=NH)NH2、-Z-T2-NHC(=NH)NH2和-[(C(O)CHR′NH)m]R″,其中Z是羰基或直接键,并且
R9选自电子对、氢、C1-C6烷基和芳烷基;
各R10独立地选自氢或甲基;和
式(III)的部分:
其中:
q是0-2的整数;
R11选自氢、C1-C6烷基、芳烷基和-C(=NH)NH2,
R12选自氢、芳烷基和C1-C6烷基,或者
R11和R12与其附连的氮原子一起形成5-7元环,其中所述环任选地被选自C1-C6烷基、苯基、卤素和芳烷基的取代基取代;并且
R13选自电子对、氢、C1-C6烷基和芳烷基;
R2选自OH、寡聚体、-(CH2)mC(O)NRfRg,其中Rf和Rg独立地选自H、酰基、C1-C6烷基、和-[(C(O)CHR′NH)m]R″、-[(C(O)CHR′NH)m]R″、H(O(CH2)sO)w-、H(OCH2CH2O)w-、三苯甲基、-C(=O)ORf和酰基,其中w是3-20的整数,其中Rf是C1-C30烷基,其包含一个或多个氧或羟基部分或其组合,或R1不存在;
R2选自氢、C1-C6烷基、寡聚体、-[(C(O)CHR′NH)m]R″、-C(=NH)NH2、三苯甲基、-C(=O)ORg、酰基、-C(O)(CH2)mC(O)和T4-(4-(4,6-(NR2)-1,3,5-三嗪-2-基)哌嗪-1-基,其中
Rg是包含一个或多个氧或羟基部分或其组合的C1-C30烷基,
T4选自-C(O)(CH2)6C(O)-或-C(O)(CH2)2S2(CH2)2C(O)-,并且
R是-(CH2)OC(O)NH(CH2)6NHC(NH)NH2;
R4选自电子对、氢、C1-C6烷基和酰基,并且
各R5独立地选自氢或甲基;
各R6和各R7独立地选自氢或-T3-NRcRdRe;并且
各T1、T2、和T3独立地是长度至多为18个原子的任选接头,包括烷基、烷氧基或烷氨基,或其组合,
其中,所述靶向序列与人酸性α-葡糖苷酶(GAA)基因的前体mRNA的内含子1(SEQIDNO:1)、内含子2(SEQIDNO:2)或外显子2(SEQIDNO:3)内的区互补。
21.如权利要求20所述的方法,其特征在于,各R1是-N(CH3)2。
22.如权利要求21所述的方法,其特征在于,所述靶向序列选自SEQIDNO:4-120,其中X选自尿嘧啶(U)或胸腺嘧啶(T)。
23.如权利要求20所述的方法,其中:
n是2;
R2和L一起是下式:
以及
每次出现的Y是O。
24.一种反义寡聚体,其包含具有足够的长度和互补性以特异性杂交人酸性α-葡糖苷酶(GAA)基因的前体mRNA的内含子1(SEQIDNO:1)、外显子2(SEQIDNO:2)或内含子2(SEQIDNO:3)内的区的靶向序列。
25.如权利要求24所述的反义寡聚体,其特征在于,所述靶向序列包含选自SEQIDNO:4-120的靶向序列的至少10个连续核苷酸,其中X选自尿嘧啶(U)或胸腺嘧啶(T)。
26.如权利要求24所述的反义寡聚体,其特征在于,所述靶向序列与选自SEQIDNO:4-120的靶向序列有80%序列相同性,其中X选自尿嘧啶(U)或胸腺嘧啶(T)。
说明书
相关申请的交叉引用
本申请根据35U.S.C.§119(e)要求2013年9月5日提交的美国申请号61/874,261和2014年1月27日提交的美国申请号61/932,195的优先权;其全文各自通过引用纳入本文。
关于序列表的声明
与本申请相关的序列表以文本形式代替纸质版提供,并且因此通过引用纳入说明书。包含序列表的文本文件的名称为SATH_001_02WO_ST25.txt。该文本文件为约62KB,其在2014年9月5日生成,并且通过EFS-Web电子提交。
背景
发明领域
本发明涉及反义寡聚体和相关的组合物以及用于诱导的外显子纳入作为对II型糖原贮积病(GSD-II)(也称为庞帕病、II型糖原病、酸麦芽糖酶缺乏(AMD)、酸性α-葡糖苷酶缺乏和溶酶体α-葡糖苷酶缺乏)的治疗的方法,并且更具体地涉及诱导外显子2的纳入并由此恢复由GAA基因编码的酶促活性酸性α-葡糖苷酶(GAA)蛋白的水平。
相关领域描述
可变剪接通过从单一基因产生多个蛋白质增加了人基因组的编码潜力。不合适的可变剪接也与不断增加的人类疾病相关。
GSD-II是一种由称为酸性α-葡糖苷酶(GAA)的酶的缺乏所导致的遗传常染色体隐性溶酶体贮积症。GAA在体内的作用是降解糖原。GAA活性水平的降低或缺失导致糖原在受影响的组织,包括心脏、骨骼肌(包括参与呼吸的那些)、肝脏和神经系统中积累。这种糖原积累被认为在患有GSD-II的个体中导致进行性肌无力和呼吸功能不全。GSD-II可发生于婴儿、小儿或成人,并且其预后根据发作的时间和症状的严重性而变化。临床上,GSD-II可能以广泛且连续的严重谱产生影响,范围从严重(婴儿)到较温和的迟发成人形式。患者最终由于呼吸功能不全而死亡。疾病的严重性与残留的酸性α-葡糖苷酶活性之间有良好的相关性,该活性在迟发中是正常情况的10-20%并且在疾病的早发形式中不到2%。估计GSD-II在全世界影响大约5000至10000人。
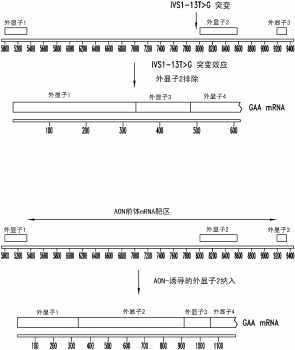
与疾病的成人发生形式相关的最常见突变是IVS1-13T>G。在三分之二的成人发生的GSD-II患者中发现,这种突变可能在杂合个体中赋予选择性优势或者是非常老的突变。带有这种突变的成人发生的GSD-II个体的广泛族群变化与常见发现对立。
GAA基因由跨20kb的20个外显子组成。3.4kbmRNA编码大约105kD的分子量的蛋白。IVS1-13T>G突变导致丢失外显子2(577个碱基),其含有起始AUG密码子。
对GSD-II的治疗已经包括药物治疗策略、饮食处理,和骨髓移植,而没有明显成功。近年来,酶替换疗法(ERT)已向GSD-II患者提供新的希望。例如, 一种重组GAA蛋白药物,在2006年在美国和欧洲得到批准用于患有GSD-II疾病的患者。 依赖于GAA蛋白表面上的甘露糖-6-磷酸(M6P)来递送至溶酶体。
最常用于RNA下调的反义技术(antisensetechnology)近来已经适用于改变剪接过程。对许多基因的主要基因转录本(前体mRNA)的处理包括去除内含子和精确剪接外显子,其中供体剪接位点联接至受体剪接位点。剪接是一个精确的处理过程,包括配位识别供体和受体剪接位点,以及分支点(受体剪接位点上游)和其余的正外显子剪接增强子(主要位于外显子内)和负剪接基序(主要位于内含子内的剪接沉默子)。
能够改变GAA前体mRNA的剪接的有效试剂可能在治疗上用于GSD-II的改善的治疗。
概述
本发明的实施方式涉及反义寡聚体以及相关的组合物和用于增加细胞中含外显子2的GAA-编码mRNA的水平的方法,包括将该细胞与具有足够的长度和互补性以足以特异性地杂交GAA基因的前体mRNA内的区的反义寡聚体接触,其中反义寡聚体与该区的结合增加了细胞中含外显子2的GAA-编码mRNA的水平。
因此,在一些实施方式中,本发明涉及10-40个核苷酸或核苷酸类似物的反义寡聚体,包括具有足够的长度和互补性以足以特异性杂交人酸性α-葡糖苷酶(GAA)基因的前体mRNA的内含子1(SEQIDNO:1)、外显子2(SEQIDNO:2)或内含子2(SEQIDNO:3)内的区的靶向序列。
在某些实施方式中,本发明涉及反义寡聚体化合物,包含:
非天然化学主链,其选自氨基磷酸酯或磷二酰胺吗啉代寡聚体(PMO)、肽核酸(PNA)、锁核酸(LNA)、硫代磷酸酯寡聚体、三环-DNA寡聚体、三环-硫代磷酸酯寡聚体、2’O-Me-修饰的寡聚体,或前述的任意组合;和
与人酸性α-葡糖苷酶(GAA)基因的前体mRNA的内含子1(SEQIDNO:1)、内含子2(SEQIDNO:2),或外显子2(SEQIDNO:3)内的区互补的靶向序列。
在一些实施方式中,反义寡聚体特异性杂交表1所列的内含子1、外显子2、和/或内含子2GAA序列内的区。在一些实施方式中,反义寡聚体特异性杂交内含子剪接沉默子元件或外显子剪接沉默子元件。在某些实施方式中,反义寡聚体包含表2所列的靶向序列、表2中靶向序列的至少10个连续核苷酸的片段,或与表2中的靶向序列有至少80%序列相同性的变体。在具体实施方式中,反义寡聚体由表2所列的靶向序列组成或基本由其组成。
在某些实施方式中,反义寡聚体是氨基磷酸酯或磷二酰胺吗啉代寡聚体(PMO)、PMO-X、PPMO、肽核酸(PNA)、锁核酸(LNA)、硫代磷酸酯寡聚体、三环-DNA寡聚体、三环-硫代磷酸酯寡聚体、2’O-Me-修饰的寡聚体,或前述的任意组合。
在一些实施方式中,反义寡聚体含有约、至少约,或不超过约1、2、3、4、5、6、7、8、9或10个阳离子核苷间连接。在某些实施方式中,反义寡聚体含有约,或至少约10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%或100%阳离子核苷间连接。在某些实施方式中,反义寡聚体含有约、至少约,或不超过约1、2、3、4、5、6、7、8、9或10个核苷间连接,其显示出约4.5至约12的pKa。在一些实施方式中,反义寡聚体含有约,或至少约10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%或100%核苷间连接,其显示出约4.5至约12的pKa。在一些实施方式中,反义寡聚体具有同时含有碱性氮和烷基、芳基或芳烷基的核苷间连接。在一些实施方式中,反义寡聚体包含吗啉基。
在某些实施方式中,本发明的反义寡聚体是式(I)的化合物:
或其药学上可接受的盐,其中:
各Nu是核碱基,一起形成靶向序列;
x是8-38的整数;
各Y独立地选自O或-NRa,其中Ra选自氢、-T1-NRcRdRe和-[(C(O)CHR′NH)m]R″,其中:
R′是天然产生的氨基酸或其一个或两个碳的同系物的侧链,R″选自氢或酰基,m是1-60的整数,Rc选自氢、C1-C6烷基、芳烷基和-C(=NH)NH2,Rd选自氢、芳烷基和C1-C6烷基,或者Rc和Rd与其附连的氮原子一起形成5-7元环,当RC和Rd各自独立地是C1-C6烷基或芳烷基时,其中该环任选地被选自C1-C6烷基、苯基、卤素和芳烷基的取代基取代,并且Re选自电子对、氢、C1-C6烷基和芳烷基;
各L独立地选自-P(O)2OH-、-P(O)2R1-、哌嗪基、羰基、H(O(CH2)sO)w-、-(OCH2CH2O)w、和-[(C(O)CHR′NH)m]R″,其中w是3-20的整数,S是1-8的整数;
n是0-3的整数;
各R1独立地选自-N(CH3)2、-NR5R6、-OR7、
式(II)的部分:
其中,R8选自氢、甲基、-C(=NH)NH2、-Z-T2-NHC(=NH)NH2和-[(C(O)CHR′NH)m]R″,其中Z是羰基或直接键,R9选自电子对、氢、C1-C6烷基和芳烷基,并且各R10独立地选自氢或甲基;和
式(III)的部分:
其中q是0-2的整数,R11选自氢、C1-C6烷基、芳烷基,和-C(=NH)NH2,R12选自氢、芳烷基,和C1-C6烷基,或者R11和R12和其附连的氮原子一起形成5-7元环,其中该环任选地被选自C1-C6烷基、苯基、卤素,和芳烷基的取代基取代,并且R13选自电子对、氢、C1-C6烷基,和芳烷基;
R2选自氢、OH、核苷酸、-(CH2)mC(O)NRfRg,其中Rf和Rg独立地选自H、酰基、C1-C6烷基,和-[(C(O)CHR′NH)m]R″、-[(C(O)CHR′NH)m]R″、H(O(CH2)sO)w-、H(OCH2CH2O)w-、三苯甲基、-C(=O)ORf,和酰基,其中Rf是C1-C30烷基,其包含一个或多个氧或羟基部分或其组合,或R2不存在;
R3选自氢、C1-C6烷基、核苷酸、-[(C(O)CHR′NH)m]R″、-C(=NH)NH2、三苯甲基、-C(=O)ORg、酰基、-C(O)(CH2)mC(O),和T4-(4-(4,6-(NR2)-1,3,5-三嗪-2-基)哌嗪-1-基,其中Rg是C1-C30烷基,其包含一个或多个氧或羟基部分或其组合,T4选自-C(O)(CH2)6C(O)-或-C(O)(CH2)2S2(CH2)2C(O)-,并且R是-(CH2)OC(O)NH(CH2)6NHC(NH)NH2;
R4选自电子对、氢、C1-C6烷基,和酰基,并且
各R5独立地选自氢或甲基;
各R6和各R7独立地选自氢或-T3-NRcRdRe;并且
各T1、T2,和T3独立地是长度至多为18个原子的任选接头,其包括烷基、烷氧基或烷氨基,或其组合,
其中,靶向序列与人酸性α-葡糖苷酶(GAA)基因的前体mRNA的内含子1(SEQIDNO:1)、内含子2(SEQIDNO:2),或外显子2(SEQIDNO:3)内的区互补。
在某些实施方式中,本发明的反义寡聚体是式(IV)的化合物:
或其药学上可接受的盐,其中:
各Nu是核碱基,一起形成靶向序列;
x是15-25的整数;
各Y是O;
各R1独立地选自下组:
其中,至少一个R1是-N(CH3)2,并且
其中,靶向序列选自SEQIDNO:4-120,其中X选自尿嘧啶(U)或胸腺嘧啶(T)。
在某些实施方式中,反义寡聚体还包含增强细胞摄入的肽部分。
本发明的范围内还包括反义寡聚体,其包括具有足够的长度和互补性以足以特异性杂交人酸性α-葡糖苷酶(GAA)基因的前体mRNA的内含子1(SEQIDNO:1)、外显子2(SEQIDNO:2)或内含子2(SEQIDNO:3)(如表2所示)内的区的靶向序列。在一些实施方式中,靶向序列包含选自SEQIDNO:4-120的靶向序列的至少10个连续核苷酸,其中X选自尿嘧啶(U)或胸腺嘧啶(T)。在某些实施方式中,靶向序列与选自SEQIDNO:4-120的靶向序列具有至少80%序列相同性,其中X选自尿嘧啶(U)或胸腺嘧啶(T)。
在某些实施方式中,反义寡聚体是氨基磷酸酯或磷二酰胺吗啉代寡聚体(PMO)、PMO-X、PPMO、肽核酸(PNA)、锁核酸(LNA)、硫代磷酸酯寡聚体、三环-DNA寡聚体、三环-硫代磷酸酯寡聚体、2’O-Me-修饰的寡聚体,或前述的任意组合。
还包括药物组合物,包含生理上可接受的运载体和本文所述的反义寡聚体。
某些实施方式还包括增加细胞中含外显子2的酸性α-葡萄糖苷酶(GAA)mRNA的水平的方法,包括将该细胞与具有足够的长度和互补性以足以特异性地杂交GAA基因的前体mRNA内的区的反义寡聚体接触,其中反义寡聚体与该区的结合增加了细胞中含外显子2的GAAmRNA的水平。
在一些实施方式中,相对于对照,细胞中含外显子2的GAAmRNA的水平增加至少约10%。在某些实施方式中,相对于对照,细胞中功能性GAA蛋白的水平增加至少约10%。在某些实施方式中,细胞在其基因组的一个或多个等位基因中有IVS1-13T>G突变,其(在没有反义治疗的情况下)导致含外显子2的GAAmRNA表达减少。
在一些实施方式中,该细胞在有此需要的对象中,并且该方法包括向该对象给予反义寡聚体。在一些实施方式中,该对象患有II型糖原贮积病(GSD-II)或具有患II型糖原贮积病的风险。本发明的一些实施方式涉及治疗有此需要的对象中的II型糖原贮积病(GSD-II;庞帕病)的方法,包括向该对象给予有效量的本发明的反义寡聚体。而某些实施方式涉及用于制备用于治疗II型糖原贮积病(GSD-II;庞帕病)的药物的反义寡聚体。
在某些实施方式中,该对象患有婴儿GSD-II或具有患婴儿GSD-II的风险。在具体实施方式中,该对象患有迟发GSD-II或具有患迟发GSD-II的风险。在某些实施方式中,该方法包括,相对于对照,使对象的一种或多种组织中的糖原水平降低至少约10%。
另外,本发明还包括检测人酸性α-葡糖苷酶(GAA)基因mRNA中外显子2纳入的方法,该方法包括:
用至少一种聚合酶链反应引物扩增GAAmRNA,该引物包含选自SEQIDNO:121、122或123的碱基序列。
本发明的这些和其它方面将在参考以下详细说明和附图之后变得显而易见。本文中公开的所有参考文献通过引用全文纳入本文,就如同它们单独纳入那样。
附图说明
图1显示了一种机制,相对于外显子缺失的GAAmRNA,空间阻断反义寡聚体通过该机制能增强含外显子2的GAAmRNA的水平。
图2显示了使用针对外显子1(正向)和外显子3(反向)的引物的,从含有外显子2的野生型GAA基因扩增的约1177个碱基的PCR扩增产物(参见实施例2)。
图3A-3C显示了来自实施例2的表E1的2’-O-甲基修饰的反义寡聚体的结果。图3A显示寡聚体9(GAA-IVS1(-74-55))和12(GAA-IVS1(-158-140))诱导携带IVS1-13G>T突变的人细胞中的外显子2-纳入,如约600个碱基的扩增子的减少的扩增(相对于全长约1177个碱基的扩增子)所示。图3B显示寡聚体14(GAA-IVS2(-53-72))诱导外显子2纳入,并且图3C显示寡聚体20(GAA-IVS2(-173-192))和22(GAA-IVS2(-338-364))也诱导一定程度的外显子2纳入。
图4A-4C显示表4A的PMO反义寡聚体的RT-PCR结果。
发明详述
I.定义
除非另外定义,否则,本文中所使用的所有技术和科学术语都具有本发明所属领域普通技术人员通常所理解的同样含义。虽然可采用与本文所述类似或等同的任何方法和材料实施或测试本发明,但本文描述优选的方法和材料。出于理解本发明的目的,定义以下术语。
本文使用冠词“一个”和“一种”表示一个或一个以上的(即至少一个)该冠词语法上的宾语。举例而言,“一种元件”表示一个元件或者一个以上的元件。
“约”指量、水平、值、数量、频率、百分比、维度、尺寸、用量、重量或长度相对于参考的量、水平、值、数量、频率、百分比、维度、尺寸、用量、重量或长度偏差达到30%、25%、20%、15%、10%、9%、8%、7%、6%、5%、4%、3%、2%或1%。
“编码序列”表示产生基因的多肽产物的密码的任何核酸序列。相反,“非编码序列”是指不直接产生基因的多肽产物的密码的任何核酸序列。
整篇说明书中,除非上下文需要另外说明,术语“包括”、“包含”和“含有”应理解为指示包括所述步骤或元素或者步骤或元素组而不排除任何其他步骤或元素或者步骤或元素组。
“由……组成”指包括但限于词组“由……组成”中的列举。因此,词组“由……组成”指所列元素是必须的或强制的,并且没有其他元素出现。“基本由……组成”指在词组中所列举的任何元素,但是限于其他不干扰或有助于本文特定列举元素的活性或作用的元素。因此,词组“基本由……组成”指所列举元素是必须的或强制的,但是其他元素是可选的,并且可以出现或可以不出现,取决于它们是否影响所列举元素的活性或作用。
本文所用术语“接触细胞”、“引入”或“递送”包括通过本领域常规方法将本发明的寡聚体递送到细胞中,例如,转染(例如,脂质体、磷酸钙、聚乙烯亚胺)、电穿孔(例如,核转染)、微注射。
本文所用术语“烷基”旨在包括线性(即,非支链或无环)、支链、环状,或多环非芳族烃基,其任选地被一个或多个官能团取代。除非另外说明,“烷基”含有1-8个,并且优选1-6个碳原子。C1-C6烷基意图包括C1、C2、C3、C4、C5和C6烷基基团。低级烷基是指含有1-6个碳原子的烷基。烷基的示例包括但不限于,甲基、乙基、正丙基、异丙基、环丙基、丁基、异丁基、仲丁基、叔丁基、环丁基、戊基、异戊基、树戊基、环戊基、己基、异己基、环己基等。烷基可以是取代的或未取代的。示例性的取代的烷基包括,但不限于,氟甲基、二氟甲基、三氟甲基、四氟甲基、2-氟乙基、3-氟丙基、羟甲基、2-羟乙基、3-羟丙基、苄基、取代的苄基、苯乙基、取代的苯乙基等。
本文所用的术语“烷氧基”表示烷基的亚组,其中具有所示数量的碳原子的如上定义的烷基通过氧桥附连。例如,“烷氧基”是指-O-烷基,其中烷基含有1-8个线性、支链、环状构象的碳原子。“烷氧基”的例子包括但不限于甲氧基、乙氧基、正丙氧基、异丙氧基、叔丁氧基、正丁氧基、仲戊氧基等。
本文所用术语“芳基”,单独使用或作为“芳烷基”、“芳烷氧基”或“芳氧基-烷基”的部分使用,是指具有6-14个环原子的芳环基团,如苯基、1-萘基、2-萘基、1-蒽基和2-蒽基。“芳基”环可含有一个或多个取代基。术语“芳基”可与术语“芳环”互换使用。“芳基”也包括稠合的多环芳环系统,其中芳环稠合至一个或多个环。可用的芳环基团的非限制性示例包括苯基、羟苯基、卤代苯基、烷氧基苯基、二烷氧基苯基、三烷氧基苯基、亚烷基二氧基苯基、萘基、菲基、蒽基、菲并等,以及1-萘基、2-萘基、1-蒽基和2-蒽基。如本文所用,术语“芳基”的范围内还包括其中芳环与一个或多个非芳环稠合的基团,如茚满基、苯邻二甲酰亚胺基,或四氢萘基,其中基团或附连点在芳环上。
术语“酰基”表示C(O)R基团(其中R指如上所述的H、烷基或芳基)。酰基的示例包括甲酰基、乙酰基、苯甲酰基、苯基乙酰基和类似基团。
本文所用术语“同源物”表示通过连续添加相同的化学基团而具有规则差异的化合物。例如,化合物的同源物的差别可在于添加一个或多个-CH2-基团、氨基酸残基、核苷酸,或核苷酸类似物。
术语“细胞穿透肽(CPP)”或“增强细胞摄入的肽部分”可互换使用并且指代阳离子细胞穿透肽,也称为“转运肽”、“载体肽”,或“肽转导结构域”。肽,如本文所示,具有给定细胞培养群的约或至少约30%、40%、50%、60%、70%、80%、90%,或100%的细胞内诱导细胞穿透的能力,并且允许大分子在全身性给药之后在体内多种组织中移位。在一些实施方式中,CPP是式-[(C(O)CHR′NH)m]R″,其中R′是天然氨基酸或其一个或两个碳的同源物的侧链,R″选自氢或酰基,并且m是高至50的整数。其它CPP是本领域所熟知的,并且公开于例如美国申请号2010/0016215,其通过引用全文纳入本文。在其它实施方式中,m是1-50的整数,其中,当m是1时,该部分是单一氨基酸或其衍生物。
本文使用的“氨基酸”是指由附连伯氨基、羧酸基团、侧链和氢原子的碳原子组成的化合物。例如,术语“氨基酸”包括但不限于甘氨酸、丙氨酸、亮氨酸、异亮氨酸、天冬氨酸、谷氨酰胺、赖氨酸和精氨酸。另外,本文所用的“氨基酸”也包括氨基酸的衍生物,如酯,和酰胺、以及盐,和其它衍生物,包括在代谢成活性形式之后具有药物性质的衍生物。因此,术语“氨基酸”被理解为包括天然产生的和非天然产生的氨基酸。
“电子对”是指不结合或与其它原子共享的电子的价对。
“同源性”是指相同或构成保守性取代的氨基酸的百分数。可使用比较程序如GAP(Deveraux等,1984,NucleicAcidsResearch12,387-395)来确定同源性。通过这种方式,可通过向比对中插入缺口来比较与本文所述的那些相似或明显不同长度的序列,例如,可通过GAP所用的比较算法来确定这类缺口。
“分离的”表示明显或基本没有其天然状态中通常伴随的组分的物质。例如,本文所用的“分离的多核苷酸”、“分离的寡核苷酸”,或“分离的寡聚体”可以指已经从其天然状态中侧接的序列中纯化或移出的多核苷酸,例如,从在基因组中与该片段相邻的序列中移出的DNA片段。与细胞相关的术语“分离”是指从来源对象(例如,患有多核苷酸重复疾病的对象)中纯化细胞(例如,成纤维细胞、淋巴母细胞)。在mRNA或蛋白质的内容中,“分离”是指从来源,例如细胞中回收mRNA或蛋白质。
术语“调节”包括一种或多种可定量参数“增加”或“降低”任选的限定和/或统计学显著的量。“增加”或“提高”、“增强”或“强化”,或“促进”或“刺激”一般是指相对于无反义化合物或对照化合物产生的响应,一种或多种反义化合物或组合物在细胞或对象中产生或导致更大的生理学响应(即,下游效应)。相关生理或细胞响应(体内或体外)对本领域技术人员而言将是显而易见的,并且可包括GAA-编码前体mRNA中外显子2纳入的增加,或有此需要的细胞、组织或对象中功能性GAA酶的表达增加。“增加的”或“增强的”量一般是“统计学显著的”量,并且可包括增加1.1、1.2、2、3、4、5、6、7、8、9、10、15、20、30、40、50或更多倍(例如,500、1000倍)的由无反义化合物(没有试剂)或对照化合物产生的量,包括之间并大于1的所有整数和小数(例如,1.5、1.6、1.7、1.8)。术语“减少”或“抑制”一般可以指一种或多种反义化合物或组合物“减少”相关生理或细胞响应的能力,如本文所述的疾病或病症的症状,如诊断领域中的常规技术所测量。相关生理或细胞响应(体内或体外)对于本领域技术人员而言将是显而易见的,并且可包括糖原贮积病如庞帕病的症状或病理的减少,例如,一种或多种组织中糖原积累减少。与由无反义化合物或对照组合物产生的响应相比,响应的“减少”可以是“统计学显著的”,并且可包括1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、11%、12%、13%、14%、15%、16%、17%、18%、19%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%,或100%的减少,包括之间的所有整数。
本文所用术语“反义寡核苷酸”、“反义寡聚体”,或“寡核苷酸”是指核苷酸的线性序列,或核苷酸类似物,其使核碱基通过Watson-Crick碱基配对与RNA中的靶序列杂交,以在靶序列内形成寡聚体:RNA异源双链体。术语“反义寡核苷酸”、“反义寡聚体”、“寡聚体”和“化合物”可以互换使用来指代寡聚体。环状亚基可基于核糖或另一种戊糖或者,在某些实施方式中,吗啉基基团(参见下文中吗啉代寡聚体的描述)。还可考虑肽核酸(PNA)、锁核酸(LNA)、三环-DNA寡聚体、三环-硫代磷酸酯寡聚体,和2’-O-甲基寡聚体等其它本领域已知的反义试剂。
包括非天然产生的寡聚体,或“寡核苷酸类似物”,其包括寡聚体,所述寡聚体具有(i)经修饰的主链结构,例如,不同于天然产生的寡核苷酸和多核苷酸中发现的标准磷酸二酯键的主链,和/或(ii)修饰的糖部分,例如,不同于核糖或脱氧核糖部分的吗啉代部分。寡聚体类似物支持能够通过Watson-Crick碱基配对与标准多核苷酸碱基形成氢键的碱基,其中类似物主链以一定方式显示碱基以允许这种氢键在标准多肽(例如,单链RNA或单链DNA)中在寡聚体类似物分子和碱基之间呈序列特异性的方式。优选的类似物是具有基本不带电的、含磷主链的那些。
“核酸酶耐受性”寡聚体是指主链对核酸酶切割有明显耐受性的寡聚体,以非杂交或杂交形式;通过体内常见的胞外和胞内核酸酶(例如,外切核酸酶如3’-外切核酸酶、内切核酸酶、RNA酶H);即,寡聚体在体内寡聚体暴露的正常核酸酶条件下显示很少或没有核酸酶切割。“核酸酶耐受性异源双链体”是指通过反义寡核苷酸与其互补靶标的结合形成的异源双链体,使得异源双链体对胞内和胞外核酸酶的体内降解有明显耐受性,这些核酸酶能够切割双链RNA/RNA或RNA/DNA复合物。“异源双链体”是指反义寡聚体和靶标RNA的互补部分之间的双链体。
本文所用的“核碱基”(Nu)、“碱基配对部分”或“碱基”可互换使用以指代天然DNA或RNA中发现的嘌呤或嘧啶(尿嘧啶、胸腺嘧啶、腺嘌呤、胞嘧啶和鸟嘌呤),以及天然产生的嘌呤和嘧啶的类似物,其(例如对寡聚体的结合亲和性)提供改善的性质。示例性的类似物包括次黄嘌呤(核苷肌苷的碱基组分);2,6-二氨基嘌呤;5-甲基胞嘧啶;C5-丙炔基-修饰的嘧啶;9-(氨基乙氧基)吩噁嗪(G-钳)等。
碱基配对部分的其它示例包括,但不限于,其相应氨基被以下部分保护的尿嘧啶、胸腺嘧啶、腺嘌呤、胞嘧啶、鸟嘌呤和次黄嘌呤:酰基保护基团、2-氟尿嘧啶、2-氟胞嘧啶、5-溴尿嘧啶、5-碘尿嘧啶、2,6-二氨基嘌呤、氮杂胞嘧啶、嘧啶类似物如假异胞嘧啶和假尿嘧啶和其它修饰的核碱基如8-取代的嘌呤、黄嘌呤或次黄嘌呤(后两者是天然降解产物)。也考虑Chiu和Rana,RNA,2003,9,1034-1048,Limbach等,NucleicAcidsResearch,1994,22,2183-2196以及Revankar和Rao,ComprehensiveNaturalProductsChemistry,第7卷,313中公开的修饰的核碱基。
碱基配对部分的其它示例包括,但不限于,尺寸扩大的核碱基,其中加入一个或多个苯环。考虑Glen研究目录(www.glenresearch.com);KruegerAT等,Acc.Chem.Res.,2007,40,141-150;Kool,ET,Acc.Chem.Res.,2002,35,936-943;BennerS.A.等,Nat.Rev.Genet.,2005,6,553-543;Romesberg,F.E.等,Curr.Opin.Chem.Biol.,2003,7,723-733;Hirao,I.,Curr.Opin.Chem.Biol.,2006,10,622-627中所述的核碱基取代可用于本文所述的寡聚体合成。尺寸扩大的核碱基的示例如下所示:
共价连接至核糖、糖类似物或吗啉基的核碱基包括核苷。“核苷酸”包括核苷和一个磷酸基团。磷酸基团将相邻核苷酸互相共价连接以形成寡聚体。
如果寡聚体在生理条件下以明显大于40℃或45℃的Tm,优选至少50℃,并且一般为60℃-80℃或更高,与靶标杂交,则寡聚体与靶多核苷酸“特异性杂交”。这种杂交优选对应于严格杂交条件。在给定的离子强度和pH下,Tm是50%的靶序列与互补多核苷酸杂交的温度。这种杂交可发生于反义寡聚体与靶序列“近似”或“基本”互补,以及精确互补。
本文所用的“足够的长度”是指反义寡聚体与GAA内含子1、外显子2或内含子2的区,或跨越任意前述的区中的至少8个,更通常8-40个连续核碱基互补。足够的长度的反义寡聚体具有至少能够与突变RNA中的GAA前体mRNA的区特异性杂交的最小数量的核苷酸。优选地,足够的长度的寡聚体长度是8-30个核苷酸。更优选地,足够的长度的寡聚体长度是9-27个核苷酸。
本文所用术语“序列相同性”或者,例如,包含“与……50%相同的序列”是指在比较窗中序列在核苷酸或氨基酸的基础上相同的程度。因此,“序列相同性百分比”的计算方法可为在比较窗中比较两条最优比对的序列,确定两条序列上出现的相同核酸碱基(例如A、T、C、G、I)或氨基酸残基(例如,Ala、Pro、Ser、Thr、Gly、Val、Leu、Ile、Phe、Tyr、Trp、Lys、Arg、His、Asp、Glu、Asn、Gln、Cys和Met)的位点数目以得出匹配位点的数目,将匹配位点的数目除以比较窗中总位点数目(即窗口大小),并将结果乘以100以得出序列相同性百分比。用于比对比较窗的任选的序列比对可通过计算机执行算法来进行(威斯康星遗传学软件包发布版本7.0中的GAP、BESTFIT、FASTA和TFASTA,遗传学计算组(GeneticsComputerGroup),科学大道575号(575ScienceDrive),美国威斯康星州麦迪逊)或通过检查和最佳比对(即,导致比较窗上的最高百分比同源性),其通过所选的多种方法中的任意生成。也参考BLAST程序家族,例如,Altschul等,Nucl.AcidsRes.25:3389,1997所述。
“对象”或“有此需要的对象”包括哺乳动物对象,如人对象。示例性的哺乳动物对象患有GSD-II(或庞帕病),或具有患GSD-II(或庞帕病)的风险。本文所用的术语“GSD-II”是指II型糖原贮积病(GSD-II或庞帕病),这是一种常染色体隐性疾病,其一般的特征在于患病个体中GAA蛋白质的低表达。在某些实施方式中,对象在一种或多种组织,例如心脏、骨骼肌、肝脏和神经系统组织中有减少的GAA蛋白质的表达和/或活性。在一些实施方式中,对象在一种或多种组织,例如心脏、骨骼肌、肝脏和神经系统组织中有增加的糖原积累。在具体实施方式中,对象具有IVS1-13T>G突变或其它突变,其导致功能性GAA蛋白质的表达减少(参见例如,Zampieri等,EuropeanJ.HumanGenetics.19:422-431,2011)。
本文所用术语“靶标”是指RNA区,并且具体指由GAA基因鉴定的区。在具体实施方式中,靶标是GAA-编码前体mRNA的内含子1或内含子2内的区,其负责对促进外显子2纳入的信号的抑制。在另一个实施方式中,靶标区是GAA外显子2的mRNA的区。
术语“靶序列”是指寡聚体类似物所针对的靶RNA的部分,即,寡聚体类似物将通过与互补序列的Watson-Crick碱基配对而杂交的序列。
术语“靶向序列”是寡聚体或寡聚体类似物中与RNA基因组中的“靶序列”互补(还表示,基本互补)的序列。反义寡聚体的完整序列或仅一部分可以与靶序列互补。例如,在具有20-30个碱基的寡聚体中,约6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28,或29个可以是与靶标区互补的靶向序列。通常,靶向序列由寡聚体中的连续碱基形成,但是可替代性地由非连续序列形成,其放置在一起时,例如来自寡聚体的相反末端时,构成跨越靶序列的序列。
出于本发明的目的,“靶向序列”可与靶序列“近似”或“基本”互补并且仍然发挥功能,即,仍然是“互补的”。优选地,本发明中所用的寡聚体类似物化合物在10个核苷酸中与靶序列具有至多一个错配,并且优选在20个核苷酸中有至多一个错配。或者,所用的反义寡聚体与本文设计的示例性靶向序列有至少90%序列同源性,并且优选地至少95%序列同源性。
本文所用的术语“定量”或其它相关词语是指确定单位体积中核酸、多核苷酸、寡聚体、肽、多肽或蛋白质的量、质量或浓度。
本文所用的对象(例如,哺乳动物,如人)或细胞的“治疗”是指尝试改变个体或细胞中的天然过程中使用的任意类型的介入。治疗包括,但不限于,给予药物组合物,并且可预防性地或者在病理事件开始或接触病原物质之后进行。还包括“预防性”治疗,其可涉及减少治疗的疾病或病症的发展速率,延缓该疾病或病症的发生,或减少其发生的严重性。“治疗”或“预防”不一定表示疾病或病症或其相关症状的完全根除、治愈或防止。
II.用于GAA剪接调节的序列
某些实施方式涉及相对于细胞中外显子2缺失的GAAmRNA增强含外显子2的GAA-编码mRNA的水平的方法,包括使细胞与具有足够的长度和互补性以足以与GAA基因内的区特异性杂交的反义寡聚体接触,使得相对于细胞中外显子2缺失的GAAmRNA增强含外显子2的GAAmRNA的水平。在一些实施方式中,该细胞在对象中,并且该方法包括向该对象给予反义寡聚体。
反义寡聚体可经设计以阻断或抑制或调节mRNA的翻译或抑制或调节前体mRNA剪接加工,或者诱导靶向的mRNA的降解,并且可以说“针对”或“靶向”其杂交的靶序列。在某些实施方式中,靶序列包括包含预处理的mRNA的3’或5’剪接位点、分支点或参与剪接调节的其它序列的区。靶序列可在外显子内或内含子内或者跨内含子/外显子连接。
在某些实施方式中,反义寡聚体与靶RNA(即,调节剪接位点选择的RNA)有足够的序列互补性以通过有效方式阻断靶RNA(例如,前体mRNA)的区。在示例性实施方式中,这种GAA前体mRNA的阻断用于调节剪接,通过遮蔽天然蛋白质的结合位点(该位点在其它情况下会调节剪接)和/或通过改变靶向的RNA的结构来调节剪接。在一些实施方式中,靶RNA是靶前体mRNA(例如,GAA基因前体mRNA)。
反义寡聚体具有对靶RNA序列的足够的序列互补性以调节靶RNA的剪接表示该反义试剂具有的序列足以引发天然蛋白的结合位点的遮蔽,其在其它情况下会调节剪接,和/或改变靶向的RNA的三维结构。类似地,寡聚体试剂具有对靶RNA序列的足够序列互补性以调节靶RNA的剪接表示,该寡聚体试剂具有的序列足以引发对天然蛋白的结合位点的遮蔽,其在其它情况下会调节剪接,和/或改变靶向的RNA的三维结构。
在示例性实施方式中,反义寡聚体具有足够的长度和对人GAA前体mRNA的内含子1、人GAA前体mRNA的外显子2,或人GAA前体mRNA的的内含子2中的序列的互补性。还包括与跨越人GAA前体mRNA的内含子1/外显子2的区,或跨越人GAA前体mRNA的外显子2/内含子2的区互补的反义寡聚体。人GAA基因的内含子1(SEQIDNO:1)、外显子2(SEQIDNO:2),和内含子2(SEQIDNO:3)的序列示于下表1(SEQIDNO:1的3’端附近高亮的T/G是上述的IVS1-13T>G突变;该位置的核苷酸是T或G)。
在某些实施方式中,反义靶向序列被设计成与表1所列的一个或多个靶序列的区杂交。可使选择的反义靶向序列更短,例如,约12个碱基,或更长,例如,约40个碱基,并且可包含小量的错配,只要序列具有足够互补性以使与靶序列杂交后的剪接调节有效,并且任选地与RNA形成Tm为45℃或更高的异源双链体即可。
在某些实施方式中,靶序列和反义靶向序列之间的互补程度足够形成稳定的双链体。反义寡聚体与靶标RNA序列互补的区可以短至8-11个碱基,但可以是12-15个碱基或更多,例如,10-40个碱基、12-30个碱基、12-25个碱基、15-25个碱基、12-20个碱基,或15-20个碱基,包括这些范围之间的所有整数。具有约14-15个碱基的反义寡聚体一般足够长以具有独特的互补序列。在某些实施方式中,可能需要互补碱基的最小长度来实现所需的结合Tm,如本文所述。
在某些实施方式中,长达40个碱基的寡聚体可以是合适的,其中至少最小数量的碱基,例如10-12个碱基,与靶序列互补。在一些实施方式中,以小于约30个碱基的寡聚体长度优化细胞中促进的或激活的摄取。对于PMO寡聚体,如本文进一步所述,结合稳定性和摄取的最优平衡一般发生在18-25个碱基的长度。本发明包括由约10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39或40个碱基组成的反义寡聚体(例如,PMO,PMO-X,PNA,LNA,2’-OMe),其中至少约6、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39或40个连续或非连续碱基与表1的靶序列(例如,SEQIDNO:1-3,跨越SEQIDNO:1/2或SEQIDNO:2/3的序列)互补。
反义寡聚体一般包含与人GAA基因的前体mRNA序列的内含子1、外显子2或内含子2之内或附近的区或序列足够互补的碱基序列。理想地,反义寡聚体能够有效调节GAA前体mRNA的异常剪接,并由此增加活性GAA蛋白质的表达。当寡聚体化合物能够被哺乳动物细胞主动摄取,并且一旦摄取即与靶标mRNA以超过约40℃或45℃的Tm形成稳定双链体(或异源双链体)时,这种要求被任选地满足。
在某些实施方式中,反义寡聚体可与靶序列100%互补,或者可包括错配,例如,以适应变体,只要寡聚体和靶序列之间形成的异源双链体足够稳定以耐受细胞核酸酶和体内可能发生的其它降解模式即可。因此,某些寡聚体可具有充分的互补性,这表示,在寡聚体和靶序列之间具有约或至少约70%序列互补性,例如,70%、71%、72%、73%、74%、75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列互补性。本文描述了不易被核酸酶切割的寡聚体主链。错配,如果存在,一般趋于杂交双链体的末端区的情况比处于中间的情况的失稳性更低。根据双链体稳定性的充分理解的原理,允许错配的数量将取决于寡聚体的长度,双链体中G∶C碱基对的百分比,和双链体中错配的位置。虽然,这种反义寡聚体不必与v靶序列100%互补,其有效地以稳定且特异性的方式结合至靶序列,以调节靶标前体RNA的剪接。
寡聚体和靶序列之间形成的双链体的稳定性随着结合Tm和双链体对细胞酶促切割的易感性变化。可通过常规方法测量寡聚体相对于互补序列RNA的Tm,如Hames等,《核酸杂交》(NucleicAcidHybridi
酸性α-葡糖苷酶中反义诱导的外显子2纳入专利购买费用说明
![]()
Q:办理专利转让的流程及所需资料
A:专利权人变更需要办理著录项目变更手续,有代理机构的,变更手续应当由代理机构办理。
1:专利变更应当使用专利局统一制作的“著录项目变更申报书”提出。
2:按规定缴纳著录项目变更手续费。
3:同时提交相关证明文件原件。
4:专利权转移的,变更后的专利权人委托新专利代理机构的,应当提交变更后的全体专利申请人签字或者盖章的委托书。
Q:专利著录项目变更费用如何缴交
A:(1)直接到国家知识产权局受理大厅收费窗口缴纳,(2)通过代办处缴纳,(3)通过邮局或者银行汇款,更多缴纳方式
Q:专利转让变更,多久能出结果
A:著录项目变更请求书递交后,一般1-2个月左右就会收到通知,国家知识产权局会下达《转让手续合格通知书》。
动态评分
0.0