专利摘要
本发明涉及用于药物输送的还原性或非还原性多核苷酸聚合物及其制备方法,并提供了通过使用核苷酸合成的还原性或非还原性的聚合物及其制备方法以及包含还原性或非还原性聚合物的用于药物输送的聚合物组合物。本发明涉及一种通过静电吸引将蛋白质或肽输送到目标部位的药物输送载体,通过使用核苷酸来合成因二硫键存在容易断裂的还原性聚合物或非还原性聚合物,获得了负电性(‑)的聚合物,然后将负电性(‑)的聚合物与正电性(+)的蛋白质或肽结合。其中衍生自包含新的还原性或非还原性聚合物的非病毒药物输送载体的聚合物能够使通过质子缓冲活性输送的药物从胞内体逸出到细胞中的其他细胞器中。
说明书
技术领域
本发明涉及用于药物输送的还原性或非还原性多核苷酸聚合物和用于制备其的方法。
背景技术
关于开发一种用于输送各种治疗剂(例如具有高分子量的肽、蛋白质和遗传物质,以及具有低分子量的化学药物和造影剂)到特定的器官、组织、细胞、细胞质、线粒体、核周区域和细胞核区域的有效系统已经引起了广泛兴趣。不同于传统的配方,位点特异性和纳米尺寸的试剂已被设计用来最大化输送到目标部位的治疗剂的生物利用度,由于其副作用小,提高了其治疗效果。这种药物输送技术已经逐渐成为整个药物开发高附加值技术中重要的一部分,越来越多地用于提高患者的服药依从性和服药的方便性。
输送到细胞内的生物制剂的内体螯合(endosomalsequestration)是相当大的障碍,是由具有胺、磺酰胺或羧酸基团的聚合物或单体引起的内体膜的不稳定或破坏而被除去。这些聚合物和单体提高了非病毒基因转移和化学药物的细胞质输送。在核内体pH方面,已知质子缓冲和构型转变导致了脂质膜或胞内裂解的不稳定性。
因此,本发明人完成了本发明,通过制备生物功能物质的药物输送载体以质子缓冲使输送的药物从核内体到细胞器,并利用静电吸引输送蛋白质或肽到目标部位,通过使用核苷酸来合成还原性聚合物或非还原性聚合物,其中二硫键可以充分断开,并获得了负电性(-)的聚合物,将正电荷(+)的蛋白质或肽结合到聚合物中。
同时,韩国专利号10-1224004公开了一种数均分子量为7000道尔顿或更小的聚乳酸衍生物化合物,以及制备该化合物的方法、使用该方法制备的蛋白质,用于多肽或肽药物的缓释组合物,以及所述组合物的制备方法,并且具有从还原性或非还原性的多核苷酸聚合物来输送药物的不同技术构成。
发明内容
技术问题
本发明的目的是提供一种新的负电性的部分还原或完全还原或非还原的多核苷酸聚合物及其制备方法。
技术方案
为了达到上述目的,本发明提供了一种新的负电性的部分还原或完全还原或非还原的多核苷酸聚合物。
此外,本发明的一个方面提供了一种制备非还原性的多核苷酸聚合物的方法,包括使选自AMP、ADP、ATP、GMP、GDP、GTP、CMP、CDP和CTP中的任何一种核苷酸与1-乙基-3-(3-二甲基氨基丙基)碳二亚胺(EDC)、N-羟基琥珀酰亚胺(NHS)搅拌反应;通过透析搅拌的反应混合物进行纯化,并从混合物中分离多核苷酸聚合物。
此外,本发明的另一个方面提供了一种制备新的负电性的部分还原或完全还原的核苷酸聚合物的方法。
此外,本发明的另一个方面提供了一种药物输送的聚合物组合物作为药物输送载体的用途,药物输送的聚合物组合物包含一种新的负电荷性的部分还原或完全还原或非还原的多核苷酸聚合物和正电性的分子(例如蛋白质或肽)。
此外,本发明的另一个方面提供了新的负电性的部分还原或完全还原或非还原的多核苷酸聚合物在去稳定化或破坏内体膜的作用,以用于增加药物在非病毒药物输送载体中的功效,该非病毒药物输送载体包含有一种新的负电性的部分还原或完全还原或非还原的多核苷酸聚合物和各种药物。
有益效果
本发明涉及一种用于药物输送的还原性或非还原性的多核苷酸聚合物,及其制备方法,并涉及一种有效的药物输送载体,以利用质子缓冲使药物从核内体中输送到细胞器中,利用静电吸引传输蛋白质或肽到目标部位,通过使用核苷酸来合成其中二硫键可以充分断开的还原性聚合物或非还原性聚合物,并获得负电性(-)的聚合物,将正电荷(+)蛋白质或肽结合到聚合物中。
此外,本发明涉及一种有效的生物功能材料,其能够通过质子缓冲活性将包含有还原性或非还原性的多核苷酸聚合物的非病毒药物输送载体中的输送药物从核内体中逸出到细胞的其它细胞器中。
附图说明
图1示出了合成的非还原的多核苷酸的凝胶渗透色谱分析。
图2示出了合成的部分还原的多核苷酸分子量的凝胶渗透色谱分析。
图3示出了合成的完全还原的多核苷酸分子量的凝胶渗透色谱分析。
图4示出了合成的部分还原的多核苷酸还原性的凝胶渗透色谱分析。
图5示出了非还原的多核苷酸的质子缓冲能力分析。
图6示出了还原的多核苷酸的质子缓冲能力分析。
图7示出了制备的pATP/溶菌酶络合物的粒径和表面电荷。
图8示出了制备的PRpATP/溶菌酶络合物的粒径和表面电荷。
图9示出了PLL/多核苷酸-pDNA络合物的粒径和表面电荷。
图10示出了bPEI25kDa/pATP-pDNA络合物(N/P5)、bPEI25kDa/pGTP-pDNA络合物(N/P5)、PLL/pATP-pDNA络合物(N/P5)和PLL/pGTP-pDNA络合物(N/P5)在HepG2细胞中的基因表达效率。如果充入的ATP和GTP的浓度为0,则形成对照络合物、bPEI25kDa/pDNA络合物(N/P5)和PLL/pDNA络合物(N/P5),它们的基因效率分别正交化进行基因效率的相对比较。
图11示出了bPEI25kDa/还原多核苷酸-pDNA络合物的颗粒尺寸和表面电荷。
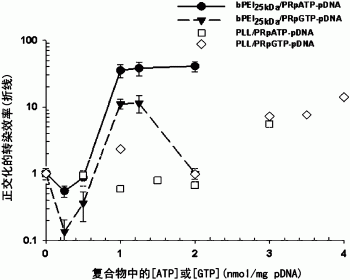
图12示出了bPEI25kDa/PRpATP-pDNA络合物(N/P5)、bPEI25kDa/PRpGTP-pDNA络合物(N/P5)、PLL/PRpATP-pDNA络合物(N/P5)以及PLL/PRpGTP-pDNA络合物(N/P5)在HepG2细胞中的基因表达效率。如果充入的ATP和GTP的浓度为0,则形成对照络合物、bPEI25kDa/pDNA络合物(N/P5)和PLL/pDNA络合物(N/P5),它们的基因效率分别正交化进行基因效率的相对比较。
具体实施方式
下面将参考附图对本发明进行更充分的说明,显示了本发明的示例性实施方式。
本发明提供了由下式1表示的非还原性的多核苷酸聚合物:
[式1]
其中R是 中的任意一种,X是0-2的整数,n是4-2000的整数。具体地,上述聚合物的特征在于其带有负电荷。
更具体地,如果X=0,该聚合物是pAMP、pGMP或pCMP;如果X=1,它是pADP、pGDP或pCDP;如果X=2,它是pATP、pGTP或pCTP。
此外,本发明提供了由下式2表示的部分还原的多核苷酸的聚合物:
[式2]
其中R是 中的任意一种,X是0-2的整数,n是1-2000的整数,m是1-2000的整数。具体地,上述聚合物的特征在于其带有负电荷。
更具体地,如果X=0,该聚合物是PRpAMP、PRpGMP或PRpCMP;如果X=1,它是PRpADP、PRpGDP或PRpCDP;如果X=2,它是PRpATP、PRpGTP或PRpCTP。
此外,本发明提供了一种由下式3表示的完全还原的多核苷酸聚合物:
[式3]
其中R是 中的任意一种,X是0-2的整数,n是2-2000的整数。具体地,上述聚合物的特征在于它带有负电荷。
更具体地,如果X=0,该聚合物是FRpAMP、FRpGMP或FRpCMP;如果X=1,它是FRpADP、FRpGDP或FRpCDP;如果X=2,它是FRpATP、FRpGTP或FRpCTP。
此外,本发明提供了一种制备非还原性的多核苷酸聚合物的方法,包括:使选自AMP、ADP、ATP、GMP、GDP、GTP、CMP、CDP和CTP中的任何一种核苷酸与1-乙基-3-(3-二甲基氨基丙基)碳二亚胺(EDC)、N-羟基琥珀酰亚胺(NHS)搅拌反应;通过透析纯化搅拌反应的混合物,并从混合物中分离多核苷酸聚合物。
具体地,反应混合物中核苷酸:EDC:NHS的摩尔比可以是1:0.5:0.5到1:3:3,核苷酸选自AMP、ADP、ATP、GMP、GDP、GTP、CMP、CDP和CTP组成的组中,反应在5至50℃的温度下进行0.5至200小时。
此外,本发明提供了制备部分还原的多核苷酸聚合物的方法,包括:使选自AMP、ADP、ATP、GMP、GDP、GTP、CMP、CDP和CTP中的任何一种核苷酸与1-乙基-3-(3-二甲基氨基丙基)碳二亚胺(EDC)、N-羟基琥珀酰亚胺(NHS)和胱胺搅拌反应;通过透析纯化搅拌的反应混合物,并从混合物中分离多核苷酸聚合物。
具体地,搅拌的反应混合物中核苷酸:EDC:NHS:胱胺的摩尔比可以是1:0.5-3:0.5-3:0.05-1,核苷酸选自AMP、ADP、ATP、GMP、GDP、GTP、CMP、CDP和CTP组成的组中,反应在5至50℃的温度下进行0.5至200小时。
此外,本发明提供了制备完全还原的多核苷酸聚合物的方法,包括:1)使选自AMP、ADP、ATP、GMP、GDP、GTP、CMP、CDP和CTP中的任何一种核苷酸与2-亚氨基四氢噻吩(2-iminothilane)搅拌反应;2)向1)的反应混合物中加入二甲基亚砜(DMSO)并搅拌反应;3)将1-乙基-3-(3-二甲基氨基丙基)碳二亚胺(EDC)、N-羟基琥珀酰亚胺(NHS)、胱胺与2)中的反应混合物混合并搅拌反应;和4)通过透析纯化搅拌的反应混合物,并从混合物中分离多核苷酸聚合物。
具体地,1)中搅拌的反应混合物中,核苷酸:2-亚氨基四氢噻吩的摩尔比可以是1:1-2,核苷酸选自由AMP、ADP、ATP、GMP、GDP、GTP、CMP、CDP和CTP组成的组中,2)中的反应混合物:EDC:NHS:胱胺的摩尔比可以是1:0.5-3:0.5-3:0.2-1,和1),2),3)中的反应在5至50℃的温度进行0.5至200小时。
在本发明中,术语“AMP”、“ADP”、“ATP”、“GMP”、“GDP”、“GTP”、“CMP”、“CDP”和“CTP”分别是单磷酸腺苷、二磷酸腺苷、三磷酸腺苷,单磷酸鸟苷,二磷酸鸟苷,三磷酸鸟苷,单磷酸胞苷,二磷酸胞苷和三磷酸胞苷的缩写。
此外,在本发明中,术语“PR”是部分还原的缩写,术语“FR”是完全还原的缩写。
此外,本发明提供了用于药物输送的聚合物组合物,其包含多核苷酸的聚合物和带正电荷的分子。
具体地,具有正电荷的分子可以是带正电荷的蛋白质或肽的药物。
具体地,由于质子缓冲活性,该组合物可诱导待输送的药物通过胞内体裂解(endosomolysis)从核内体逸出。
此外,本发明提供了非病毒的药物输送组合物,包括多核苷酸聚合物和非病毒的药物载体。
具体地,由于其质子缓冲活性,该组合物可诱导待输送的药物通过胞内体裂解从核内体逸出。
具体而言,非病毒的载体包含选自亲水性化学药物、疏水性化学药物、蛋白质药物、肽类药物、基因药和诊断药中的至少一种药物;和选自聚乙烯亚胺(bPEI)、聚赖氨酸(PLL)、聚(精氨酸)、聚组氨酸、聚(酰氨基胺)、聚(β-酸氨基酯)、脱乙酰壳多糖、鱼精蛋白、组蛋白、聚(叔胺甲基丙烯酸酯)、聚(2-(二甲基氨基)乙基甲基丙烯酸酯)、聚(N-[N-(2-氨基乙基)-2-氨基乙基]天冬酰胺)、脂类、磷脂、聚合物衍生的纳米结构、金属衍生的纳米结构、碳衍生的纳米结构、磷酸钙纳米结构、多孔二氧化硅的纳米结构和其配合物中的至少一种载体,但不限于此。
根据本发明的用于药物输送的聚合物组合物,可包含单独的药学上有效量的药物,或一种或多种药学上可接受的载体、赋形剂或稀释剂。药物的药学上有效量是指足以诱导被给药的动物或人类的生理和药理活性的量。然而,药学上有效量取决于给药对象的年龄、体重、健康状况、性别、给药途径和治疗期。
此外,“药学上可接受”是指当给药到人体时,它是生理上可接受的,不会引起胃肠功能紊乱、过敏反应如头晕或类似的反应。载体、赋形剂和稀释剂的实例包括乳糖、葡萄糖、蔗糖、山梨醇、甘露醇、木糖醇、赤藓糖醇、麦芽糖醇、淀粉、阿拉伯橡胶、藻酸盐、明胶、磷酸钙、硅酸钙、纤维素、甲基纤维素、聚乙烯吡咯烷酮、水、羟基苯甲酸甲酯、羟基苯甲酸丙酯、滑石、硬脂酸镁和矿物油。此外,可进一步包括填料、抗凝血剂、润滑剂、润湿剂、调味剂、乳化剂和防腐剂。
根据本发明的用于药物输送的聚合物组合物,可通过各种途径给药,包括口服、透皮给药、皮下给药、静脉内给药或肌肉内给药,药物的剂量可根据各种因素如给药途径、患者的年龄、性别、体重和病人的严重性等适当确定。此外,本发明的用于药物输送的聚合物组合物也可与能增加药物期望药效的已知化合物结合给药。
如本文所用,“药物”是一种能够通过促进或抑制人、动物体内生理功能来诱导期望的生物学或药理学效果的物质,或者化学上或生物上适合给药给动物或人体的材料或化合物,并且(1)防止了不期望的生物学效果如感染,从而对有机材料有预防作用,(2)减少疼痛或疾病感染,(3)缓解、减少或完全消除了有机材料引起的疾病。
以下,通过实施例对本发明进行更详细地说明。然而,本发明并不受这些实施例限制。
<实施例1>多核苷酸的合成
1.非还原性的多核苷酸的合成
将不同的单体(ATP、ADP、AMP、GTP、GDP、GMP、CTP、CDP、CMP)在水溶液中于1-乙基-3-(3-二甲基氨基丙基)碳二亚胺(EDC)、N-羟基琥珀酰亚胺(NHS)和三甲胺(TEA)存在下搅拌反应。分离合成的聚合物和副产物并通过透析、冷冻、干燥进行纯化,由此得到非还原性的多核苷酸。
在本发明中,单体和反应物的摩尔比为单体:EDC:NHS=1:1:1,并将200mg的单体溶解在5mL水中。使用100μL的TEA,在室温搅拌进行反应48小时。合成的聚合物溶液加入到MWCO(分子量截止值)为3500道尔顿的透析膜中,外部的水在48小时内更换了至少10次以除去具有低分子量的核苷酸,在室温下进行分离和纯化操作。剩余在透析膜中的水溶液进行冷冻干燥,得到非还原的多核苷酸聚合物。
[化学反应1]
2.还原性的多核苷酸的合成
(1)部分还原的多核苷酸的合成
将不同的单体(ATP、ADP、AMP、GTP、GDP、GMP、CTP、CDP、CMP)在水溶液中于胱胺、1-乙基-3-(3-二甲基氨基丙基)碳二亚胺(EDC)、N-羟基琥珀酰亚胺(NHS)和三甲胺(TEA)存在下搅拌反应。分离合成的聚合物和副产物并通过透析、冷冻、干燥进行纯化,由此得到部分还原的多核苷酸。
在本发明中,单体和反应物的摩尔比为单体:EDC:NHS:胱胺=1:1:1:0.1或1:1:1:0.2或1:2:2:1,并将200mg单体溶解在5mL水中。使用100μL的TEA,在室温搅拌进行反应48小时。合成的聚合物溶液加入到MWCO(分子量截止值)为3500道尔顿的透析膜中,外部的水在48小时内更换了至少10次以除去具有低分子量的核苷酸,在室温下进行分离和纯化操作。剩余在透析膜中的水溶液进行冷冻干燥,得到部分还原的多核苷酸聚合物。
[化学反应2]
(2)完全还原的多核苷酸的合成
将不同的单体(ATP、ADP、AMP、GTP、GDP、GMP、CTP、CDP、CMP)在水溶液中于2-亚氨基四氢噻吩存在下搅拌反应。这时,调整pH值到约7。反应物搅拌反应一天,加入二甲亚砜(DMSO),然后搅拌反应一天。之后,反应物在胱胺、1-乙基-3-(3-二甲基氨基丙基)碳二亚胺(EDC)、N-羟基琥珀酰亚胺(NHS)和三甲胺(TEA)存在下搅拌反应48小时。分离合成的聚合物和副产物并通过透析、冷冻、干燥进行纯化,由此得到完全还原的多核苷酸。
在本发明中,单体和反应物的摩尔比为单体:2-亚氨基四氢噻吩=1:1,单体:EDC:NHS:胱胺=1:1:1:0.5,并将200mg的单体溶解于5mL水中。使用100μL的TEA,在室温搅拌进行反应48小时。合成的聚合物溶液加入到MWCO(分子量截止值)为3500道尔顿的透析膜中,外部的水在48小时内更换了至少10次以除去具有低分子量的核苷酸,在室温下进行分离和纯化操作。剩余在透析膜中的水溶液进行冷冻干燥,得到完全还原的多核苷酸聚合物。
[化学反应3]
<实施例2>多核苷酸的合成凝胶渗透色谱分析
1.非还原性多核苷酸的分析
在将聚合物水溶液稀释到0.5mg/mL后,每个小瓶转移0.2mL上述溶液用于GPC。此后,每一个样本以1mg/mL的流速进行HPLC15分钟。切换到分析项目的GPC模式并选择分子量测量范围后,通过标准曲线计算分子量。
图1示出了对于合成的pATP和pGTP的GPC结果。pATP的数均分子量为1.28×105道尔顿,重均分子量为1.67×105道尔顿,其多分散性为1.30。pGTP的数均分子量为1.15×105道尔顿,重均分子量为1.83×105道尔顿,其多分散性为1.5。
2.还原性多核苷酸的分析
使用GPC评估了聚合物的分子量和还原能力。在制备了0.5mg/mL的聚合物溶液之后,用流动的水以1mg/mL的速率分析含水柱。此外,处理20mM的二硫苏糖醇(DTT)并分析GPC以检查还原能力。
根据合成条件(图2),PRpATP的分子量Mn为1.5-2.5x104Da,PDI=1.5-2.5。根据合成条件(图3),FRpATP的分子量Mn为4-7x104Da,PDI=1.5-2.0。如图4中所示,PRpATP(Mn为2.5×104Da)用20mM的DTT还原以确定改变具有分子量1300Da的ATP的两种衍生物形式。
<实施例3>多核苷酸的质子缓冲能力评价
1.非还原性的多核苷酸
将单体和合成的多核苷酸聚合物溶解在150mM的氯化钠水溶液中浓度达到1mg/mL后,加入少量NaOH制备出pH约11的水溶液。将0.1M氯化氢加入到水溶液中,监控pH的变化。
如图5所示,在核内体的pH值范围,pH为4-7时,三磷酸多腺苷(pATP)相对没有质子缓冲能力的NaCl而言具有质子缓冲能力,几乎相当于ATP。此外,三磷酸多腺苷(pATP)的质子缓冲能力几乎对应于GTP的能力。核内体pH范围内的多核苷酸的该质子缓冲能力可通过渗透差去稳定化或破坏内吞体膜,如著名的“质子海绵效应”。
2.还原性的多核苷酸
将单体和合成的多核苷酸聚合物溶解在150mM的氯化钠水溶液中浓度达到1mg/mL后,加入少量NaOH制备出pH约11的水溶液。当将0.1M氯化氢加入到水溶液中,监控pH的变化。
如图6所示,在核内体的pH值范围,pH为4-7时,还原性的三磷酸多腺苷(PRpATP或FRpATP)和还原性的三磷酸多鸟苷(PRpGTP或FRpGTP)相对没有质子缓冲能力的NaCl而言具有质子缓冲能力,几乎相当于ATP。此外,PRpGRP和FRpGTP的质子缓冲能力几乎相当于GTP的能力。核内体pH范围内的多核苷酸的质子缓冲能力可通过渗透差去稳定化或破坏内吞体膜,如著名的“质子海绵效应”。
<实施例4>带正电荷的药物在多核苷酸中包封的评价
1.非还原性的多核苷酸
使用带负电荷的多核苷酸和溶菌酶评价了带正电的蛋白质/肽药物的包封能力。使用模型的多核苷酸pATP和溶菌酶,以彼此相同的体积制备了重量比为10或20的溶液。将制备的两种溶液混合,剧烈搅拌约15秒并在室温下放置30分钟。在水溶液中形成的pATP/溶菌酶复合物的粒径用激光粒度仪测定,使用扫描电子显微镜观察水溶液中的复合粒子。此外,复合粒子的表面电荷通过水溶液中的激光粒度仪电荷进行评价。形成的pATP/溶菌酶复合物约为40nm,并且其表面电荷约为-5mV(图7)。根据上述结果,带负电荷的多核苷酸发现其中包封带正电荷的蛋白质/肽。
2.还原性的多核苷酸
使用带负电的还原性多聚核苷酸和溶菌酶对带正电荷的蛋白质/肽药物的包封能力进行了评价。使用模型的还原性多核苷酸pATP和溶菌酶,以彼此相同的体积制备了重量比为10或20的溶液。形成的pATP/溶菌酶复合物约为60nm,其表面电荷约为-15mV(图8)。根据上述结果,带负电荷的还原性多核苷酸包封了带正电荷的蛋白质/肽。
<实施例5>包含多核苷酸的聚合物基因药物输送载体的基因表达效率
1.非还原性的多核苷酸
为了将多核苷酸包封在已知的聚合物/基因复合物中,制备了带正电荷的聚合物-聚乙烯亚胺(bPEI,分子量25kDa)或聚赖氨酸(PLL)的溶液和包含pDNA和多核苷酸的带负电荷的溶液,混合两种溶液得到bPEI25kDa/多核苷酸-pDNA复合物或PLL/多核苷酸-pDNA的复合物。仅使用bPEI25kDa或PLL的胺和pDNA的磷酸酯计算N/P比为5,而不考虑磷酸酯的多核苷酸。
相比于没有多核苷酸的bPEI25kDa/pDNA复合物或PLL/pDNA复合物,测量了获得的bPEI25kDa/多核苷酸-pDNA复合物或PLL/多核苷酸-pDNA复合物的包封多核苷酸有增强基因表达效率的能力。在6孔板的每个孔中接种5×105的细胞后,培养细胞24小时。转染之前1小时改变转染培养基,将制备的bPEI25kDa/多核苷酸-pDNA复合物、PLL/多核苷酸-pDNA复合物、bPEI25kDa/pDNA复合物或PLL/pDNA复合物溶液转染到细胞中。培养4小时后,将培养基更换为原本含有血清的细胞培养基,在进一步培养44小时后,评价了基因表达的效率。
例如,PLL/三磷酸多腺苷-pDNA复合物的粒径至多为200nm,直到3nmol的ATP每1微克pDNA,表面电荷是正电性的(图9)。
如图10中,当包封的ATP和GTP的浓度为0时,制备了对照复合物、bPEI25kDa/pDNA复合物或PLL/pDNA复合物,为了相对比较,将HepG2细胞中的基因表达效率分别确定为1。为了将包封在复合物中的pATP和pGTP的数量表达为每个ATP和GTP的数量,bPEI25kDa/pATP-pDNA复合物、bPEI25kDa/pGTP-pDNA复合物、PLL/pATP-pDNA复合物和PLL/pGTP-pDNA复合物的基因表达效率增加到约ATP浓度为1nmol/μgpDNA时的80倍,约GTP浓度为1nmol/μgpDNA时的4倍,约ATP浓度为3nmol/μgpDNA时的3.6倍,约GTP浓度为4nmol/μgpDNA时的12倍。
2.还原性的多核苷酸
为了将还原性的多核苷酸包封在已知的聚合物/基因复合物中,制备了带正电荷的聚合物-聚乙烯亚胺(bPEI,分子量25kDa)或聚赖氨酸(PLL)的溶液和包含pDNA和还原性多核苷酸的带负电荷的溶液,混合两种溶液得到bPEI25kDa/还原性多核苷酸-pDNA复合物或PLL/还原性多核苷酸-pDNA的复合物。仅使用bPEI25kDa或PLL的胺和pDNA的磷酸酯计算N/P比为5,而不考虑磷酸酯的还原性多核苷酸。
相比于没有多核苷酸的bPEI25kDa/pDNA复合物或PLL/pDNA复合物,测量了获得的bPEI25kDa/还原性多核苷酸-pDNA复合物或PLL/还原性多核苷酸-pDNA复合物包封的还原性多核苷酸有较高的基因表达效率的能力。在6孔板的每个孔中接种5×105的细胞后,培养细胞24小时。转染之前1小时改变转染培养基,将制备的bPEI25kDa/还原性多核苷酸-pDNA复合物、PLL/还原性多核苷酸-pDNA复合物、bPEI25kDa/pDNA复合物或PLL/pDNA复合物溶液转染到细胞中。培养4小时后,将培养基更换为原本含有血清的细胞培养基,在进一步培养44小时后,评价了基因表达的效率。
例如,bPEI25kDa/还原性多核苷酸-pDNA复合物的粒径至多为200nm,直到1nmol的ATP每1微克pDNA,表面电荷是正电性的(图11)。
如图12中,当包封的ATP和GTP的浓度为0时,制备了对照复合物、bPEI25kDa/pDNA复合物或PLL/pDNA复合物,为了相对比较,将HepG2细胞中的基因表达效率分别确定为1。为了将包封在复合物中的PRpATP和PRpGTP的数量表达为每个ATP和GTP的数量,bPEI25kDa/PRpATP-pDNA复合物、bPEI25kDa/PRpGTP-pDNA复合物、PLL/PRpATP-pDNA复合物和PLL/PRpGTP-pDNA复合物的基因表达效率增加到约ATP浓度为2nmol/μgpDNA时的41倍,约GTP浓度为1nmol/μgpDNA时的11倍,约ATP浓度为3nmol/μgpDNA时的5.6倍,约GTP浓度为4nmol/μgpDNA时的14倍。
尽管结合目前认为是可行的示例性实施方式对本发明进行了说明,但应该理解的是,本发明并不限制于这些公开的实施方式,相反,本发明旨在涵盖包含在本发明附加权利要求的精神和范围内的各种修改和等同设置。
用于药物输送的还原性或非还原性多核苷酸聚合物及其制备方法专利购买费用说明
![]()
Q:办理专利转让的流程及所需资料
A:专利权人变更需要办理著录项目变更手续,有代理机构的,变更手续应当由代理机构办理。
1:专利变更应当使用专利局统一制作的“著录项目变更申报书”提出。
2:按规定缴纳著录项目变更手续费。
3:同时提交相关证明文件原件。
4:专利权转移的,变更后的专利权人委托新专利代理机构的,应当提交变更后的全体专利申请人签字或者盖章的委托书。
Q:专利著录项目变更费用如何缴交
A:(1)直接到国家知识产权局受理大厅收费窗口缴纳,(2)通过代办处缴纳,(3)通过邮局或者银行汇款,更多缴纳方式
Q:专利转让变更,多久能出结果
A:著录项目变更请求书递交后,一般1-2个月左右就会收到通知,国家知识产权局会下达《转让手续合格通知书》。
动态评分
0.0