IPC分类号 : C12N1/20,C12N9/02,C12N15/53,C12P11/00,C12P17/10,C12P17/16,C12R1/01
专利摘要
本发明公开了一种慢生根瘤菌单加氧酶、编码该酶的基因、含有该基因的重组表达载体和重组表达转化体,利用重组表达转化体制备所述单加氧酶的方法,以及利用所述单加氧酶制备光学纯手性亚砜,特别是催化拉唑类前体硫醚不对称氧化制备拉唑类药物的方法。与光学纯亚砜制备的其他方法相比,使用本发明所述单加氧酶作为催化剂制备的产物,光学纯度高,没有副产物砜的生成,而且具有反应条件温和、操作简便、易于放大等优点。因此在一系列药物中间体及拉唑类药物,特别是右旋兰索拉唑的合成中具有很好的工业应用前景。
权利要求
1.一种Bradyrhizobium oligotrophicum,其为Bradyrhizobium oligotrophicumECU1212,保藏在中国微生物菌种保藏委员会普通微生物中心,保藏编号为CGMCCNo.15208。
2.根据权利要求1所述的Bradyrhizobium oligotrophicum,其特征在于可以产生氨基酸序列如SEQ ID No.2所示的Bradyrhizobium oligotrophicum ECU1212硫醚单加氧酶。
3.一种单加氧酶,其特征在于,所述单加氧酶含有如SEQ ID No.2所示的氨基酸序列;或,
所述单加氧酶含有如所述SEQ ID No.2所示的氨基酸序列发生突变后的突变氨基酸序列。
4.根据权利要求3所述的单加氧酶,其特征在于,所述突变氨基酸序列为所述SEQ IDNo.2所示的氨基酸序列中任意1至5个氨基酸发生替换后而生成的突变氨基酸序列。
5.根据权利要求4所述的单加氧酶,其特征在于,所述突变氨基酸序列为所述SEQ IDNo.2所示的氨基酸序列中第295位、第357位、第394位、第395位以及第396位的氨基酸中的任意一个或多个发生替换后而生成的突变氨基酸序列。
6.根据权利要求5所述的单加氧酶,其特征在于,所述突变氨基酸序列包括以下任意一项或多项特征:
(1)所述SEQ ID No.2所示的氨基酸序列中第295位的氨基酸Asp替换为Cys;
(2)所述SEQ ID No.2所示的氨基酸序列中第357位的氨基酸Ser替换为Ile;
(3)所述SEQ ID No.2所示的氨基酸序列中第394位的氨基酸Phe替换为Ala;
(4)所述SEQ ID No.2所示的氨基酸序列中第395位的氨基酸Ser替换为Leu;
(5)所述SEQ ID No.2所示的氨基酸序列中第396位的氨基酸Trp替换为Ala。
7.根据权利要求6所述的单加氧酶,其特征在于,所述单加氧酶含有如SEQ ID No.4所示的突变氨基酸序列。
8.根据权利要求6所述的单加氧酶,其特征在于,所述单加氧酶含有如SEQ ID No.6所示的突变氨基酸序列。
9.一种分离的核酸,其特征在于,所述的核酸编码权利要求3-8中任一项所述的单加氧酶。
10.一种重组表达载体,其特征在于,所述重组表达载体包含如权利要求9所述的核酸。
11.一种重组表达转化体,其特征在于,所述重组表达转化体包含如权利要求10所述的重组表达载体。
12.一种如权利要求3至8任一项所述的单加氧酶的制备方法,其特征在于,包括以下步骤:
培养如权利要求11所述的重组表达转化体,从中分离所述单加氧酶。
13.一种如权利要求1-8任一项所述的Bradyrhizobium oligotrophicum或单加氧酶在不对称催化氧化潜手性硫醚化合物中的应用。
14.根据权利要求13所述的应用,其特征在于,所述潜手性硫醚化合物选自以下任一化学式所示的化合物:
15.根据权利要求13所述的应用,其特征在于,将所述潜手性硫醚化合物不对称催化氧化为亚砜化合物。
说明书
技术领域
本发明属于生物工程技术领域,尤其是涉及一种慢生根瘤菌单加氧酶、编码该酶的基因、含有该基因的重组表达载体和重组表达转化体,利用重组表达转化体制备所述单加氧酶的方法,以及利用所述单加氧酶制备光学纯手性亚砜,特别是催化拉唑类前体硫醚氧化制备拉唑类药物的方法。
背景技术
手性亚砜具有广泛而重要的应用价值,它的用途大致可以分为几类:手性辅助试剂、手性配体、手性催化剂以及手性药物和药物中间体。
一些手性亚砜是含有硫原子手性中心药物的重要中间体或药物本身。例如:艾司奥美拉唑为代表的一系列苯并吡唑类质子泵抑制剂,都是手性杂环基亚砜类化合物。质子泵抑制剂(PPIs,Proton Pump Inhibitors)是许多胃食管疾病(如胃及十二指肠溃疡,胃食管反流病)的首选治疗药物,作为H
利用生物催化的方法合成手性亚砜具有立体选择性高、反应条件温和安全、环境友好等优点,是化学方法合成手性亚砜的有益补充,并且随着生物技术的发展已经成为目前研究的热点。虽然可以不对称催化氧化硫醚化合物的生物催化剂种类繁多,但是现有的生物催化剂对大位阻硫醚底物的催化效率极低。亚克(Babiak)等从土壤污染物中筛选到了一株野生菌,经鉴定为赖氨酸芽孢杆菌(Lysinibacillus),使用该菌株生长细胞催化奥美拉唑硫醚的转化,底物上载量为0.1g/L时,发酵培养48h后,转化率仅为77%。WO2011/071982中公开了Codexis公司对来自 Acinetobacter sp.NCIMB 9871的环己酮单加氧酶CHMO进行了定向进化,得到的工程酶能够高效催化奥美拉唑硫醚氧化制备(S)-奥美拉唑,尽管如此,目前仍然缺乏能够不对称催化氧化兰索拉唑硫醚的高效催化剂。Codexis公司得到的工程酶能够催化兰索拉唑硫醚生成(R)-兰索拉唑,但是工程酶的催化效率极低,底物上载量为1.5g/L时,17h转化率仅为1.2%,且由于极低的转化率导致无法测定产物的光学纯度。
目前,右旋兰索拉唑仍然采用化学法生产,在现有生产工艺中,不对称催化氧化过程的选择性差、转化率低。手性金属钛试剂和辅剂酒石酸用量大,硫醚剩余约10~15%,杂质砜的含量约2%。由于反应产物杂质多,后处理过程中需要多次萃取结晶,产率低,并且产生大量三废(废水、废气、废液)。而现有的生物催化剂虽然反应条件温和、安全且环境友好,但是转化率较低。
发明内容
本发明针对现有技术中化学法生产亚砜类化合物选择性差、转化率低以及生物催化合成大位阻亚砜类化合物转化率低的问题,提供了一株筛选获得的 Bradyrhizobiumoligotrophicum ECU1212。
本发明提供了一种Bradyrhizobium oligotrophicum,其为Bradyrhizobiumoligotrophicum ECU1212,保藏在中国微生物菌种保藏委员会普通微生物中心,保藏编号为CGMCC No.15208。
在其中一个实施例中,所述的Bradyrhizobium oligotrophicum可以产生氨基酸序列如SEQ ID No.2所示的Bradyrhizobium oligotrophicum ECU1212硫醚单加氧酶。
本发明还提供了一种单加氧酶,所述单加氧酶含有如SEQ ID No.2所示的氨基酸序列;或,
所述单加氧酶含有如所述SEQ ID No.2所示的氨基酸序列发生突变后的突变氨基酸序列。
在其中一个实施例中,所述突变氨基酸序列为所述SEQ ID No.2所示的氨基酸序列中任意1至5个氨基酸发生替换后而生成的突变氨基酸序列。
在其中一个实施例中,所述突变氨基酸序列为所述SEQ ID No.2所示的氨基酸序列中第295位、第357位、第394位、第395位以及第396位的氨基酸中的任意一个或多个发生替换后而生成的突变氨基酸序列。
在其中一个实施例中,所述突变氨基酸序列包括以下任意一项或多项特征:
(1)所述SEQ ID No.2所示的氨基酸序列中第295位的氨基酸Asp替换为Cys;
(2)所述SEQ ID No.2所示的氨基酸序列中第357位的氨基酸Ser替换为Ile;
(3)所述SEQ ID No.2所示的氨基酸序列中第394位的氨基酸Phe替换为Ala;
(4)所述SEQ ID No.2所示的氨基酸序列中第395位的氨基酸Ser替换为Leu;
(5)所述SEQ ID No.2所示的氨基酸序列中第396位的氨基酸Trp替换为Ala。
在其中一个实施例中,,所述单加氧酶含有如SEQ ID No.4所示的突变氨基酸序列。
在其中一个实施例中,所述单加氧酶含有如SEQ ID No.6所示的突变氨基酸序列。
本发明还提供了一种分离的核酸,所述的核酸编码上述任一项所述的单加氧酶。
本发明还提供了一种重组表达载体,所述重组表达载体包含上述的核酸。
本发明还提供了一种重组表达转化体,所述重组表达转化体包含如上所述的重组表达载体。
本发明还提供了一种如上所述的单加氧酶的制备方法,包括以下步骤:
培养如上所述的重组表达转化体,从中分离所述单加氧酶。
本发明还提供了一种如上所述的Bradyrhizobium oligotrophicum或单加氧酶在不对称催化氧化潜手性硫醚化合物中的应用。
在其中一个实施例中,所述潜手性硫醚化合物选自以下任一化学式所示的化合物:
在其中一个实施例中,将所述潜手性硫醚化合物不对称催化氧化为亚砜化合物。
本发明的积极进步效果在于:本发明提供了一种单加氧酶,所述单加氧酶包括BoTEMO、BoTEMO突变体,所述单加氧酶可以高效催化硫醚的不对称氧化以制备光学纯手性亚砜。在兰索拉唑硫醚底物浓度达到10g/L时,转化率仍达到99%以上,ee值达到99%以上,并且产物亚砜不会进一步氧化为砜副产物。相对于其他不对称氧化制备方法,使用本发明方法制备所得的产物浓度高,光学纯度好,无副产物生成,反应条件温和,对环境友好,操作简便,易于工业放大,因此具有很好的工业应用前景。
附图说明
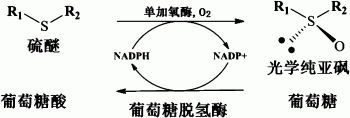
图1为本发明的单加氧酶不对称催化氧化硫醚化合物生成光学纯手性亚砜的反应过程示意图。
具体实施例
本发明提供的一种Bradyrhizobium oligotrophicum,是发明人进行了大规模土壤微生物筛选获得的。其中,土壤的采集主要分为两个部分,直接采集土样和预埋底物之后的土样采集,共252份土样。以兰索拉唑硫醚为导向,通过四轮的梯度富集培养不断提高兰索拉唑硫醚的浓度,通过初筛和复筛,从土壤中分离获得一种可以催化兰索拉唑硫醚氧化的菌株,命名为Bradyrhizobium oligotrophicum ECU1212;该命名采用属名(genus)+种名(species)+菌株代号的命名方式,其中, Bradyrhizobium表示属名,oligotrophicum表示种名,ECU1212表示菌株代号;本发明中将Bradyrhizobium译为慢生根瘤菌,或慢生根瘤菌属。
目前,该Bradyrhizobium oligotrophicum已经保藏于中国微生物菌种保藏管理委员会普通微生物中心(China General Microbiological Culture Collection Center,CGMCC,北京市朝阳区北辰西路1号院3号),保藏时间为:2018-01-15,其保藏编号为:CGMCCNo.15208。
该Bradyrhizobium oligotrophicum ECU1212具有以下生理生化特征:
在显微镜下观察呈杆状,不产生芽孢,革兰氏阴性,好氧,以氧为末端电子受体的严格呼吸型,以一根极毛或亚极毛运动;菌落呈圆形,不透明,罕见半透明,白色和凸起,有颗粒状结构,最适温度25~30℃,最适pH 6.0~8.0;在酵母膏-甘露醇-无机盐琼脂上5~7天的菌落不超过l mm,在5~7天或更长时间的液体培养物呈中度混浊。
该Bradyrhizobium oligotrophicum ECU1212的培养方法和培养条件没有特殊的限制,只要能使该Bradyrhizobium oligotrophicum ECU1212的菌株生长并产生本发明所述的单加氧酶即可。一种优选的培养基配方为:蛋白胨1g/L,肉汤提取物1 g/L,NaCl 0.5g/L,培养条件为:28℃。另一种优选的培养基配方为葡萄糖15g/L,蛋白胨5g/L,酵母粉5g/L,K2HPO4·3H2O 0.5g/L,KH2PO4 0.5g/L,NaCl 1.0g/L, MgSO4 0.5g/L,培养条件为:28℃。
可选地,使用该Bradyrhizobium oligotrophicum ECU1212培养收获的静息细胞不对称催化氧化兰索拉唑硫醚制备(R)-兰索拉唑,硫醚底物浓度为:0.1g/L,催化剂上载为10g/L,反应在30℃,180rpm搅拌条件下进行。兰索拉唑硫醚的转化率能够达到80%,产物的光学纯度达99%ee(R)。由此可知,该Bradyrhizobium oligotrophicum ECU1212中含有具有不对称催化氧化功能的功能性酶,且催化的转化率高,能够解决传统的生物催化剂在不对称催化氧化过程中转化率低的问题。
进一步地,本发明提供的Bradyrhizobium oligotrophicum ECU1212可以产生一种单加氧酶,该单加氧酶含有如SEQ ID No.2所示的氨基酸序列。
本发明的发明人通过实验发现,该Bradyrhizobium oligotrophicum ECU1212的静息细胞能够对硫醚化合物进行不对称催化氧化生成亚砜化合物,从而能够表明该Bradyrhizobium oligotrophicum ECU1212能够产生一种具有该催化功能的酶,并且具有编码该种酶的基因。因此,基于该Bradyrhizobium oligotrophicum ECU1212,本发明还分别提供了一种单加氧酶及其制备方法和应用、编码该单加氧酶的分离基因、含有该分离基因的重组表达载体以及重组表达转化体。
本发明提供的一种单加氧酶,是本发明发明人在筛选获得Bradyrhizobiumoligotrophicum ECU1212的基础上,通过生物信息学分析的策略,分析预测其中可能对硫醚具有明显氧化活性的单加氧酶的基因,并将其分选出来进行克隆表达,验证其功能获得的。采用这种方法,从中克隆获得一种具有高效不对称催化氧化硫醚底物获得手性亚砜的单加氧酶,该单加氧酶催化5种大位阻拉唑硫醚底物氧化产物的ee值高达99%,经测定,该单加氧酶含有如SEQ ID No.2所示的氨基酸序列。本发明中将该单加氧酶命名为BoTEMO(
进一步地,本发明还可以通过使如SEQ ID No.2所示的氨基酸序列发生突变获得突变氨基酸序列,以改造如SEQ ID No.2所示的氨基酸序列,即改造BoTEMO,获得了活性提高的单加氧酶。改造后的BoTEMO,本发明将其命名为BoTEMO突变体,该BoTEMO突变体含有如所述SEQ ID No.2所示的氨基酸序列发生突变后的突变氨基酸序列。
可选地,采用随机突变策略对BoTEMO进行突变改造,以兰索拉唑硫醚为筛选底物,经过对10,000突变体库初筛、复筛获得由SEQ ID No.2所示氨基酸序列经过突变,即经过取代、缺失或添加一个或多个氨基酸而得到的酶活性提高的衍生蛋白质--BoTEMO突变体。
突变改造后的BoTEMO,即BoTEMO突变体的氨基酸序列(即如SEQ ID No.2 所示的氨基酸序列的发生突变后的突变氨基酸序列,也就是说相对于BoTEMO的氨基酸序列的突变氨基酸序列),优选地为如SEQ ID No.2所示的氨基酸序列中任意1~5个氨基酸发生替换而生成的氨基酸序列。
进一步地,BoTEMO突变体的氨基酸序列优选为如SEQ ID No.2所示的氨基酸序列中第295位、第357位、第394位、第395位、第396位氨基酸中一个或多个发生替换而生成的氨基酸序列。
更进一步地,BoTEMO突变体的氨基酸序列优选为如SEQ ID No.2所示的氨基酸序列中第295位、第395位、第396位氨基酸中一个或多个发生替换而生成的氨基酸序列;或者优选为如SEQ ID No.2所示的氨基酸序列中第357位、第394 位氨基酸中一个或两个发生替换而生成的氨基酸序列。
例如,可以是如SEQ ID No.2所示的氨基酸序列中第295位的Asp替换为Cys;如SEQID No.2所示的氨基酸序列中第357位的Ser替换为Ile;如SEQ ID No.2 所示的氨基酸序列中第394位的Phe替换为Ala;如SEQ ID No.2所示的氨基酸序列中第395位的Ser替换为Leu;如SEQ ID No.2所示的氨基酸序列中第396位的 Trp替换为Ala。
相应地,依据BoTEMO突变体的氨基酸序列,本领域技术人员可以根据生物学的基本知识,确定编码相应BoTEMO突变体的核苷酸序列,即BoTEMO突变体的氨基酸序列对应的核苷酸序列。
可选地,本发明提供的一种活性提高的BoTEMO突变体的氨基酸序列如SEQ IDNo.4所示的氨基酸序列,相应地,该氨基酸序列可以通过如SEQ ID No.3所示的核苷酸序列编码获得。
可选地,本发明还提供的一种活性提高的BoTEMO突变体的氨基酸序列如 SEQ IDNo.6所示的氨基酸序列,相应地,该氨基酸序列可以通过如SEQ ID No.5 所示的核苷酸序列编码。
需要说明的是,在本发明中没有特别指出时,单加氧酶指的是BoTEMO或 BoTEMO突变体中的任意一种或多种。
本发明还提供了一种分离基因,该分离基因含有如SEQ ID No.1所示的核苷酸序列;或,该分离基因含有如SEQ ID No.1所示的核苷酸序列发生突变后的突变核苷酸序列。相应地,上述分离基因能够编码上述单加氧酶。
可选地,编码本发明的BoTEMO的分离基因的来源有:以Bradyrhizobiumoligotrophicum ECU1212的基因组DNA为模板,采用本领域常规技术方法,如聚合酶链反应(PCR),获得编码上述BoTEMO的完整DNA核苷酸分子。并根据基因组分析设计的合成该分离基因的引物对。
可选地,用于制备上述分离基因的引物对的正向引物以及反向引物含有如下所示的核苷酸序列:
正向引物:CCG
反向引物:CCG
其中,正向引物中以下划线标出的为Nde I酶切位点,反向引物中以下划线标出的为Hind III酶切位点。然后以Bradyrhizobium oligotrophicum ECU1212的基因组DNA为模板,利用PCR进行基因扩增,获得BoTEMO全长基因的PCR产物。
具体地,本发明提供的一种分离基因的核苷酸序列如SEQ ID No.1所示,全长1461bp,其起始密码子为ATG,终止密码子为TGA,编码序列(CDS)从第1个碱基起至第1461个碱基,所编码的蛋白质BoTEMO的氨基酸序列如SEQ ID No.2 所示。
进一步地,由于密码子的简并性,编码如SEQ ID No.2所示的氨基酸序列的核苷酸序列不仅仅局限于如SEQ ID No.1所示的核苷酸序列。本领域技术人员可以通过适当引入替换、缺失、改变、插入或增加来获得如SEQ ID No.1所示的核苷酸序列发生突变后的突变核苷酸序列,即本发明涵盖这些突变核苷酸序列,只要其表达的单加氧酶保持硫醚不对称催化氧化活性即可。
本发明中如SEQ ID No.1所示核苷酸序列的发生突变后的突变核苷酸序列可以通过对如SEQ ID No.1所示的核苷酸序列中的一个或多个核苷酸在保持活性范围内进行替换、缺失或增加来制得。
本发明提供的如SEQ ID No.1所示的核苷酸序列能够编码BoTEMO,如SEQ ID No.1所示的核苷酸序列发生突变后的突变核苷酸序列能够编码BoTEMO或 BoTEMO突变体中的任意一种。
相应地,本发明还提供了一种重组表达载体,该重组表达载体包含如上所述的分离基因。
具体可选地,重组表达载体可通过本领域常规方法将本发明的分离基因的核苷酸序列连接于各种合适载体上构建而成。其中,载体可以是本领域的各种常规载体,如市售的质粒、粘粒、噬菌体或病毒载体等;进一步地,载体优选质粒,根据本领域常规的技术手段制备的重组表达载体为重组表达质粒,更优选的质粒为质粒 pET28a。本发明的分离基因可以操作性连接于表达合适的调控序列,以实现所述单加氧酶的组成型或诱导型表达。
可选地,本发明的重组表达载体可通过下述示例性方法制得:通过PCR扩增获得的包含分离基因的PCR产物,用限制性内切酶NdeI和HindIII双酶切,形成互补的黏性末端,同时将克隆载体基因片段和表达载体pET28a用限制性内切酶 NdeI和HindIII双酶切,经T4DNA连接酶连接经过酶切的基因片段和表达载体,形成含有本发明的BoTEMO的分离基因的重组表达质粒pET-BoTEMO。
进一步相应地,本发明还提供了一种重组表达转化体,该重组表达转化体包含如上所述的重组表达载体。
具体可选地,可通过将本发明的重组表达载体转化至宿主细胞中来制得重组表达转化体。其中,宿主细胞可以是本领域的各种常规宿主细胞,前提是能使该重组表达载体稳定地自行复制,且其所携带的单加氧酶的分离基因可被有效表达。本发明优选大肠杆菌,更优选大肠杆菌(E.coli)BL21(DE3)或大肠杆菌(E.coli)DH5α。
可选地,将重组表达质粒pET-BoTEMO转化至大肠杆菌(E.coli)BL21(DE3) 中,即可获得本发明优选的基因工程菌株,即重组大肠杆菌E.coli BL21 (DE3)/pET-BoTEMO。
本发明所述重组表达转化体的培养方法和培养条件没有特殊的限制,可以根据宿主细胞类型和培养方法等因素的不同按本领域普通知识进行适当的选择,只要使重组表达转化体能够生长并产生本发明所述的单加氧酶即可。所述重组表达转化体是大肠杆菌时,优选LB培养基,该培养基含有蛋白胨10g/L,酵母膏5g/L,NaCl 10g/L,pH 7.0。重组表达转化体的培养和单加氧酶的产生,可优选下述方法:将本发明涉及的重组大肠杆菌(优选E.coli BL21(DE3))接种至含卡那霉素的LB培养基中培养,当培养液的光密度OD600达到0.5-0.7(优选0.6)时,在终浓度为0.1-1.0 mmol/L(优选0.2mmol/L)的异丙基-β-D-硫代吡喃半乳糖苷(IPTG)的诱导下,即可高效表达本发明所述的单加氧酶。表达的单加氧酶可以通过生物学的常规方法分离获得。
即本发明公开了一种上述单加氧酶的制备方法,培养上述的重组表达转化体,然后从中分离单加氧酶。
本发明还提供了一种上述Bradyrhizobium oligotrophicum ECU1212或单加氧酶在不对称催化氧化潜手性硫醚化合物中的应用。可选地,Bradyrhizobium oligotrophicumECU1212可以是以其静息整细胞的形式用于不对称催化氧化潜手性硫醚化合物的应用中。
进一步可选地,潜手性硫醚化合物选自以下任一化学式所示的化合物:
其中,本发明中将上述化学式Ⅰ至Ⅸ的中文名称分别以苯甲硫醚、对甲基苯甲硫醚、对甲氧基苯甲硫醚、5-甲氧基-2-(甲基硫代)苯并咪唑、奥美拉唑硫醚、兰索拉唑硫醚、泮托托拉唑硫醚、雷贝拉唑硫醚、艾普拉唑硫醚进行叙述,当然,在其他文献中也可以以不同的命名方式命名。
进一步可选地,所述单加氧酶将所述潜手性硫醚化合物不对称催化氧化为亚砜化合物。
可选地,利用本发明的Bradyrhizobium oligotrophicum ECU1212或单加氧酶将硫醚不对称催化氧化生成光学活性的亚砜。涉及的具体反应条件如底物浓度、pH、缓冲液组成、酶用量等可按本领域此类反应的常规条件进行选择。进一步地,不对称催化氧化反应可在振荡或搅拌条件下进行。
具体而言,可按下述示例性方法进行:反应历程如附图1所示,在pH 8.0~10.0 的Tris-HCl缓冲液中,Tris-HCl缓冲液的浓度可以为0.05~0.2mol/L。在葡萄糖脱氢酶、葡萄糖和NADP+的存在下,在本发明的单加氧酶作用下,对硫醚进行不对称氧化反应,制得光学活性亚砜。优选如下:底物在反应液中的浓度为0.1-37g/L。本发明所述单加氧酶的酶活单位(U)定义为每分钟催化1μmol底物生成产物所需的酶量。在硫醚的不对称氧化时,为了进行辅酶循环,向反应体系中额外添加葡萄糖和来自巨大芽孢杆菌的葡萄糖脱氢酶(制备方法参见:Journal of Industrial Microbiology and Biotechnology 2011,38,633-641)。通过葡萄糖脱氢酶催化葡萄糖氧化,使NADP+转化为NADPH。取决于不同反应体系,葡萄糖脱氢酶的活力单位可以与本发明所述单加氧酶的活力单位相当。葡萄糖的用量可以为2~20mmol/L,额外添加的NADP+的用量可以为0~1mmol/L。所述的不对称氧化反应的温度可以为20~35℃,优选25℃。不对称氧化反应结束后,可按本领域常规方法,从反应混合液中提取手性亚砜产物。
本发明提供的一种Bradyrhizobium oligotrophicum ECU1212,由该Bradyrhizobium oligotrophicum ECU1212能够衍生出一种单加氧酶,可以高效不对称催化氧化硫醚化合物以生成光学纯手性亚砜化合物,具有高效、高立体选择性以及高转化率的特点。例如,在兰索拉唑硫醚底物浓度达到10g/L时,转化率仍达到99%以上,ee值达到99%以上,并且产物亚砜不会进一步氧化为砜副产物。相对于其他不对称氧化制备方法,使用本发明方法制备所得的产物浓度高,光学纯度好,无副产物生成,反应条件温和,对环境友好,操作简便,易于工业放大,因此具有很好的工业应用前景。
进一步的,本发明下列实施例中的材料来源为:
Bradyrhizobium oligotrophicum ECU1212,CGMCC No.15208。
表达质粒pET28a购自上海Novagen公司。
E.coli DH5α和E.coli BL21(DE3)感受态细胞,2×Taq PCR MasterMix,琼脂糖凝胶DNA回收试剂盒均购自北京天根生化科技有限公司。
除非另有说明,本发明所用的试剂和原料均为市售可得。
本说明书中,除非另有注明具体条件,实施例中各实验方法均按照常规方法和条件或按照试剂说明书进行。
实施例1
Bradyrhizobium oligotrophicum ECU1212的筛选
土壤的采集主要分为两个部分,直接采集土样和预埋底物之后的土样采集,共252份土样。
直接土样采集:采集较为湿润的土壤,一般多为水源、植物、受污染底物等处,挖取距地面2-3cm处的土壤,大约3-5g,使用后的土样放于低温、干燥处保存,也可直接放在1.5mL Eppendorf管中后置于4℃冰箱中保存。采集地点如下:上海奉贤化工区、新华医院、果园、菜场、垃圾箱附近、河道附近、绿化带、校园(华东理工大学徐汇或奉贤校区)、居民区绿化、植物园等。
预埋底物:兰索拉唑硫醚为白色粉末状,难溶于水但溶于二甲基亚砜(DMSO),因此使用了两种不同的形式在多个地点进行预埋,地点选择多为植被丰富,微生物群可能具有被驯化的潜力处。第一种是直接将白色粉末预埋至土壤离地大约5cm 处,第二种是将兰索拉唑硫醚溶于二甲基亚砜(DMSO)后,浇至土壤表面。
在对选定的菌种进行表征和培养条件优化之前,所有的反应都在30℃下进行,试管中培养基的装载量为4mL,摇床的转速设置为180r/min。筛选的过程采取了四轮富集培养,并且采用了梯度培养的方法,即酵母粉的浓度在每一轮培养过程中减半,而底物浓度在每一轮培养过程中翻倍。平板培养在30℃的恒温箱内进行。
由于非天然底物兰索拉唑硫醚对大部分野生菌来说都是难以利用的,252份土样进行四轮富集培养之后,菌体生长良好的样品只有124份,经过初筛有21份培养液中含有产物兰索拉唑,且转化率>1%。初筛得到的21份培养液中,划线得到了81个单菌,单独培养后用0.33g/L底物浓度做24h的转化反应之后,将活力最高的菌株进行16S rDNA验证,测序结果在NCBI数据库中检索并与同源序列比对后发现,该菌株和Bradyrhizobiumoligotrophicum的序列一致性为99%,因此命名为Bradyrhizobium oligotrophicumECU1212。
实施例2
Bradyrhizobium oligotrophicum ECU1212静息细胞的制备
将如实施例1筛选获得的Bradyrhizobium oligotrophicum ECU1212接种至丰富培养基(葡萄糖15g/L,蛋白胨10g/L,酵母膏5g/L,NaH2PO4 0.5g/L,MgSO4 0.5 g/L,NaCl10g/L,pH 7.0)中,28℃、180rpm摇床振摇培养24小时后,5000×g 离心10min,收集湿细胞。所收集的湿细胞在-80℃下冷冻12h后,用冷冻干燥机低温干燥20h,得到冻干细胞,储存在4℃冰箱内。
实施例3
BoTEMO的分离基因的克隆
在筛选获得Bradyrhizobium oligotrophicum ECU1212的基础上,本发明通过生物信息学分析的策略,分析预测其中可能对硫醚具有明显不对称催化氧化活性的酶的基因,并将其分选出来进行克隆表达,验证其功能。采用这种方法,从 Bradyrhizobiumoligotrophicum ECU1212中克隆获得一个种能够产生高效不对称催化氧化硫醚底物的BoTEMO的分离基因。
本发明的BoTEMO(Bradyrhizobium oligotrophicum ECU1212硫醚单加氧酶,Bradyrhizobium oligotrophicum ECU1212Thioether Monooxygenase)催化5种大位阻拉唑硫醚底物氧化产物的ee值高达99%。相比于传统的生物催化剂,能够显著提高产物的光学纯度。
可选地,本发明的BoTEMO分离基因较佳的来源为Bradyrhizobiumoligotrophicum ECU1212的基因组DNA为模板,采用本领域常规技术方法(如聚合酶链反应,PCR),获得编码所述BoTEMO的完整核酸分子。
可选地,在本实施例中,引物对的核苷酸序列如下:
正向引物:CCG
反向引物:CCG
其中,正向引物中带下划线部分为NdeI酶切位点,反向引物中带下划线部分为HindIII酶切位点。以如实施例1所述方法制备的Bradyrhizobium oligotrophicumECU1212的基因组DNA为模板,利用聚合酶链式反应(PCR)进行基因扩增。
可选地,PCR体系为:2×Taq PCR MasterMix 25μl,正向引物和反向引物各 1.5μl(0.3μmol/L),DNA模板1.5μl(0.1μg),DMSO 2μl和ddH2O 19μl。PCR扩增步骤为:(1)95℃,预变性3min;(2)94℃,变性1min;(3)55℃退火30s;(4) 72℃延伸2min;步骤(2)~(4)重复30次;(5)72℃继续延伸10min,冷却至12℃。 PCR产物经琼脂糖凝胶电泳纯化,利用琼脂糖凝胶DNA回收试剂盒回收 1400~1600bp区间的目标条带。
其中包含的分离基因核苷酸序列,全长1461bp,其核苷酸序列如SEQ ID No.1 所示。其起始密码子为ATG,终止密码子为TGA,编码序列(CDS)从第1个碱基起至第1461个碱基,所编码的单加氧酶的氨基酸序列如SEQ ID No.2所示。
实施例4
重组表达质粒和重组表达转化体的制备
将如实施例3所示方法克隆的包含分离基因的PCR产物在37℃用限制性内切酶NdeI和HindIII双酶切12小时,经琼脂糖凝胶电泳纯化,利用琼脂糖凝胶DNA 回收试剂盒回收目标片段。在T4DNA连接酶的作用下,将目标片段与同样经NdeI 和HindIII酶切后的载体质粒pET28a,在16℃下连接过夜得到重组表达质粒 pET-BoTEMO。
将上述重组表达质粒转化到大肠杆菌E.coli DH5α感受态细胞中,在含有卡那霉素的抗性平板上对阳性重组体进行筛选,挑取单克隆,菌落PCR验证阳性克隆。培养重组菌,待质粒扩增后提取质粒,重新转化至大肠杆菌E.coli BL21(DE3)感受态细胞中,转化液涂布到含有卡那霉素的LB平板上,37℃倒置培养过夜,即获得阳性重组表达转化体大肠杆菌E.coli BL21(DE3)/pET-BoTEMO,菌落PCR证实为阳性克隆。
实施例5
重组BoTEMO的表达
将如实施例4所述的方法制备的重组表达转化体大肠杆菌E.coli BL21 (DE3)/pET-BoTEMO,接种至含50μg/mL卡那霉素的LB培养基(蛋白胨10g/L,酵母膏5g/L,NaCl 10g/L,pH 7.0)中,37℃、180rpm摇床振摇培养,当培养液的OD600达到0.6时,加入终浓度为0.2mmol/L的IPTG作为诱导剂,16℃诱导 16小时后,将培养液离心,收集细胞,并用生理盐水洗涤两次,得静息细胞。将 100mL发酵液所得的静息细胞悬浮于10mL pH 7.0的缓冲液中,在冰水浴的条件下进行超声破碎(超声破碎仪的设定功率为400W,工作4s,间歇6s,共循环99 次)。破碎液在4℃低温离心机里15000rpm离心40min,获得上清粗酶液进行活力测定以及蛋白纯化。
所收集的粗酶液在-80℃下冷冻12h后,用真空冷冻干燥机低温干燥20h,即可得到冻干粗酶粉,储存在4℃冰箱内。冻干粗酶粉对苯甲硫醚的活力为0.2 U/mg。粗酶液经聚丙烯酰胺凝胶电泳图分析,重组蛋白在细胞中以部分可溶的形式存在,另外有部分蛋白存在于细胞碎片中。
纯化实验全部使用镍亲和自装柱完成,纯化过程中使用的缓冲液为:A液:50 mMKPB,500mM NaCl,10mM咪唑,2mMβ-巯基乙醇,pH 8.0;B液:50mM KPB,500mM NaCl,300mM咪唑,2mMβ-巯基乙醇,pH 8.0;C液:50mM KPB, 150mM NaCl,1mM DTT,pH 9.0。纯化方法如下:
1)菌体用A液重新悬浮后进行超声破碎,破碎后的粗酶液用低温高速离心机在4℃离心,12000rpm离心30min,离心后的上清液暂时保存在4℃冰箱或冷库里;
2)Ni柱用5~10倍柱体积的A液预先平衡;
3)保存的上清液上样;
4)上样完成后用5~10倍柱体积的A和B混合液(5%B液)洗去杂蛋白;
5)用1个柱体积的B液洗脱目的蛋白并收集;
6)收集到的目的蛋白用30kDa的超滤管进行浓缩,浓缩至500μl时添加5ml C液继续超滤浓缩,重复3~5次以除去酶液中的咪唑并降低盐浓度,完成缓冲液的置换;
7)置换后的酶液用液氮速冻后保存于-80℃冰箱。
实施例6
重组BoTEMO和葡萄糖脱氢酶活力的测定
利用分光光度计,通过检测340nm处吸光值的变化来测定BoTEMO和葡萄糖脱氢酶的活力。
BoTEMO活力的测定方法如下:1mL反应体系(100mmol/L Tris-HCl缓冲液, pH9.0)中,加入1mmol/L苯甲硫醚,0.2mmol/L NADPH,30℃保温2分钟后加入实施例5制备的适量粗酶液,迅速混匀,检测340nm处吸光值的变化。测得该粗酶液的比活为101mU/mL。
葡萄糖脱氢酶活力的测定方法如下:1mL反应体系(100mmol/L磷酸钠缓冲液,pH7.0)中,加入10mmol/L葡萄糖,1mmol/L NADP
酶活力的计算公式为:酶活力(U)=EW×V×10
式中,EW为1分钟内340nm处吸光度的变化;V为反应液的体积,单位为 ml;6220为NADPH的摩尔消光系数,单位为L/(mol·cm);1为光程距离,单位为 cm。每单位BoTEMO的定义为在上述条件下每分钟催化1μmol NADPH氧化所需的酶量。每单位葡萄糖脱氢酶的定义为在上述条件下,每分钟催化1μmol NADP
实施例7
重组BoTEMO对一系列硫醚的活力测定
在0.5mL磷酸钾缓冲液(100mmol/L,pH 9.0)中加入BoTEMO纯酶(如实施例5所述方法制备的BoTEMO纯酶),加入溶解于DMSO中的硫醚底物,硫醚的终浓度为0.2~2mmol/L,DMSO的终浓度为2%(v/v)、加入终浓度为0.2~2mmol/L的 NADPH。在25℃,1000rpm振荡反应1小时。反应结束后加入0.6mL乙酸乙酯进行萃取,萃取液加入无水硫酸钠干燥,吸取有机相清液并过夜挥发除去溶剂,然后加入0.5mL异丙醇溶解,分析测定产物的ee值。
产物转化率及ee值的具体分析条件如下:
使用高效液相色谱仪进行分析,色谱柱为手性OD-H柱(250mm×4.6mm,5 μmparticle size,Daicel),流动相为正己烷:异丙醇=93:7,流速1mL/min,在254nm 处紫外检测。或AS-H柱(250mm×4.6mm,5μm particle size,Daicel),流动相为正己烷:异丙醇=55:45,流速0.5mL/min,在254nm处紫外检测。
进一步按实施例6所述方法测定BoTEMO催化一系列硫醚底物不对称氧化生成光学活性亚砜的活力,测定结果如表1所示。
表1.BoTEMO纯酶比活测定
实施例8
Bradyrhizobium oligotrophicum ECU1212整静息细胞不对称催化氧化苯甲硫醚
在100mLTris-HCl缓冲液(100mmol/L,pH 9.0)中加入Bradyrhizobiumoligotrophicum ECU1212的1g冻干细胞(如实施例2所述制备的冻干细胞),加入苯甲硫醚、甲醇至终浓度为37g/L、10%(v/v)。在28℃,180rpm搅拌反应,间歇取样100μL。取样后加入0.6mL乙酸乙酯进行萃取,萃取液加入无水硫酸钠干燥,挥发除去溶剂,然后加入0.5mL异丙醇溶解,按如实施例7所述方法分析测定底物转化率和产物ee值。24h时底物的转化率大于99%,产物的ee值大于 99%(S)。
实施例9
重组BoTEMO不对称催化氧化苯甲硫醚
在0.5mL磷酸钾缓冲液(100mmol/L,pH 9.0)中加入BoTEMO粗酶液100μL (如实施例5所述方法制备的粗酶液)和葡萄糖脱氢酶粗酶液,加入苯甲硫醚、甲醇、 NADP
实施例10
重组BoTEMO不对称催化氧化奥美拉唑硫醚
在0.5mL磷酸钾缓冲液(100mmol/L,pH 9.0)中加入BoTEMO粗酶液100μL (如实施例5所述方法制备的粗酶液)和葡萄糖脱氢酶粗酶液,加入奥美拉唑硫醚、甲醇、NADP
实施例11-15
重组BoTEMO不对称催化氧化系列拉唑硫醚
在10mL磷酸钾缓冲液(100mmol/L,pH 9.0)中加入BoTEMO冻干粗酶粉0.1 g(如实施例5所述方法制备的粗酶粉和葡萄糖脱氢酶冻干酶粉(15U/mg)0.02g,加入奥美拉唑硫醚/兰索拉唑硫醚/泮托拉唑硫醚/雷贝拉唑硫醚/艾普拉唑硫醚1~3 g/L、甲醇10%(v/v)、NADP
测得BoTEMO以上述条件不对称催化氧化5种拉唑前体硫醚-大位阻硫醚化合物,反应24h所得底物的转化率大于90%,产物ee值大于99%。测定结果如表 2所示:
表2
实施例16
重组BoTEMO不对称催化氧化奥美拉唑硫醚
在100mLTris-HCl缓冲液(100mmol/L,pH 9.0)中加入BoTEMO冻干粗酶粉1 g(如实施例5所述方法制备的粗酶粉)和葡萄糖脱氢酶冻干酶粉0.2g,加入奥美拉唑硫醚、甲醇、NADP
实施例17
重组BoTEMO不对称催化氧化兰索拉唑硫醚
在10mLTris-HCl缓冲液(100mmol/L,pH 9.0)中加入BoTEMO冻干粗酶粉0.2 g(如实施例5所述制备的粗酶粉)和葡萄糖脱氢酶冻干酶粉0.02g,加入兰索拉唑硫醚、甲醇、NADP
实施例18
BoTEMO的突变
对实施例3所得的BoTEMO全长基因序列(如SEQ ID No.1所述的核苷酸酸序列)进行定点突变,得到两个突变体:
1)将编码BoTEMO的核苷酸序列的第883位的G突变为T,第884位的 A突变为G,第1184位的C突变为T,第1186位的T突变为G,第1187位的G突变为C,从而得到如SEQ ID No.3所示的突变基因的核苷酸序列。其编码的氨基酸序列为SEQ ID No.4,即将BoTEMO(如SEQID No.2所述的氨基酸序列)的第295位的Asp突变为Cys,第395位的Ser突变为Leu,第396位的 Trp突变为Ala,该突变基因所编码的单加氧酶命名为BoTEMO-M1。
2)将编码BoTEMO的核苷酸序列的第1070位的G突变为T,第1180位的T突变为G,第1181位的T突变为C,第1182位的C突变为A,从而得到如SEQ ID No.5所示的突变基因的核苷酸序列。其编码的氨基酸序列为SEQ ID No.6,即将BoTEMO(如SEQ ID No.2所示的氨基酸序列)的第357位的Ser突变为Ile,第394位的Phe突变为Ala,该突变基因所编码的单加氧酶命名为 BoTEMO-M2。
按如实施例4所述的方法分别用上述BoTEMO-M1以及BoTEMO-M2两个突变基因制备重组转化体,并按照如实施例5所述的方法制备静息细胞和冻干粗酶粉,进一步按照如实施例6所述的酶活力测定方法测定BoTEMO-M1以及 BoTEMO-M2的酶活力,BoTEMO-M1和BoTEMO-M2的酶活力分别是BoTEMO 的7.6倍(BoTEMO-M1)和1.6倍(BoTEMO-M2),对兰索拉唑硫醚的活力达到20U/g(BoTEMO-M1)和4.2U/g(BoTEMO-M2)。
实施例19
BoTEMO-M1不对称催化氧化兰索拉唑硫醚
在100mLTris-HCl缓冲液(100mmol/L,pH 9.0)中加入BoTEMO-M1冻干粗酶粉1g和葡萄糖脱氢酶粗酶0.2g,加入兰索拉唑硫醚、甲醇、NADP
实施例20
BoTEMO-M2不对称催化氧化兰索拉唑硫醚
在100mL Tris-HCl缓冲液(100mmol/L,pH 9.0)中加入BoTEMO-M2冻干粗酶粉1g和葡萄糖脱氢酶粗酶0.2g,加入兰索拉唑硫醚、甲醇、NADP
实施例21
BoTEMO-M1不对称催化氧化兰索拉唑硫醚
在2L Tris-HCl缓冲液(100mmol/L,pH 9.0)中加入BoTEMO-M1冻干粗酶粉 20g和葡萄糖脱氢酶粗酶4g,加入兰索拉唑硫醚、甲醇、NADP
应理解,在阅读了本发明的上述内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。
序列表
<110> 华东理工大学
江苏奥赛康药业股份有限公司
<120> 一种慢生根瘤菌单加氧酶及其在制备手性亚砜中的应用
<160> 6
<170> Patent In version 3.5
<210> 1
<211> 1461
<212> DNA
<213> Bradyrhizobium oligotrophicum ECU1212
<400> 1
atgtcaactg agcatgtcga cgtgctgatc gtcggtgccg ggctgtccgg catcgccgcc 60
gcctatcatc tgcagcacaa atgtccgggc aagcgcttcg ccctcctgga ggggcgcggt 120
gcgctcggcg gcacctggga cctgttccgc tatcccggca tccgctcgga cagcgacatg 180
tacacgctcg gctattcgtt caagccgtgg accgatccga aagccatcgc cgacgggccg 240
cagatcctca aatatgtcca ggacaccgcg accgagaacg gcatcgaccg ccacatccgt 300
ttcaatcatc gcgtccgccg cgcctcgtgg tcgagcgcgg acgcacgctg gacggtcgag 360
gccgagcggc agacggcgca gggcacgacg gaaaccgtgt cgatgacatg cggcttcctt 420
ttcatgtgct ccggctacta ccgctatgag aaaggctatc tgccggactt caagggcatg 480
gccgatttca agggccgcat cgtgcatccg caggcctggc ccgccgacct cgactatgcc 540
ggcaaacgcg tcgtcgtgat cggctccggt gcgacggcgg tgacgctggt gccggcaatg 600
gccaagaccg cggcgcacgt gacgatgctg cagcgctcgc cgacctatgt cgtgtcgcgc 660
ccggcgcagg atgcgctcgc caacaagctg cgcgagcacc tcccggctgg tctcgcctat 720
catctgatcc gctggcgcaa cgtgctgttc gggatgtatt tcttccagct cagccgccgc 780
aagccgcagc gggtcaagca gctgatatta gggggcgtgc gcgccgcgct tggccccgac 840
tacgacgtcg ccacccattt cacgccgcgc tacaacccgt gggaccagcg gttgtgcctg 900
gtgccggatg gcgacctgtt caggaccatc cgcgagcagc gggcgtcggt ggtgacagcc 960
gggatcgaca cgttcaccga gcgcggcctg cgcctctccg acggccgcga gctcgaggcc 1020
gaaatcgtgg tgaccgcgac ggggctggtg ctgcaggttc tcggcggcag cgaggtcgtg 1080
gtcgacggcc gcacggtcga ttttgccaag acgctcaact acaagggcat gatgtattcc 1140
gacgtgccca acatggcggc caccctcggc tacacgaact tctcgtggac gctgaaatgc 1200
gatctcacct gcgaatatgt ctgccgtctc ctcaactaca tggatcgcca tggctatcgc 1260
caatgcgtgc cgcacaacga cgacaccacc gtcacgccgc tgccgtcgct gagcttcagc 1320
tccggctatg tgcagcgctc gattgccgac ctgcccaagc aaggctcgaa gcggccgtgg 1380
cggctgtacc agaactacgc gctggatatc gtctcgctgc ggttcggcaa ggtcgatgat 1440
ggggtgatgc ggtattcgtg a 1461
<210> 2
<211> 486
<212> PRT
<213> Bradyrhizobium oligotrophicum ECU1212
<400> 2
Met Ser Thr Glu His Val Asp Val Leu Ile Val Gly Ala Gly Leu Ser
1 5 1015
Gly Ile Ala Ala Ala Tyr His Leu Gln His Lys Cys Pro Gly Lys Arg
202530
Phe Ala Leu Leu Glu Gly Arg Gly Ala Leu Gly Gly Thr Trp Asp Leu
354045
Phe Arg Tyr Pro Gly Ile Arg Ser Asp Ser Asp Met Tyr Thr Leu Gly
505560
Tyr Ser Phe Lys Pro Trp Thr Asp Pro Lys Ala Ile Ala Asp Gly Pro
65707580
Gln Ile Leu Lys Tyr Val Gln Asp Thr Ala Thr Glu Asn Gly Ile Asp
859095
Arg His Ile Arg Phe Asn His Arg Val Arg Arg Ala Ser Trp Ser Ser
100 105 110
Ala Asp Ala Arg Trp Thr Val Glu Ala Glu Arg Gln Thr Ala Gln Gly
115 120 125
Thr Thr Glu Thr Val Ser Met Thr Cys Gly Phe Leu Phe Met Cys Ser
130 135 140
Gly Tyr Tyr Arg Tyr Glu Lys Gly Tyr Leu Pro Asp Phe Lys Gly Met
145 150 155 160
Ala Asp Phe Lys Gly Arg Ile Val His Pro Gln Ala Trp Pro Ala Asp
165 170 175
Leu Asp Tyr Ala Gly Lys Arg Val Val Val Ile Gly Ser Gly Ala Thr
180 185 190
Ala Val Thr Leu Val Pro Ala Met Ala Lys Thr Ala Ala His Val Thr
195 200 205
Met Leu Gln Arg Ser Pro Thr Tyr Val Val Ser Arg Pro Ala Gln Asp
210 215 220
Ala Leu Ala Asn Lys Leu Arg Glu His Leu Pro Ala Gly Leu Ala Tyr
225 230 235 240
His Leu Ile Arg Trp Arg Asn Val Leu Phe Gly Met Tyr Phe Phe Gln
245 250 255
Leu Ser Arg Arg Lys Pro Gln Arg Val Lys Gln Leu Ile Leu Gly Gly
260 265 270
Val Arg Ala Ala Leu Gly Pro Asp Tyr Asp Val Ala Thr His Phe Thr
275 280 285
Pro Arg Tyr Asn Pro Trp Asp Gln Arg Leu Cys Leu Val Pro Asp Gly
290 295 300
Asp Leu Phe Arg Thr Ile Arg Glu Gln Arg Ala Ser Val Val Thr Ala
305 310 315 320
Gly Ile Asp Thr Phe Thr Glu Arg Gly Leu Arg Leu Ser Asp Gly Arg
325 330 335
Glu Leu Glu Ala Glu Ile Val Val Thr Ala Thr Gly Leu Val Leu Gln
340 345 350
Val Leu Gly Gly Ser Glu Val Val Val Asp Gly Arg Thr Val Asp Phe
355 360 365
Ala Lys Thr Leu Asn Tyr Lys Gly Met Met Tyr Ser Asp Val Pro Asn
370 375 380
Met Ala Ala Thr Leu Gly Tyr Thr Asn Phe Ser Trp Thr Leu Lys Cys
385 390 395 400
Asp Leu Thr Cys Glu Tyr Val Cys Arg Leu Leu Asn Tyr Met Asp Arg
405 410 415
His Gly Tyr Arg Gln Cys Val Pro His Asn Asp Asp Thr Thr Val Thr
420 425 430
Pro
一种慢生根瘤菌单加氧酶及其在制备手性亚砜中的应用专利购买费用说明
![]()
Q:办理专利转让的流程及所需资料
A:专利权人变更需要办理著录项目变更手续,有代理机构的,变更手续应当由代理机构办理。
1:专利变更应当使用专利局统一制作的“著录项目变更申报书”提出。
2:按规定缴纳著录项目变更手续费。
3:同时提交相关证明文件原件。
4:专利权转移的,变更后的专利权人委托新专利代理机构的,应当提交变更后的全体专利申请人签字或者盖章的委托书。
Q:专利著录项目变更费用如何缴交
A:(1)直接到国家知识产权局受理大厅收费窗口缴纳,(2)通过代办处缴纳,(3)通过邮局或者银行汇款,更多缴纳方式
Q:专利转让变更,多久能出结果
A:著录项目变更请求书递交后,一般1-2个月左右就会收到通知,国家知识产权局会下达《转让手续合格通知书》。
动态评分
0.0