IPC分类号 : B01J31/24,C07F9/6561,C07D207/16,C07B37/02,C07B37/04,C07B35/02
专利摘要
本发明公开了一种新型多功能膦/酰胺配体催化剂及其合成和应用。所述催化剂具有式(Ⅰ)或(Ⅱ)所示的结构。本发明科学设计催化剂的分子结构,使其可以很好地与金属Lewis酸络合可形成一个新的催化体系即碱-Lewis酸体系,此体系对参与反应的亲核试剂和亲电试剂同时进行活化,共同控制反应中的过渡态,能有效的产生相应手性环境,具有更多的空间修饰其结构和改变金属Lewis酸以获得高的选择性。其中,式(Ⅰ)中,R为H、Me、Bn、Ph、iPr或tBu。
权利要求
1.一种新型多功能膦/酰胺配体催化剂,其特征在于,所述催化剂具有式(Ⅰ)或(Ⅱ)所示的结构:
其中,式(Ⅰ)中,R为H、Me、Bn、Ph、iPr或tBu。
2.权利要求1所述新型多功能膦/酰胺配体催化剂的应用,其特征在于,应用于与金属Lewis酸络合形成 碱-Lewis酸催化体系,用于催化不对称反应。
3.根据权利要求2所述的应用,其特征在于,应用于和碳酸银协同催化偶氮甲碱叶立德和马来酸二乙酯通过[3+2]环加成反应制备含有四氢吡咯环骨架的化合物方面。
4.根据权利要求2所述的应用,其特征在于,应用于[2+2]的环加成反应体系的催化方面。
5.根据权利要求2所述的应用,其特征在于,应用于Conia-Ene反应体系的催化方面。
6.权利要求1所述新型多功能膦/酰胺配体催化剂的合成方法,其特征在于,包括以下步骤:
S1.生物碱和α-氨基酸合成Boc保护的酰胺中间体;
S2.将步骤S1所得酰胺中间体溶于二氯甲烷中,在冰浴条件下将三氟乙酸的二氯甲烷分批加入酰胺中间体的二氯甲烷溶液,所得体系在常温下搅拌过夜;
S3.向步骤S2所述体系中加入饱和的NaHCO3溶液至无气泡产生,用CH2Cl2萃取,合并有机相,干燥旋转得浓缩液;
S4.在N2的保护下,将步骤S3所述浓缩液溶于二氯甲烷中,然后依次加入邻二苯基膦苯甲酸、DCC、DMAP和二异丙基乙胺,室温下搅拌至反应完全,用饱和的碳酸钠淬灭反应,用CH2Cl2萃取,合并有机相,干燥后减压浓缩;
S5.经硅胶短柱洗脱,减压浓缩即得。
7.根据权利要求6所述的合成方法,其特征在于,所述生物碱为奎宁、奎尼丁、辛可宁或辛可尼丁。
8.根据权利要求6所述的合成方法,其特征在于,步骤S5所述洗脱是采用EtOAc:MeOH:Et3N=15:1:0.05作为洗脱剂。
说明书
技术领域
本发明涉及一种新型催化剂合成技术领域,更具体地,涉及一种新型多功能膦/酰胺配体催化剂及其合成和应用。
背景技术
合成稳定、低成本和高效率的手性配体及催化剂的设计一直是不对称催化领域的核心任务之一,而发展新的催化体系,研究配体结构与催化性能之间的关系更具有重要的意义。在对手性配体及其催化性能关系的研究过程中,人们发现最直接影响配体催化效果的因素主要包括配体骨架的刚性、配体的空间立体结构和配位原子的电子效应等。而在手性配体的设计方面,不管是双膦配体、膦/亚胺配体还是膦/酰胺配体,其和金属络合催化不对称烯丙基烷基化、不对称氢化、共轭加成及不对称环丙烷化等反应时,与底物活化的方式大都通过以下两种单活化方式进行:(a)反应活性较低的亲电试剂与手性金属Lewis酸结合,从而被活化,然后亲核试剂与此“活化配合物”反应,生成对映异构体过量的产物;(b)反应活性较低的亲核试剂与手性金属Lewis酸结合,从而被活化,然后亲电试剂与此“活化配合物”反应,生成对映异构体过量的产物。然而,有许多不对称反应活性很低,以至于仅仅活化其中一个底物仍然难以获得相应的产物。因此在催化不对称合成领域中,从能诱导反应具有高活性和高立体选择性的角度来考虑,通过两个不同催化剂的组合形成一个大的双功能催化体系,使得亲电和亲核底物能够被分别活化是未来研究的导向之一。此催化体系除了含有活化亲核试剂的 /Lewis碱外,还含有活化亲电试剂的Lewis酸,它们之间相互作用共同控制反应的中间过渡态,有效地产生相应手性环境,如附图1所示(附图1来自于参考文献:(a)Paull,D.H.;Abraham,C.J.;Scerba,M.T.;Alden-Danforth,E.T.;Lectka,T.Acc.Chem.Res.2008,41,655-663.(b)丁奎岭;范青华《不对称催化新概念与新方法》,化学工业出版社(北京),2008:9.)。
奎宁、奎尼丁、辛可宁和辛可尼丁均是从金鸡纳树皮中提取得到的一类金鸡纳生物碱,通常作为手性选择剂应用于手性分析领域,α-氨基酸中除了甘氨酸之外,都是具有手性的,其衍生物也被广泛应用于催化不对称反应领域。但是,目前未见将生物碱和α-氨基酸通过多步简单反应合成新颖的多功能膦/酰胺配体催化剂的相关技术报道。
发明内容
本发明要解决的技术问题是针对现有手性配体催化剂及催化体系的技术不足,提供一种新型多功能膦/酰胺配体催化剂,基于本发明提供的配体催化剂,可和金属Lewis酸络合形成一个新的催化体系即 /Lewis碱-Lewis酸体系,此体系对参与反应的亲核试剂和亲电试剂同时进行活化,共同控制反应中的过渡态,能有效的产生相应手性环境。
本发明要解决的另一技术问题是提供所述新型多功能膦/酰胺配体催化剂的合成方法。
本发明要解决的还一技术问题是提供所述新型多功能膦/酰胺配体催化剂的应用。
本发明的目的通过以下技术方案予以实现:
提供一种生物碱和α-氨基酸衍生的新型多功能膦/酰胺配体催化剂,所述催化剂具有式(Ⅰ)或(Ⅱ)所示的结构:
其中,式(Ⅰ)中,R为H、Me、Bn、Ph、iPr或tBu。
本发明同时提供所述生物碱和α-氨基酸衍生的新型多功能膦/酰胺配体催化剂的合成方法,包括以下步骤:
S1.生物碱和α-氨基酸合成Boc保护的酰胺中间体;
S2.将步骤S1所得酰胺中间体溶于二氯甲烷中,在冰浴条件下将三氟乙酸的二氯甲烷分批加入酰胺中间体的二氯甲烷溶液,所得体系在常温下搅拌过夜;
S3.向步骤S2所述体系中加入饱和的NaHCO3溶液至无气泡产生,用CH2Cl2萃取,合并有机相,干燥旋转得浓缩液;
S4.在N2的保护下,将步骤S3所述浓缩液溶于二氯甲烷中,然后依次加入邻二苯基膦苯甲酸、DCC、DMAP和二异丙基乙胺,室温下搅拌至反应完全,用饱和的碳酸钠淬灭反应,用CH2Cl2萃取,合并有机相,干燥后减压浓缩;
S5.经硅胶短柱洗脱,减压浓缩即得。
优选地,所述生物碱包括但不限于奎宁、奎尼丁、辛可宁或辛可尼丁。
优选地,步骤S5所述洗脱是采用EtOAc:MeOH:Et3N=15:1:0.05作为洗脱剂。
本发明同时提供所述新型多功能膦/酰胺配体催化剂的的应用,具体是将此膦/酰胺配体催化剂和金属Lewis酸络合可形成一个新的催化体系即 /Lewis碱-Lewis酸体系用于催化不对称反应。
本发明具有以下有益效果:
本发明提供了一类新的膦/酰胺配体催化剂,通过科学设计催化剂的分子结构,使其可以很好地与金属Lewis酸络合可形成一个新的催化体系即 /Lewis碱-Lewis酸体系,此体系对参与反应的亲核试剂和亲电试剂同时进行活化,共同控制反应中的过渡态,能有效的产生相应手性环境;具有特有的刚性和空间立体结构,以及可以在氨基酸衍生的膦/酰胺配体部分对电子效应和位阻大小进行精细调控以适合和金属配位,这一点对于催化剂的分子设计非常重要,因为不对称反应的多样性,不存在能应用于所有反应的单一催化体系,当金鸡纳生物碱和a-氨基酸衍生的膦/酰胺配体和金属Lewis酸作用不同的反应时,有更多的空间修饰其结构和改变金属Lewis酸以获得高的选择性。
本发明膦/酰胺配体催化剂具有很大的实用和潜在价值,与不同金属结合不仅可以催化[3+2]的环加成反应、[2+2]的环加成反应、Conia-Ene反应及串联反应等,还可以催化各种不饱和键如羰基、烯烃、炔基、亚胺的氢化。
为获得所述膦/酰胺配体催化剂,本发明通过将生物碱和α-氨基酸结合,经多步简单反应合成了所述新颖的多功能膦/酰胺配体催化剂。奎宁、奎尼丁、辛可宁和或辛可尼丁等生物碱均是从金鸡纳树皮中提取得到的一类金鸡纳生物碱,具有特殊的刚性和空间立体结构,本发明创造性地发挥金生物碱分子骨架中的桥头氮原子不仅可以通过σ键与金属配位,也可以作为 /Lewis碱活化一些亲核试剂的优越性,将其与不同取代的α-氨基酸合成了所述催化剂,广泛应用于催化不对称反应领域。
本发明不仅为膦/酰胺配体催化剂提供了一类新成员,并为合成膦/酰胺配体催化剂提供了一种新方法,而且为开展其他类型不同、结构新颖独特的膦/酰胺配体催化剂的合成及其在不对称催化反应领域的应用研究开辟了一条途新径。
附图说明
图1具有代表性的不对称双活化催化模式示意图。
图2本发明膦/酰胺配体催化剂合成路线图(式(Ⅰ)所示结构的催化剂)。
图3本发明膦/酰胺配体催化剂合成路线图(式(Ⅱ)所示结构的催化剂)。
图4利用本发明膦/酰胺配体催化剂和碳酸银协同催化偶氮甲碱叶立德和马来酸二乙酯环加成反应的路线图。
图5本发明膦/酰胺配体催化剂的底物适应性研究反应路线图。
图6利用本发明膦/酰胺配体催化剂催化[2+2]环加成反应的路线图。
图7利用本发明手性膦/酰胺配体和金属(Cu、Pd、Au等试剂)协同催化末端炔基及联烯底物的Conia-Ene反应路线图。
图8利用本发明手性膦/酰胺配体和金属(Cu、Pd、Au等试剂)协同催化形成不对称碳-碳单键的反应路线图。
图9利用本发明手性膦/酰胺配体和金属络合通过双活化策略催化各种不饱和键如羰基、烯烃、炔基、亚胺等底物获得高的对映选择性及区域选择性反应路线图。
具体实施方式
下面结合具体实施例进一步说明本发明。下述实施例仅用于示例性说明,不能理解为对本发明的限制。除非特别说明,下述实施例中使用的试剂原料为常规市购或商业途径获得的试剂原料,除非特别说明,下述实施例中使用的方法和设备为本领域常规使用的方法和设备。
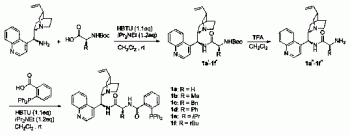
实施例1代表性膦/酰胺配体催化剂1a的合成
合成路线图如附图2所示。
将合成的Boc保护的酰胺中间体1a,(0.5mmol,225mg)(此中间体的合成参考文献:Zhu,Q.;Lu,Y.,Angew.Chem.Int.Ed.2010,49,7753.)溶于二氯甲烷(3.0mL)中加入到50mL的圆底烧瓶中,然后在冰浴下分批加入三氟乙酸(0.5mL)的二氯甲烷(2.0mL)溶液,在常温下搅拌过夜,TLC板检测原料消耗完毕后,向反应体系中加入饱和的NaHCO3溶液至无气泡产生,用CH2Cl2(10mL)萃取3次,合并有机相,干燥旋转得浓缩液,此浓缩液没有柱层析,直接用于下一步反应。在N2的保护下,将上步获得的浓缩液溶于二氯甲烷(15mL)中,加入到50mL的圆底烧瓶中,然后向反应瓶中依次加入邻二苯基膦苯甲酸(0.5mmol,153mg)、DCC(1.2mmol,124mg),DMAP(0.25mmol,31mg),二异丙基乙胺(1.0mmol,0.22mL),室温搅拌6h后,TLC检测至原料反应完全,用饱和的碳酸钠淬灭反应,用CH2Cl2(10mL)萃取3次,合并有机相,无水Na2SO4干燥,减压浓缩,用EtOAc:MeOH:Et3N=15:1:0.05作为洗脱剂,硅胶短柱洗脱,减压浓缩得到白色固体物质1a(223mg,70%)。
Mp.129-130℃;[α]D30=-11.7(c0.53,CH2Cl2);1H-NMR(400MHz,CDCl3)δ8.71(d,J=4.4Hz,1H),8.41(d,J=8.4Hz,1H),8.11(d,J=4.8Hz,1H),7.92(brs,1H),7.72(t,J=7.2Hz,1H),7.63-7.50(m,1H),7.49-7.47(m,1H),7.34-7.07(m,14H),5.68-5.59(m,2H),4.94(s,1H),4.90(d,J=6.4Hz,1H),4.21(dd,J=16.8,6.0Hz,1H),3.78(dd,J=16.8,4.0Hz,1H),3.17-3.11(m,3H),2.94(brs,2H),2.73-2.65(m,1H),2.61-2.56(m,1H),2.26(brs,1H),1.62-1.55(m,3H),1.42-1.36(m,1H),0.82-0.77(m,1H);13C-NMR(100MHz,CDCl3)(C-Pcouplingnotremoved)δ169.2,168.7,149.9,148.5,141.0,136.8,136.0,134.1,133.8,133.6,133.5,133.3,130.3,130.2,129.3,129.0,128.9,128.7,128.6,128.6,128.5,127.4,127.3,127.0,123.4,114.6,59.6,55.6,53.4,43.4,40.9,39.2,27.5,27.2,26.2;31P-NMR(162MHz,CDCl3)δ-11.1;HRMS(ESI):calcd.forC40H39N4O2P1[M+H]+639.2883,found639.2878.
实施例2代表性膦/酰胺配体催化剂1b的合成
合成方法参照实施例1。
Mp.130-132℃;[α]D30=-59.7(c1.13,CH2Cl2);1H-NMR(400MHz,CDCl3)δ8.69(d,J=4.4Hz,1H),8.37(d,J=8.4Hz,1H),8.08(d,J=8.4Hz,1H),7.84-7.83(m,1H),7.67(t,J=7.2Hz,1H),7.55(brs,1H),7.43(d,J=4.4Hz,1H),7.40-7.37(m,1H),7.34-7.16(m,11H),6.97-6.93(m,1H),6.46(d,J=7.2Hz,1H),5.73-5.64(m,1H),5.21(brs,1H),4.96-4.88(m,2H),4.55-4.48(m,1H),3.26-3.10(m,3H),2.75-2.71(m,3H),2.27(brs,1H),1.63-1.56(m,3H),1.39-1.32(m,1H),1.13(d,J=7.2Hz,3H),0.90-0.85(m,1H);13C-NMR(100MHz,CDCl3)(C-Pcouplingnotremoved)δ171.5,168.5,149.9,148.3,141.2,140.2,140.0,136.8,136.7,136.6,136.5,136.3,133.9,133.9,133.8,133.7,133.6,130.3,130.2,129.0,128.8,128.7,128.5,128.5,128.4,127.5,127.4,126.7,123.2,114.4,55.8,48.9,40.7,39.4,27.7,27.2,25.9,17.3;31P-NMR(162MHz,CDCl3)δ-9.8;HRMS(ESI):calcd.forC41H41N4O2P1[M+H]+653.3040,found653.3042.
实施例3代表性膦/酰胺配体催化剂1c的合成
合成方法参照实施例1。
Mp.100-102℃;[α]D30=-32.6(c1.06,CH2Cl2);1H-NMR(400MHz,CDCl3)δ8.77(d,J=4.4Hz,1H),8.34(d,J=7.6Hz,1H),8.11(d,J=9.2Hz,1H),7.71-7.68(m,1H),7.58-7.52(m,2H),7.36-7.16(m,16H),7.10-7.08(m,2H),7.00-6.97(m,1H),6.24(d,J=7.6Hz,1H),5.67-5.59(m,1H),5.31(brs,1H),4.93-4.87(m,2H),4.80(dd,J=14.4,7.2Hz,1H),3.15-3.10(m,1H),3.01-2.91(m,3H),2.63-2.60(m,1H),2.53-2.51(m,1H),2.22(brs,1H),1.83(brs,2H),1.59-1.52(m,3H),1.32-1.26(m,1H),0.87-0.83(m,1H);13C-NMR(100MHz,CDCl3)(C-Pcouplingnotremoved)δ170.2,168.7,150.0,148.5,141.3,137.1,137.0,136.5,136.4,136.2,134.4,133.8,133.7,133.6,133.6,133.4,130.4,129.4,129.0,128.8,128.7,128.6,127.5,127.4,126.8,126.7,123.3,114.5,60.0,55.8,54.6,40.7,39.5,37.3,27.8,27.4,25.9;31P-NMR(162MHz,CDCl3)δ-10.8;HRMS(ESI):calcd.forC47H45N4O2P1[M+H]+729.3353,found729.3358.
实施例4代表性膦/酰胺配体催化剂1d的合成
合成方法参照实施例1。
Mp.130-132℃.[α]D30=+22.0(c0.66,CH2Cl2).1H-NMR(400MHz,CDCl3)δ8.87(d,J=4.4Hz,1H),8.30(d,J=8.4Hz,1H),8.14(d,J=8.4Hz,1H),8.72(t,J=7.2Hz,1H),7.61-7.58(m,2H),7.52(brs,1H),7.45(brs,1H),7.27-7.09(m,17H),6.91(brs,1H),5.67-5.62(m,1H),5.49(d,J=6.0Hz,1H),5.07(brs,1H),4.95-4.89(m,2H),3.12-3.05(m,1H),2.98(brs,1H),2.63-2.58(m,1H),2.47(brs,1H),2.30-2.17(m,2H),1.76-1.64(m,1H),1.63-1.56(m,1H),1.53-1.40(m,2H),1.39-1.29(m,1H),0.93-0.88(m,1H);13C-NMR(100MHz,CDCl3)(C-Pcouplingnotremoved)δ170.0,168.3,150.1,148.5,140.5,140.3,137.5,137.3,137.2,137.1,137.0,136.6,136.4,134.3,133.8,133.6,130.5,130.3,129.1,128.8,128.6,128.5,128.4,128.3,128.1,127.8,127.7,127.2,126.8,123.1,114.7,57.5,55.5,40.3,39.3,38.6,27.5,27.2,25.8;31P-NMR(162MHz,CDCl3)δ-10.2;HRMS(ESI):calcd.forC46H43N4O2P1[M+H]+715.3196,found715.3192.
实施例5代表性膦/酰胺配体催化剂1e的合成
合成方法参照实施例1。
Mp124-126℃;[α]D30=-47.2(c1.13,CH2Cl2);1H-NMR(400MHz,CDCl3)δ8.79(d,J=4.4Hz,1H),8.36(d,J=8.0Hz,1H),8.11(d,J=8.4Hz,1H),7.70(t,J=7.2Hz,1H),7.58-7.52(m,2H),7.44-7.41(m,2H),7.32-7.20(m,10H),7.14-7.12(m,2H),6.97-6.94(m,1H),6.31-6.29(m,1H),5.72-5.63(m,1H),5.38(brs,1H),4.98-4.91(m,2H),4.42-4.39(m,1H),3.25-3.19(m,1H),3.05(brs,2H),2.73-2.70(m,2H),2.28(brs,1H),2.05-2.00(m,1H),1.74-1.60(m,4H),1.40-1.33(m,1H),0.97-0.93(m,1H),0.88(d,J=6.4Hz,3H),0.79(d,J=6.8Hz,3H);13C-NMR(100MHz,CDCl3)(C-Pcouplingnotremoved)δ170.6,168.9,150.0,148.5,141.2,141.1,140.8,137.2,137.1,137.0,136.2,136.0,134.4,133.7,133.5,130.4,130.3,129.1,128.8,128.6,128.5,128.4,127.6,127.5,126.8,123.2,114.6,58.8,55.8,40.8,39.5,30.6,27.8,27.3,25.9,19.1,18.0;31P-NMR(162MHz,CDCl3)δ-10.8;HRMS(ESI):calcd.forC43H45N4O2P1[M+H]+681.3353,found681.3358.
实施例6代表性膦/酰胺配体催化剂1f的合成
合成方法参照实施例1。
Mp.107-108℃;[α]D30=-44.9(c1.04,CH2Cl2);1H-NMR(400MHz,CDCl3)δ8.81(d,J=4.4Hz,1H),8.35(d,J=8.4Hz,1H),8.11(d,J=8.4Hz,1H),7.67-6.92(m,16H),6.41-6.39(m,1H),5.70-5.62(m,1H),5.39(brs,1H),4.97-4.90(m,2H),4.45(d,J=8.8Hz,1H),3.25-3.20(m,1H),3.10-2.86(m,2H),2.80-2.70(m,2H),2.28(brs,1H),2.03-2.00(m,3H),1.66-1.61(m,3H),1.36-1.31(m,1H),0.95-0.85(m,1H),0.93(s,9H);13C-NMR(100MHz,CDCl3)(C-Pcouplingnotremoved)δ170.1,168.9,150.1,148.5,141.5,141.2,137.6,137.5,137.5,137.4,136.3,136.1,134.6,133.8,133.7,133.7,133.6,133.5,130.5,130.2,129.0,128.7,128.6,128.5,128.4,128.3,127.3,127.2,126.7,123.1,114.6,60.9,55.8,40.8,39.6,34.6,27.9,27.3,26.5;31P-NMR(162MHz,CDCl3)δ-10.6;HRMS(ESI):calcd.forC44H47N4O2P1[M+H]+695.3509,found695.3493.
实施例7代表性膦/酰胺配体催化剂1g的合成
合成路线图如附图3所示,合成方法参看实施例1。
Mp.108-111℃;[α]D30=+41.2(c1.31,CH2Cl2);1H-NMR(400MHz,CDCl3)δ8.75(d,J=3.6Hz,1H),8.33(d,J=8.4Hz,1H),8.10(d,J=8.4Hz,1H),7.70-7.21(m,14H),7.13-7.10(m,2H),6.96-6.94(m,1H),6.35(d,J=7.6Hz,1H),5.92-5.85(m,1H),5.43(brs,1H),5.17-5.09(m,2H),4.42(t,J=7.6Hz,1H),2.98-2.91(m,4H),2.32-2.28(m,1H),2.05-1.97(m,3H),1.65-1.47(m,3H),1.32-1.24(m,1H),1.00-0.95(m,1H),0.88(d,J=6.8Hz,3H),0.81(d,J=6.8Hz,3H);13C-NMR(100MHz,CDCl3)(C-Pcouplingnotremoved)δ170.7,168.9,150.0,148.5,141.0,140.8,140.2,140.1,137.4,137.3,137.2,136.3,136.1,134.4,133.8,133.7,133.6,133.5,130.4,130.3,129.1,128.8,128.6,128.5,128.5,128.4,127.5,126.7,123.2,114.9,55.8,49.1,47.0,39.1,30.9,27.3,26.5,25.4,19.0,18.2;31P-NMR(162MHz,CDCl3)δ-10.0;HRMS(ESI):calcd.forC43H45N4O2P1[M+H]+681.3353,found681.3358.
实施例8应用例
[3+2]环加成反应:本实施例以本发明所述不同膦/酰胺类配体和碳酸银协同催化偶氮甲碱叶立德和马来酸二乙酯通过[3+2]环加成反应,获得了含有四氢吡咯环骨架的化合物,反应路线图参看附图4。取得显著技术效果的方面是本发明所述催化剂体现出优秀的双功能催化剂特性,反应中不需要加入额外的碱。本应用反应体系中,进一步通过条件优化发现,最好的催化剂1e和碳酸银的用量只需要4%和2%的组合就能表现出优异的催化活性,获得了产率96%,endo/exo>99:1,对映选择性96%。优化实验结果见表1所示:
表1反应条件的优化a
实施例9应用例
[2+2]环加成反应可以构筑张力相对比较大的四元环产物。首先探索用活性较好的联烯酮与不同的亚胺(C=N)或醛(C=O)等底物的[2+2]环加成反应,反应方程式见附图6所示,叔胺Lewis碱部分加成到原位生成的联烯酮后可能得到一个活化的1,3-二偶极体,同时金属Lewis酸部分通过和不同的亚胺(C=N)或醛(C=O)配位活化其不饱和键,进而发生相应的环化反应(附图6中的椅式构象为假定的过渡态)。经大量实验总结,使用本发明催化剂产率最高可达84%,ee值最高可达90%。
实施例10应用例
本发明手性膦/酰胺配体和金属(Cu、Pd、Au等试剂)协同催化末端炔基及联烯底物的Conia-Ene反应,反应路线见附图7所示,手性膦氮配体中的叔胺作为 碱和金属Lewis酸协同作用共同活化底物得到相应的五元或六元环化产物。末端联烯也可以被铜、钯、金等多种金属Lewis酸活化,在手性膦/酰胺配体和金属协同催化下对联烯底物进行研究。经大量实验总结,使用本发明催化剂产率最高可达81%,ee值最高可达75%。
实施例11应用例
在形成不对称碳-碳单键的反应中,过渡金属催化的烯丙基乙酸酯与亲核试剂的不对称取代反应是研究得最为广泛的领域之一,但对其不对称催化的探索能取得好的产率和高的对映选择性例子不多,且其底物范围主要限于1,3-二苯基-2-烯丙基乙酸酯。本发明将手性膦/酰胺配体和金属络合通过双活化方式控制反应的过渡态,从而取得好的活性和控制高的对映选择性及区域选择性(当R≠R2)。反应路线见附图8所示。经大量实验总结,使用本发明催化剂产率最高为86%,ee值最高可达89%。
实施例11应用例
加氢反应是有机反应中最常见的反应之一,H2分子简单,来源充足,价格低廉目标产物收率高,副产物少,因此得到了广泛的应用和研究。本发明将手性膦/酰胺配体和金属络合通过双活化策略催化各种不饱和键如羰基、烯烃、炔基、亚胺等底物,从而获得高的对映选择性及区域选择性。反应路线图请见附图9所示。经大量实验总结,使用本发明催化剂产率最高为92%,ee值最高可达93%。
实施例13
根据实施例8实验结果,本实施例将不同取代的偶氮甲碱叶立德和马来酸酯进行反应,考察其反应情况,如表2所示,反应路线图见附图5所示。本反应底物适用性良好,可以兼容不同类型的取代基。首先考察偶氮甲碱叶立德的R2基团,不管R2基团的苯环上带有给电子基团(如Me和MeO)、吸电子基团(如F、Cl、CN等基团)还是位阻较大的叔丁基,都获得了较高的产率和ee值。接着带有杂环和脂肪族的偶氮甲碱叶立德也进行了考察,同样获得了满意的结果。最后我们对偶氮甲碱叶立德的R3基团和马来酸酯R1基团进行考察,研究发现,R1基团为甲基时获得了高达94%的产率和93%的ee值,而当R3基团为Me、Bn、3-indolylmethyl时反应速率明显降低,但ee值没有大的丢失。
表2底物的适应性研究a
一种新型多功能膦/酰胺配体催化剂及其合成和应用专利购买费用说明
![]()
Q:办理专利转让的流程及所需资料
A:专利权人变更需要办理著录项目变更手续,有代理机构的,变更手续应当由代理机构办理。
1:专利变更应当使用专利局统一制作的“著录项目变更申报书”提出。
2:按规定缴纳著录项目变更手续费。
3:同时提交相关证明文件原件。
4:专利权转移的,变更后的专利权人委托新专利代理机构的,应当提交变更后的全体专利申请人签字或者盖章的委托书。
Q:专利著录项目变更费用如何缴交
A:(1)直接到国家知识产权局受理大厅收费窗口缴纳,(2)通过代办处缴纳,(3)通过邮局或者银行汇款,更多缴纳方式
Q:专利转让变更,多久能出结果
A:著录项目变更请求书递交后,一般1-2个月左右就会收到通知,国家知识产权局会下达《转让手续合格通知书》。
动态评分
0.0