专利摘要
本发明公开了一种青阳参皂苷组合物,该组合物包括青阳参皂苷M1和青阳参皂苷M2,按质量比1:1进行组合,经试验证实,该组合物可以被口服吸收,与苯巴比妥钠联合使用,可增强苯巴比妥钠的抗癫痫作用,效果强于单一使用,该组合物可以成为抗癫痫药物。
权利要求
1.一种青阳参皂苷组合物,其特征在于:其包括青阳参皂苷M1和青阳参皂苷M2,其中青阳参皂苷M1的结构式如下:
;
青阳参皂苷M2的结构式如下:
。
2.权利要求1所述青阳参皂苷组合物在制备抗癫痫药物中的应用。
说明书
技术领域
本发明属于民族药的有效成分领域和抗癫痫化合物领域,特别是涉及一种青阳参皂苷组合及其在制备抗癫痫药物中的应用。
背景技术
癫痫(epilepsy)即俗称的“羊角风”或“羊癫风”,是大脑神经元突发性异常放电,导致短暂的大脑功能障碍的一种慢性疾病。中国约有900万左右的癫痫患者,其中500~600万是活动性癫痫患者,同时每年新增加癫痫患者约40万,在中国癫痫已经成为神经科仅次于头痛的第二大常见病。
青阳参(Cynanchum otophyllum)是鹅绒藤属植物中的一种常用的民族药,广泛分布于我国西南地区,主要治疗癫痫,眩晕,耳鸣,腰膝酸软等症。目前已经将其氯仿提取物开发成片剂上市,联合苯巴比妥、苯妥英钠等传统抗癫痫药物,治疗顽固性癫痫大发作【匡培根等,青阳参治疗癫痫大发作,中医杂志,1980(8)】。另外,有文献报到了青阳参对于慢性肝炎【Jeanne Levy and Estera Miahel-Ber.Therapin 22(3)671-88(1967)(Fr); C.A.67 52609h;何树勋等:青阳参治疗迁延性肝炎、慢性肝炎疗效观察,滇产植物药-青阳参的研究资料1981;65-62】、美尼尔综合症【木全章等:青阳参苷丙至苷庚五个化合物及其制备方法和应用;CN9611280 3.8】、抑郁等病症有预防和治疗作用【杨庆雄,人工栽培青阳参化学成分及抗抑郁活性研究,贵州科学,2007(25)421-426】。
目前仅有文献报道了青阳参总苷的抗癫痫作用【李先春,青阳参总苷抗癫痫作用的分子机理研究,华东师范大学博士学位论文,2005】。对于抗癫痫的具体有效成分,仅有木全章等曾经提过的青阳参皂苷A和B,但未看到可靠的研究数据,其它的成分是否有抗癫痫作用至今没有报道。
中药/天然药物多成分多靶点作用的特点已经成为研究者的共识,然而如何快速高效地筛选其药效物质基础,特别是包含多个成分组成的有效成分组,是国内外学者不断探索的问题。传统的中药/天然药物的物质基础研究是对其化学成分进行提取、分离、结构鉴定,然后进行生物活性筛选,确定有效成分。近10年来随着新思路、新方法被提出,中药天然药物物质基础研究有了快速发展。例如以活性为导向的中药物质基础研究、基于组合化学或化学物质组学概念的中药药效物质基础研究、基于谱效关系或组效关系的中药物质基础研究等【屠鹏飞,史社坡,姜勇.中药物质基础研究思路与方法[J].中草药,2012,43(2):209-215.】。但传统方法耗时比较长,效率不高;新的方法过分重视或局限于体外筛选和计算机虚拟筛选,然而有些体外有效的成分不能被吸收或代谢后失活,有些成分在体外无效而在体内代谢转化为活性成分,或通过神经体液系统而发挥药效,因而体外筛选并不能准确、高效地得到药效物质基础【肖秋元,马超英.血清药物化学在中药物质基础方面的研究进展[J].时珍国医国药,2009,20(5): 1061-1062】。更重要的是,以上的筛选和分离中药活性成分的研究方法,破坏了中药以多个化合物组成的活性成分组的系统性特点,导致了常见的“越分离越没有效”的情况。
面对以上情况,我们需要用新的方法筛选青阳参的有效成分和有效成分组。基于血清药物化学的中药成分筛选是一种高效的筛选方法【黄财顺, 向诚, 李宝才, 孔靓, 王怀基. 基于中药血清药物化学的活性成分筛选的现状和问题. 中草药, 2014, 45(20):3009-3014】,其核心观点是“中药能被胃肠道吸收入血的成分可能是药效成分”。青阳参的传统用法是口服,所以入血成分可能是其有效成分;若入血成分明显比原药成分少,甚至只有少数几个,那么可以针对性分离入血成分并测试活性,将大大减少研究的工作量,提高效率;更重要的是可以尝试将入血成分进行重新组合,构建青阳参的有效成分组,更加确切地表征青阳参的活性物质基础。
发明内容
本发明的目的是提供一种青阳参皂苷组合物,该组合物包括青阳参皂苷M1和青阳参皂苷M2;经试验证实,该组合物可以被口服吸收,与苯巴比妥钠联合使用,可增强苯巴比妥钠的抗癫痫作用,效果强于单一使用,故该组合物可以开发成为抗癫痫药物。
青阳参皂苷M1的结构为青阳参苷元3-O-?-D-夹竹桃吡喃糖基-(1→4)-?-D-加拿大嘛吡喃糖基-(1→4)-?-D-洋地黄毒吡喃糖苷;青阳参皂苷M2的结构为青阳参苷元3-O-?-D-夹竹桃吡喃糖基-(1→4)-?-D-加拿大嘛吡喃糖基-(1→4)-?-D-洋地黄毒吡喃糖基-(1→4)-?-D-加拿大嘛吡喃糖苷;
青阳参皂苷M1的结构式如下:
;
青阳参皂苷M2的结构式如下:
;
它们的结构特点都是含青阳参苷元的C21甾体皂苷,3位的糖链长度为3-4个糖,其中前三个糖的结构和链接方式为3-O-?-D-夹竹桃吡喃糖基-(1→4)-?-D-加拿大嘛吡喃糖基-(1→4)-?-D-洋地黄毒吡喃糖。
本发明另一目的是将该组合物应用于制备抗癫痫药物中。
本发明所述的组合物,采用了新颖的基于血清药物化学的中药有效成分筛选方法,其大致步骤如下:
1、采用血清药物化学方法筛选青阳参入血成分,即通过大鼠的灌胃吸收试验,用HPLC-UV技术检测青阳参提取物的入血成分,发现主要有两个原型化合物可以被吸收入血,为筛选目标成分;
2、对青阳参入血成分的定点分离和鉴定,即在上一步骤筛选出目标成分的指导下,采用植物化学手段,从青阳参提取物中有针对性地分离得到两个入血成分:青阳参皂苷M1和青阳参皂苷M2,并通过核磁、质谱等手段鉴定其准确的化学结构;
3、构建青阳参的抗癫痫有效成分组合,以青阳参入血成分筛选的HPLC结果为模板,将两个主要的入血成分---青阳参皂苷M1和青阳参皂苷M2---按照青阳参提取物中的近似比例(质量比1:1)进行组合,构建青阳参的抗癫痫有效成分组合,并采用小鼠最大电休克发作实验(MES)癫痫模型测试其抗癫痫作用。结果显示:青阳参的抗癫痫有效成分组合与苯巴比妥钠联合应用,可以显著增强苯巴比妥钠抗癫痫效果,具有协同作用;其作用效果也较为显著地强于单独将单体化合物青阳参皂苷M1或青阳参皂苷M2与苯巴比妥钠联用的效果。
本发明所述组合物中可以加入一种或多种可接受的辅料,制成胶囊剂、片剂、颗粒剂、丸剂、口服液和注射液等多种形式,联合苯巴比妥钠、苯妥英钠等抗癫痫药物,作为癫痫的辅助药物,治疗难治性癫痫。所述辅料包括药学领域常规的吸收促进剂、表明活性剂、稀释剂、粘合剂、赋形剂、填充剂和稳定剂等,必要时还可加入色素、香味剂和甜味剂等。
本发明所提供的青阳参的抗癫痫组合物,因为其筛选、构建方法的独特,所以具有以下优势:1、化学成分组成明确,成分的结构明确,优于传统提取物成分复杂且难以说清的情况;2、由两个成分构成一个整体的有效成分组合,与中药/天然药物的“多成分”的系统本质特征一致,优于单一化合物;3、由于采用了血清药物化学的筛选办法,所以筛选出的组合的化合物会具有较好的口服吸收特性,避免了体外筛选与体内筛选的不一致情况;4、构建有效成分组合的过程是以青阳参成分入血情况为模板,有客观依据,过程优于拆方分析和凭经验的随意组合。该组合的发明,可以开发成为抗癫痫药物,也可以为青阳参药材的质量控制、药理研究奠定重要的基础。
附图说明
图1为采用血清药物化学进行青阳参入血成分筛选的HPLC示意图;
图2为对青阳参入血成分的定点分离和鉴定的工艺流程示意图。
具体实施方式
以下结合附图和实施例对本发明作进一步详细说明,但本发明的保护范围不限于以下的实施例,实施例中,未注明具体条件的实施方法,按照常规条件,或按照制造厂商所建议的条件进行试验。
实施例1:采用血清药物化学进行青阳参入血成分筛选
(1)青阳参药材粉碎后,采用质量百分比浓度为70%乙醇回流提取,提取液浓缩为浸膏,制得青阳参提取物;
(2)使用HPLC或LC-MS对青阳参提取物进行分析,建立青阳参药材的指纹图谱;
(3)采用步骤(1)提取物进行动物口服吸收实验,实验将大鼠分为高、中、低剂量三组,然后用青阳参提取物进行灌胃,高剂量组使用剂量为450mg/kg,中剂量组使用剂量200mg/kg,低剂量组使用剂量为110mg/kg;每组大鼠18只,每个时间点平行3只,分别于0 min、15min、30min、60min、120min、180 min抽取股动脉血,4000rpm离心制备血浆,并处死动物,收集胃肠道内容物;
(4)合并各组所有时间点收集的血浆样品,用乙酸乙酯萃取;胃肠内容物先匀浆,再用乙酸乙酯萃取,合并血浆的提取液后用N2吹干,合并胃肠内容物的提取液后用N2吹干;吹干后固体用甲醇复溶、微孔滤膜过滤、HPLC检测;
(5)步骤(4)检测结果与提取物指纹图谱对照,选取青阳参提取物指纹图谱、血浆和胃肠内容物中都具有的成分,即为青阳参口服易吸收的入血化合物;
实验结果如图1所示,大鼠灌胃15分钟后胃中青阳参皂苷M1含量较高,30分钟时明显减少,逐渐向小肠转移,因此,小肠30分钟时含M1;60分钟时,小肠中的M1消失,却在血液中发现,因此M1是我们需要的入血成分即口服易吸收成分;
大鼠灌胃15分钟后胃中青阳参皂苷M2含量较高,30分钟时明显减少,逐渐向小肠转移,因此,小肠30分钟时含M2;60分钟时,小肠中的M2消失,却在血液中发现,因此M2是我们需要的入血成分即口服易吸收成分。
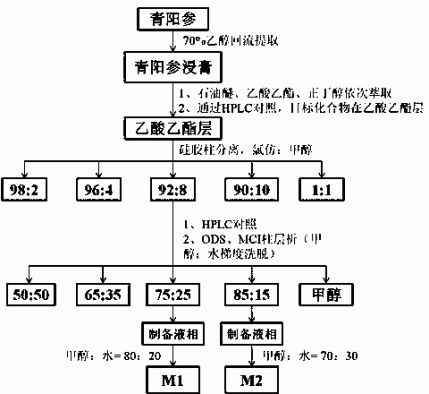
实施例2:对青阳参入血成分的定点分离和鉴定
从昆明菊花村药材市场购买的青阳参打成干粉(事先要进行药材清洗粉碎机),青阳参根粉用70%乙醇浸泡24小时,之后回流提取三次,每次2小时。乙醇提取液合并后用旋转蒸发仪在温度55摄氏度,压力-0.054下回收乙醇,并浓缩提取液得浸膏,所得到的浸膏依次用石油醚、乙酸乙酯及正丁醇萃取。
进行HPLC检测,发现入血成分在乙酸乙酯部位。将乙酸乙酯萃取部位( 45 g)经硅胶柱色谱,以氯仿-甲醇梯度洗脱(98:2、96:4、92:8、90:10、1:1),收集各部分洗脱液,减压浓缩,浓缩液转移至10ml青霉素瓶中,TLC检测,将成分大致相同的馏份进行合并;进行HPLC检测,发现入血成分在对氯仿:甲醇=92:8的部分,对其(10g)进行分离,分离方法为ODS、MCI柱层析,以甲醇水混合液:(50:50、65:35、75:25、85:15)进行洗脱;进行HPLC检测,发现入血成分M1在甲醇:水=75:25的组份中,M2在甲醇:水=85:15的组分。利用制备液相作进一步分离,方法是对甲醇:水=75:25的组份用甲醇:水=80:20分离青阳参皂苷M1,对甲醇:水=85:15的组分用甲醇:水=70:30分离青阳参皂苷M2,收集两个目标色谱峰洗脱液,洗脱液浓缩后出现大量白色结晶,甲醇重结晶后即得到青阳参皂苷M1(85mg)和青阳参皂苷M2(70mg)。经核磁共振检测得到的1H-NMR和13C-NMR数据,青阳参皂苷M1与【殷敏敏等,青阳参乙酸乙酯萃取部位的化学成分,中国药科大学学报,2013,44(3):213-218】一文中所述的数据基本一致,如下:
1H-NMR (pyridine-d5, 500 MHz), δ:3.87 (1H, m, H-3), 5.27 (1H, s, H-6), 5.33 (1H, dd, J=4.0, 11.0 Hz, H-12), 2.09 ( 3H, s, H-18), 1.30 (3H, s, H-19), 2.42 (3H, s, H-21), 8.30 (1H, d, J=8.5 Hz, H-3'), 7.23 (1H, d , J=8.5, H-4'), 7.23 (1H, d, J=8.5 Hz, H-6'), 8.30 (1H, dJ=8.5 Hz, H-7'), 5.48 (1H, d, J=9.5 Hz, H-1''), 4.64 (1H, m, H-3''), 3.51 (1H, m, H-4''), 4.30 (1H, m, H-5''), 1.43 (3H, d, J=6.0 Hz, H-6''), 5.17 (1H, d, J=9.5 Hz, H-1'''), 4.05 (1H, m, H-3'''), 3.41 (1H, m, H-4'''), 4.20 (1H, m, H-5'''), 1.35 (3H, d, J=6.0 Hz, H-6'''), 3.56 (3H, s, H-7'''), 4.75 (1H, d, J=10.0 Hz, H-1''''), 3.48 (1H, m, H-3''''), 3.44 (1H, m, H-4''''), 3.59 (1H, m, H-5''''), 1.59 (3H, d, J=4.5 Hz, H-6''''), 3.45 (3H, s, H-7'''');
13C-NMR (pyridine-d5, 125 MHz), δ: 39.3 (C-1), 29.9 (C-2), 77.7 (C-3), 39.0 (C-4), 139.6 (C-5), 118.9 (C-6), 34.8 (C-7), 74.4 (C-8), 44.5 (C-9), 37.4 (C-10), 25.2 (C-11), 73.4 (C-12), 58.5 (C-13), 89.6 (C-14), 33.9 (C-15), 33.2 (C-16), 92.5 (C-17), 10.8 (C-18), 18.2(C-19), 209.7 (C-20), 27.8 (C-21), 165.4 (C-1'), 122.1(C-2'), 132.4 (C-3'), 116.2 (C-4'), 163.6 (C-5'), 116.2 (C-6'), 132.4 (C-7'), 96.4 (C-1''), 39.0 (C-2''), 67.5 (C-3''), 83.4 (C-4''), 69.2 (C-5''), 18.5 (C-6''), 99.8 (C-1'''), 36.8(C-2'''), 77.8(C-3''') , 83.2 (C-4'''), 68.6 (C-5'''), 18.7 (C-6'''), 58.9 (C-7'''), 102.2 (C-1''''), 37.3 (C-2''''), 81.4 (C-3''''), 76.3 (C-4''''), 73.0 (C-5'''') , 18.7 (C-6''''), 57.1(C-7'''')。根据上述波谱数据,确定为青阳参皂苷M1。
青阳参皂苷M2与【Xiao-Xia Ma等,Identification of new qingyangshengenin and caudatin glycosides from the roots of Cynanchum otophyllum,Steroids,2011,1003-1009】一文中所述的数据基本一致,1H-NMR和13C-NMR数据如下:
1H-NMR (pyridine-d5, 500 MHz), δ:3.84 (1H, m, H-3), 5.26 (1H, s, H-6), 5.32 (1H, dd, J=4.0, 11.5 Hz, H-12), 2.09 ( 3H, s, H-18), 1.30 (3H, s, H-19), 2.42 (3H, s, H-21), 8.30 (1H, d, J=8.0Hz, H-3'), 7.22 (1H, d , J=8.0 Hz, H-4'), 7.22(1H, d, J=8.0 Hz, H-6'), 8.30 (1H, dJ=8.0 Hz, H-7'), 5.48 (1H, d, J=9.5和1.5 Hz, H-1''), 4.64 (1H, m, H-3''), 3.52 (1H, m, H-4''), 4.30 (1H, m, H-5''), 1.42 (3H, d, J=6.0 Hz, H-6''), 5.16 (1H, d, J=9.5 Hz, H-1'''), 4.00 (1H, m, H-3'''), 3.41 (1H, m, H-4'''), 4.17 (1H, m, H-5'''), 1.32 (3H, d, J=6.0 Hz, H-6'''), 3.56 (3H, s, H-7'''), 4.67 (1H, d, J=10.0 Hz, H-1''''), 3.55 (1H, m, H-3''''), 3.51 (1H, m, H-4'''') , 3.52 (1H, m, H-5''''), 1.43 (3H, d, J=4.5 Hz, H-6''''), 3.51 (3H, s, H-7''''), 5.25 (1H, d, J=9.5 Hz, H-1'''''), 3.77 (1H, m, H-3'''''), 3.54 (1H, m, H-4'''''), 4.14 (1H, m, H-5'''''), 1.54 (3H, d, J=5.5 Hz, H-6'''''), 3.46 (3H, s, H-7''''');
13C-NMR (pyridine-d5, 125 MHz), δ: 39.2 (C-1), 29.8 (C-2), 77.7 (C-3), 39.0 (C-4), 139.4 (C-5), 119.1 (C-6) , 34.8 (C-7), 74.3(C-8), 44.5 (C-9), 37.4 (C-10), 25.2 (C-11), 73.4 (C-12), 58.4 (C-13), 89.5 (C-14), 33.9 (C-15), 33.2 (C-16), 92.5 (C-17), 10.8 (C-18), 18.1(C-19), 209.8 (C-20), 27.8 (C-21), 165.3 (C-1'), 122.0(C-2'), 132.4 (C-3'), 116.2 (C-4'), 163.6 (C -5'), 116.2 (C-6'), 132.4 (C-7'), 96.4 (C-1''), 39.0 (C-2''), 67.5 (C-3''), 83.4 (C-4''), 68.6(C-5''), 18.7 (C-6''), 99.7 (C-1'''), 36.8(C-2'''), 77.7(C-3'''), 83.2 (C-4'''), 69.2 (C-5'''), 18.5 (C-6'''), 58.7 (C-7'''), 102.2 (C-1''''), 37.7 (C-2''''), 78.9 (C-3''''), 82.6 (C-4''''), 71.8 (C-5''''), 18.7 (C-6''''), 57.3 (C-7''''), 98.5 (C-1'''''), 35.9 (C-2'''''), 79.0 (C-3'''''), 74.7 (C-4'''''), 71.3 (C-5'''''), 19.0 (C-6'''''), 58.0 (C-7''''')。根据上述波谱数据,确定为青阳参皂苷M2。
实施例3:青阳参的抗癫痫有效成分组协同苯巴比妥钠,对抗癫痫最大电休克发作试验
癫痫模型的建立:最大电休克抗癫痫模型(MES)优化条件主要包括电刺激时间、电刺激部位(耳尖、中、根)和电压,最终的优化条件为:电刺激时间0.125s,电刺激部位耳中部,电压100V。该条件下,小鼠的电刺激作用不至于过强或过弱,苯巴比妥钠可治疗该条件下引起的强直性痉挛。
本实验将苯巴比妥钠与青阳参皂苷M1+M2联合使用,以合用对癫痫发作的抑制率是否增大判断化合物的协同作用;具体方法是:昆明种小鼠,采用MES筛选出敏感的动物40只,随机分为阴性对照组、苯巴比妥组(阳性对照组)、M1+苯巴比妥钠组、M2+苯巴比妥钠组、M1+M2+苯巴比妥钠联合用药组等5组,每组8只。苯巴比妥钠(8 mg/kg)、M1(10 mg/kg)、M2(10 mg/kg)、M1+M2(5+5 mg/kg)均为腹腔注射。单用时,苯巴比妥钠给药1h后进行试验;联合使用时,先腹腔注射M1、M2或M1+M2,4h后腹腔注射苯巴比妥钠,1小时后进行MES试验,评价药物对MES引起的癫痫样反应的抑制作用。数据统计采用χ2检验法,以检验苯巴比妥钠合用M1+M2对抗癫痫疗效是否上升,并与单体M1、M2的效果进行比较。
结果(表1)证明M1+M2与苯巴比妥钠合用有协同作用,给药后抗癫痫作用增强;且与苯巴比妥钠与M1或M2联用组比较也增强,有显著性差异,可作为治疗癫痫的辅助药物。
表1:M1+M2和苯巴比妥钠合用对MES致小鼠癫痫的作用
注:**:给药组和阴性对照组比较,P < 0.01,有显著性差异; :与苯巴比妥钠组比较:P < 0.01。
一种青阳参皂苷组合物及其应用专利购买费用说明
![]()
Q:办理专利转让的流程及所需资料
A:专利权人变更需要办理著录项目变更手续,有代理机构的,变更手续应当由代理机构办理。
1:专利变更应当使用专利局统一制作的“著录项目变更申报书”提出。
2:按规定缴纳著录项目变更手续费。
3:同时提交相关证明文件原件。
4:专利权转移的,变更后的专利权人委托新专利代理机构的,应当提交变更后的全体专利申请人签字或者盖章的委托书。
Q:专利著录项目变更费用如何缴交
A:(1)直接到国家知识产权局受理大厅收费窗口缴纳,(2)通过代办处缴纳,(3)通过邮局或者银行汇款,更多缴纳方式
Q:专利转让变更,多久能出结果
A:著录项目变更请求书递交后,一般1-2个月左右就会收到通知,国家知识产权局会下达《转让手续合格通知书》。
动态评分
0.0