专利摘要
本发明提供了一种邻位巯基苯酚衍生物及其制备方法,制备方法包括:a、前体合成;b、目标产物合成;c、纯化。本发明与现有技术相比,提供了一种全新的多取代邻位巯基苯酚的合成方法,生成一系列新的邻位巯基苯酚衍生物。相对于普通邻位巯基苯酚衍生物,本发明提供的方法制备的邻位巯基苯酚衍生物有多环的存在,其结构更加复杂多样,在化工生产、临床医药中也将表现出更加广阔的用途前景。
权利要求
1.一种邻位巯基苯酚衍生物,其特征在于,所述邻位巯基苯酚衍生物结构式为:
其中E1、E2相同,均为CO2R,R为直链烷基或支链烷基;
R1、R2为氢、直链烷基、支链烷基、卤素或烷氧基;
R3为直链烷基、支链烷基、芳基。
2.根据权利要求1所述的邻位巯基苯酚衍生物,其特征在于,所述邻位巯基苯酚衍生物结构式为:
3.一种权利要求1或2所述的邻位巯基苯酚衍生物的制备方法,其特征在于,所述制备方法包括以下步骤:
a、前体化合物合成;
b、目标产物合成;
c、纯化。
4.根据权利要求3所述的邻位巯基苯酚衍生物的制备方法,其特征在于,所述的步骤a、前体化合物合成,包括以下步骤:
(1)将丙二酸二酯类化合物与炔丙基溴加入到溶剂中,加入催化剂,反应一段时间后,得到产物,洗涤、萃取、干燥、柱层析,得到白色固体产物;
(2)在无水无氧催化体系中,将白色固体产物与苯乙炔基溴或其衍生物加入到溶剂中,加碱反应一段时间后,将产物洗涤、萃取、干燥、柱层析,得到浅棕色固体产物,即前体化合物。
5.根据权利要求4所述的邻位巯基苯酚衍生物的制备方法,其特征在于,步骤(1)具体包括如下步骤:将丙二酸二酯类化合物与炔丙基溴加入到无水乙腈中,以氢化钠为催化剂,冰水浴搅拌反应8小时,将产物加水洗涤后用乙酸乙酯萃取,减压旋干,柱层析(体积比乙酸乙酯:石油醚=1:80-100)得到白色固体产物。
6.根据权利要求4或5所述的邻位巯基苯酚衍生物的制备方法,其特征在于,所述丙二酸二酯类化合物与炔丙基溴摩尔比为1:2.2-3.2;所述丙二酸二酯类化合物的结构式为 其中,R为直链烷基、支链烷基、饱和烃类、不饱和烃类或芳香烃类基团。
7.根据权利要求4所述的邻位巯基苯酚衍生物的制备方法,其特征在于,步骤(2)具体包括如下步骤:将步骤(1)得到的白色固体产物与苯乙炔基溴或其衍生物混合在Pd(PPh3)2Cl2/CuI的无水无氧催化体系中,以三乙胺作碱,以无水乙腈为溶剂,室温下搅拌反应12小时,产物用水洗涤,用乙酸乙酯萃取,减压旋干,柱层析(体积比乙酸乙酯:石油醚=1:80-100)得到浅棕色固体产物,即前体化合物。
8.根据权利要求7所述的邻位巯基苯酚衍生物的制备方法,其特征在于,所述白色固体产物与苯乙炔基溴或其衍生物的摩尔比为1:2.2-3.2,所述Pd(PPh3)2Cl2/CuI的无水无氧催化体系中,摩尔比Pd(PPh3)2Cl2:CuI=3:1;
所述苯乙炔基溴或其衍生物的结构式为 或 或两者的混合物,其中R1、R2为氢、直链烷基、支链烷基、卤素或烷氧基。
9.根据权利要求3所述的邻位巯基苯酚衍生物的制备方法,其特征在于,所述步骤b、目标产物合成,包括以下步骤:
在105℃的条件下,化合物2在二甲基亚砜或其衍生物中反应24小时,得到邻位巯基苯酚衍生物粗产物,即目标产物;
所述二甲基亚砜或其衍生物结构式为 R3为直链烷基、支链烷基或芳基。
10.根据权利要求3所述的邻位巯基苯酚衍生物的制备方法,其特征在于,所述步骤c、纯化包括以下步骤:
将步骤b制备的邻位巯基苯酚衍生物粗产物加水洗涤后,用乙酸乙酯萃取,减压旋干,柱层析(乙酸乙酯:石油醚=1:40)分离可得到浅黄色固体,即邻位巯基苯酚衍生物,柱层析产率约为75%。
说明书
技术领域
本发明涉及有机合成领域,具体涉及邻位巯基苯酚衍生物的制备方法。
背景技术
邻位巯基苯酚及其衍生物广泛应用于工业生产和科学研究,例如巯基苯酚主要用于医药、农药、高分子材料及有机合成的助剂等方面,也用于制局部麻醉剂。鉴于邻位巯基苯酚及其衍生物的特殊重要性,如何去拓展巯基苯酚及其衍生物的合成路径引起了无数有机合成家和化学家积极思考,并且得出了一些很有效的方法。
常见的巯基苯酚的合成路线主要可以分为以下五大类:
1.氯磺酸法
该法以苯为原料,经氯磺化、铁粉或锌粉还原制得,其反应式如下:
其后,人们对该方法也进行了不断的研究,但是对该方法的研究主要集中在苯磺酰氯转化到苯硫酚的过程研究中,而很少关 注由苯生成苯磺酰氯需耗用大量的氯磺酸,原料来源紧张。氯磺酸腐蚀性大,遇水作用剧烈,给工艺、设备和运输带来困难;而且该法工艺复杂,反应周期长,总收率低,成本高,最大的弱点是三废不易处理。
2.氯苯法
氯苯法又可以分为氯苯催化法和氯苯非催化法。氯苯催化法由氯苯和硫化氢作用而得,其反应式如下:
此法原料易得,反应温度为450-500℃用ZnS作催化剂。但是,此法有两个问题尚待解决:一是催化剂使用寿命短,只能运转300h,中毒后的催化剂尚未找到理想的再生方法;二是催化剂是用醋酸锌和5#活性炭制备,这两种原料来源少、价格高。
3.苯酚法
该法一般由苯酚与硫化氢在高温下反应制得。1977年,美国的N.A.Fishel等利用该法合成了苯硫酚,其反应式如下:
该反应有48%的苯酚发生了反应,其中有75%转化成了苯酚。1987年,美国化学家B.Elliont采用新的反应条件,先利用苯酚与硫光气反应,然后用碱金属氟化物氟化,经水解同样得到了苯硫酚。
但是,用苯酚法生成苯硫酚其产率低,成本高,实用价值不大。
4.Ph2S2裂解法
以Ph2S2为原料,采用不同的方法将其裂解为苯硫酚的相关报道也较多。1951年日本的M.Nakazoki利用Ph2S2与四氢化萘在250-260℃的高温下加热反应两小时得到了苯硫酚。1982年,俄罗斯的M.G.Voronkov等对利用Ph2S2与硫化氢反应生成苯硫酚的反应进行了研究,结果认为随着反应温度的提高,尽管反应速度加快,但得到的苯硫酚的产率却降低了。
5.其它合成方法
1960年,有研究人员用苯甲硫醚在过量的甲苯溶液中进行高温分解也可以得到苯硫酚。将PhSO2)2还原亦可以得到苯硫酚。L.Field和Frederick用四氢铝锂还原PhSO2)2得到了苯硫酚
其反应式如下:
氯苯和硫化氢的无催化气相反应是在有催化剂存在下氯苯和硫化氢反应而发展起来的,具有工业开发的前途,有关它的工艺及过程曾有过详细的报道。
综上所述,现有技术基本研究制备巯基苯酚的方法,存在产率低,成本高等缺点,对巯基苯酚衍生物的制备方法研究却很少。
发明内容
针对现有技术存在的技术问题,本发明提供一种邻位巯基苯酚衍生物。
本发明还有一个目的,提供一种邻位巯基苯酚衍生物的制备方法。
本发明提供的一种邻位巯基苯酚衍生物,其结构式为:
其中E1、E2相同,均为CO2R,R为直链烷基或支链烷基;
R1、R2为氢、直链烷基、支链烷基、卤素或烷氧基;
R3为直链烷基、支链烷基或芳基。
优选的邻位巯基苯酚衍生物结构式为:
本发明提供的一种邻位巯基苯酚衍生物的制备方法,包括以下步骤:
a、前体化合物合成;
b、目标产物合成;
c、纯化。
所述的步骤a、前体化合物合成包括以下步骤:
(1)将丙二酸二酯类化合物与炔丙基溴加入到溶剂中,加入催化剂,反应一段时间后,得到产物,洗涤、萃取、干燥、柱层析,得到白色固体产物;
(2)在无水无氧催化体系中,将白色固体产物与苯乙炔基溴或其衍生物加入到溶剂中,加碱反应后,将产物洗涤、萃取、干燥、柱层析,得到浅棕色固体产物,即前体化合物。
步骤(1)具体包括如下步骤:将丙二酸二酯类化合物与炔丙基溴加入到无水乙腈中,以氢化钠为催化剂,冰水浴搅拌反应8小时,将产物加水洗涤后用乙酸乙酯萃取,减压旋干,柱层析(体积比乙酸乙酯:石油醚=1:80-100)得到白色固体产物。
其中丙二酸二酯类化合物与炔丙基溴摩尔比为1:2.2-3.2。
所述丙二酸二酯类化合物的结构式为 其中,R为直链烷基、支链烷基、饱和烃类、不饱和烃类或芳香烃类基团。
步骤(2)具体包括如下步骤:将步骤(1)得到的白色固体产物与苯乙炔基溴或其衍生物混合在Pd(PPh3)2Cl2/CuI的无水无氧催化体系中,以三乙胺作碱,以无水乙腈为溶剂,室温下搅拌反应12小时,产物用水洗涤,用乙酸乙酯萃取,减压旋干,柱层析(体积比乙酸乙酯:石油醚=1:80-100)得到浅棕色固体产物,即前体化合物。
其中所述白色固体产物与苯乙炔基溴或其衍生物的摩尔比为1:2.2-3.2,所述Pd(PPh3)2Cl2/CuI的无水无氧催化体系中,摩尔比 Pd(PPh3)2Cl2:CuI=3:1;
所述苯乙炔基溴或其衍生物的结构式为 或 或两者的混合物,其中R1、R2为氢、直链烷基、支链烷基、卤素或烷氧基。
所述步骤b、目标产物合成,包括以下步骤:
在105℃的条件下,化合物2在二甲基亚砜或其衍生物中反应24小时,得到邻位巯基苯酚衍生物粗产物,即目标产物。
所述二甲基亚砜或其衍生物结构式为 R3为直链烷基、支链烷基或芳基。
所述步骤c、纯化包括以下步骤:
将步骤b制备的邻位巯基苯酚衍生物粗产物加水洗涤后,用乙酸乙酯萃取,减压旋干,柱层析(乙酸乙酯:石油醚=1:40)分离可得到浅黄色固体,即邻位巯基苯酚衍生物,柱层析产率约为75%。
本发明与现有技术相比,提供了一种全新的多取代邻位巯基苯酚的合成方法,生成一系列新的邻位巯基苯酚衍生物。相对于普通邻位巯基苯酚衍生物,本发明提供的方法制备的邻位巯基苯酚衍生物有多环的存在,其结构更加复杂多样,在化工生产、临床医药中也将表现出更加广阔的用途前景。
附图说明
图1为本发明所述邻位巯基苯酚衍生物的结构式;
图2为本发明所述优选的邻位巯基苯酚衍生物结构式;
图3为本发明实施例1的核磁共振氢谱;
图4为本发明实施例1的核磁共振碳谱;
图5为本发明实施例2的核磁共振氢谱;
图6为本发明实施例2的核磁共振碳谱;
图7为本发明实施例3的核磁共振氢谱;
图8为本发明实施例3的核磁共振碳谱。
具体实施方式
实施例1
一种邻位巯基苯酚衍生物,其结构如下:
一种上述邻位巯基苯酚衍生物,其制备方法包括以下步骤:
a、前体化合物合成:
(1)以氢化钠(400mmol)为催化剂,将丙二酸二甲酯(200mmol)与炔丙基溴(440mmol)加入到无水乙腈中冰水浴搅拌反应8小时,将反应产物加水洗涤后用乙酸乙酯萃取,减压旋干,柱层析(体积比乙酸乙酯:石油醚=1:100)得到白色固体产物,其中丙二酸二甲酯与炔丙基溴摩尔比为1:2.2。
(2)将白色固体产物(80mmol)与苯乙炔基溴混合在Pd(PPh3)2Cl2:CuI=(3:1)的无水无氧催化体系中,以三乙胺作碱,以 无水乙腈为溶剂,室温下搅拌反应12小时,将反应产物加水洗涤后用乙酸乙酯萃取,减压旋干,柱层析(体积比乙酸乙酯:石油醚=1:100)得到浅棕色固体产物,即前体化合物,其中前体化合物与苯乙炔基溴的摩尔比为1:2.2。
b、目标产物合成:
在105℃的条件下,前体化合物(1mmol)在二甲基亚砜(DMSO)(5mL)中反应24小时,得到邻位巯基苯酚衍生物的粗产物。
c、纯化:
将邻位巯基苯酚衍生物的粗产物加水洗涤后,用乙酸乙酯萃取,减压旋干,柱层析(乙酸乙酯:石油醚=1:40)分离可得到我们需要的浅黄色固体:化合物3,即邻位巯基苯酚衍生物,柱层析产率约为75%。
邻位巯基苯酚衍生物的结构通过;1H NMR;13C NMR来测定。
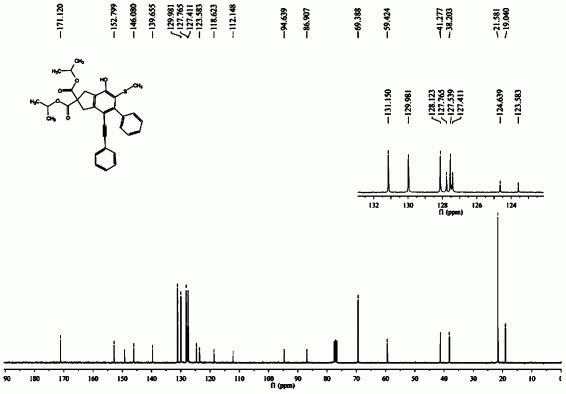
化合物3:
1H NMR(300MHz,CDCl3)δ7.421–7.466(m,3H),7.367–7.399(m,3H),7.208–7.237(m,3H)7.096–7.129(m,2H),3.812–3.829(d,8H),3.714(s,2H),1.942(s,3H);
13C NMR(75MHz,CDCl3)δ171.993,152.806,149.268,145.795,139.565,131.146,129.951,128.231,127.819,127.553,127.451,124.393,123.488,118.781,112.146,112.146,94.738,86.798,59.400,53.164,41.480,38.337,19.020
实施例2
一种邻位巯基苯酚衍生物,其结构如下:
一种上述邻位巯基苯酚衍生物,其制备方法包括以下步骤:
a、前体化合物合成:
(1)以氢化钠(400mmol)为催化剂,将丙二酸二乙酯(200mmol)与炔丙基溴(440mmol)加入到无水乙腈中冰水浴搅拌反应8小时,将反应产物加水洗涤后用乙酸乙酯萃取,减压旋干,柱层析(体积比乙酸乙酯:石油醚=1:100)得到白色固体产物,其中丙二酸二乙酯与炔丙基溴摩尔比为1:2.2;
(2)将白色固体产物(80mmol)与苯乙炔基溴混合在Pd(PPh3)2Cl2:CuI(3:1)的无水无氧催化体系中,以三乙胺作碱,以无水乙腈为溶剂,室温下搅拌反应12小时,将反应产物加水洗涤后用乙酸乙酯萃取,减压旋干,柱层析(体积比乙酸乙酯:石油醚=1:100)得到浅棕色固体产物,及前体化合物,其中白色固体产物与苯乙炔基溴的摩尔比为1:2.2。
b、目标产物合成:
在105℃的条件下,前体化合物(1mmol)在二甲基亚砜(DMSO) (5mL)中反应24小时,得到邻位巯基苯酚衍生物的粗产物,即目标产物。
c、纯化:
将邻位巯基苯酚衍生物的粗产物加水洗涤后,用乙酸乙酯萃取,减压旋干,柱层析(乙酸乙酯:石油醚=1:40)分离可得到我们需要的浅黄色固体,即邻位巯基苯酚衍生物,柱层析产率约为85%。
邻位巯基苯酚衍生物的结构通过;1H NMR;13C NMR来测定。
化合物3:
1H NMR(300MHz,CDCl3):δ7.46-7.43(m,3H),7.41-7.37(m,3H),7.23-7.20(m,3H),7.12-7.09(m,2H),4.26(q,J=7.2Hz,4H),3.80(s,2H),3.70(s,2H),1.93(s,3H),1.30(t,J=7.2Hz,6H);
13C NMR(75.5MHz,CDCl3):δ171.57,152.82,149.24,145.97,139.62,131.15,129.98,128.14,127.80,127.55,127.44,124.55,123.54,118.71,112.15,94.69,86.88,61.95,59.46,41.36,38.24,19.04,14.09;
实施例3
一种邻位巯基苯酚衍生物,其结构如下:
一种上述邻位巯基苯酚衍生物,其制备方法包括以下步骤:
a、前体化合物合成:
(1)以氢化钠(400mmol)为催化剂,将丙二酸二丙酯(200mmol)与炔丙基溴(440mmol)加入到无水乙腈中冰水浴搅拌反应8小时,将反应产物加水洗涤后用乙酸乙酯萃取,减压旋干,柱层析(体积比乙酸乙酯:石油醚=1:100)得到白色固体产物,其中丙二酸二丙酯与炔丙基溴摩尔比为1:2.2。
(2)将白色固体产物(80mmol)与苯乙炔基溴混合在Pd(PPh3)2Cl2:CuI(3:1)的无水无氧催化体系中,以三乙胺作碱,以无水乙腈为溶剂,室温下搅拌反应12小时,将反应产物加水洗涤后用乙酸乙酯萃取,减压旋干,柱层析(体积比乙酸乙酯:石油醚=1:100)得到浅棕色固体产物,即前体化合物,其中白色固体产物与苯乙炔基溴的摩尔比为1:2.2。
b、目标产物合成:
在105℃的条件下,化合物2(1mmol)在二甲基亚砜(DMSO)(5mL)中反应24小时,得到邻位巯基苯酚衍生物的粗产物,即目标产物。
c、纯化:
将邻位巯基苯酚衍生物的粗产物加水洗涤后,用乙酸乙酯萃取, 减压旋干,柱层析(乙酸乙酯:石油醚=1:40)分离可得到我们需要的浅黄色固体,即邻位巯基苯酚衍生物,柱层析产率约为89%。
邻位巯基苯酚衍生物的结构通过;1H NMR;13C NMR来测定。
化合物3:
1H NMR(300MHz,CDCl3)δ7.45-7.41(m,3H),7.39-7.37(m,3H),7.23-7.21(m,3H),7.11-7.10(m,2H),5.16-5.04(m,2H),3.76(s,2H),3.66(s,2H),1.93(s,3H),1.28(d,J=6.6Hz,12H);13CNMR(75.5MHz,CDCl3)δ171.12,152.80,149.21,146.08,139.66,131.15,129.98,128.13,127.77,127.54,127.41,124.64,123.58,118.63,112.15,96.64,86.91,69.39,59.43,41.28,38.21,21.58,19.04。
一种邻位巯基苯酚衍生物及其制备方法专利购买费用说明
![]()
Q:办理专利转让的流程及所需资料
A:专利权人变更需要办理著录项目变更手续,有代理机构的,变更手续应当由代理机构办理。
1:专利变更应当使用专利局统一制作的“著录项目变更申报书”提出。
2:按规定缴纳著录项目变更手续费。
3:同时提交相关证明文件原件。
4:专利权转移的,变更后的专利权人委托新专利代理机构的,应当提交变更后的全体专利申请人签字或者盖章的委托书。
Q:专利著录项目变更费用如何缴交
A:(1)直接到国家知识产权局受理大厅收费窗口缴纳,(2)通过代办处缴纳,(3)通过邮局或者银行汇款,更多缴纳方式
Q:专利转让变更,多久能出结果
A:著录项目变更请求书递交后,一般1-2个月左右就会收到通知,国家知识产权局会下达《转让手续合格通知书》。
动态评分
0.0