专利摘要
专一性结合至一个或多个α5β1及αv整合蛋白(例如αvβ1、αvβ3、αvβ5、αvβ6及αvβ8),但具有与αIIbβ3的降低结合活性的去整合蛋白变异体;以及该去整合蛋白变异体在治疗和预防一与αv整合蛋白或α5β1整合蛋白相关的疾病上的用途。
权利要求
1.一种去整合蛋白变异体,其特征在于,其包含选自由以下所组成的群组的至少一个:
(a)一突变连接符,其包含至少一位于SEQ ID NO:332(SRAGKIC)氨基酸序列的1至5位点上的突变;
(b)一突变RGD环,其包含选自由SEQ ID NO:329至331所组成的群组的氨基酸序列;以及
(c)一突变C-端,其包含至少一位于SEQ ID NO:334(PRYH)氨基酸序列的1至4位点上的突变,
其中,相较于一去整合蛋白不具有该选自由该突变连接符、该突变RGD环以及该突变C-端所组成的群组的至少一个,该去整合蛋白变异体具有以下至少一个:降低与αIIbβ3整合蛋白的结合活性以及提高与αvβ1、αvβ3、αvβ5、αvβ6、αvβ8、及α5β1整合蛋白中的至少一个的结合活性。
2.如权利要求1所述的去整合蛋白变异体,其特征在于,该去整合蛋白选自由以下所组成的群组:马来亚蝮素、白唇竹叶青蛇素、百步蛇素、墨西哥西海岸响尾蛇素、矛头蝮素、鼓腹巨蛇素、西部亚种响尾蛇素、角响尾蛇素、西部菱背响尾蛇素、南美响尾蛇素、丽纹龟壳花蛇素、黄绿龟壳花蛇素、黄绿龟壳花蛇毒解离素、日本蝮蛇素、西伯利亚蝮蛇毒解离素、巴西蝮素、巴西蝮蛇毒解离素、马来亚红口蝮素、亚马逊巨蝮素、西部亚种响尾蛇素、黑尾响尾蛇素、韩国亚种短尾蝮素、白眉蝮素、北美侏儒响尾蛇素、黄绿龟壳花蛇毒解离素、台湾龟壳花素、台湾龟壳花去整合蛋白、乌苏里蝮素及草原响尾蛇素。
3.如权利要求1或2所述的去整合蛋白变异体,其特征在于,其包含一突变RGD环、以及该突变连接符及该突变C-端中的至少一个,该突变RGD环包含至少一位于SEQ ID NO:333(RIPRGDMP)氨基酸序列的1至3、5、7及8位点上的突变。
4.如权利要求1至3中任一项所述的去整合蛋白变异体,其特征在于,该突变连接符包含选自由SEQ ID NO:306至SEQ ID NO:318所组成的群组的氨基酸序列。
5.如权利要求1至4中任一项所述的去整合蛋白变异体,其特征在于,该突变C-端包含选自由SEQ ID NO:319至SEQ ID NO:328所组成的群组的氨基酸序列。
6.如权利要求1至6中任一项所述的去整合蛋白变异体,其特征在于,其包含一突变RGD环、以及一突变连接符及一突变C-端中的至少一个,该突变RGD环具有选自由SEQ ID NO:329至331所组成的群组的氨基酸序列,该突变连接符具有选自由SEQ ID NO:306至SEQ ID NO:318所组成的群组的氨基酸序列,该突变C-端具有选自由SEQ ID NO:319至SEQ ID NO:328所组成的群组的氨基酸序列。
7.如权利要求6所述的去整合蛋白变异体,其特征在于,其包含该突变RGD环、该突变连接符以及该突变C-端。
8.如权利要求1所述的去整合蛋白变异体,其特征在于,其包含选自由SEQ ID NO:123、124、147、149、及171所组成的群组的氨基酸序列。
9.如权利要求1至8中任一项所述的去整合蛋白变异体,其特征在于,该去整合蛋白变异体接上聚乙二醇或与白蛋白或抗体的可结晶区(Fc)结合。
10.一种编码如权利要求1至9中任一项所述的去整合蛋白变异体的多核苷酸。
11.一种重组宿主细胞,其特征在于,其包含一编码如权利要求1至9中任一项所述的去整合蛋白变异体的多核苷酸。
12.一种医药组合物,其特征在于,其包含该如权利要求1至9中任一项所述的去整合蛋白变异体及一药学上可接受的载体。
13.一种用于治疗在一有需要的个体中与至少一选自由αvβ1、αvβ3、αvβ5、αvβ6、αvβ8及α5β1整合蛋白所组成的群组的整合蛋白相关的疾病的方法,其特征在于,其将包含如权利要求12所述的医药组合物投予至该个体。
14.如权利要求13所述的方法,其特征在于,该整合蛋白相关疾病是一选自由以下所组成的群组的血管新生相关的眼部疾病:老年性黄斑病变、糖尿病视网膜病变、角膜神经血管增生病变、局部缺血导致的神经血管增生视网膜病变、高度近视及早熟性视网膜病变。
15.如权利要求13所述的方法,其特征在于,该整合蛋白相关疾病是一选自由以下所组成的群组的癌症:转移性黑色素瘤、转移性前列腺癌、转移性乳癌、结肠直肠癌、肝癌、卵巢癌、子宫颈癌、胰脏癌、非小细胞肺癌及多形性神经胶母细胞瘤。
16.一种使用如权利要求1至9中任一项所述的去整合蛋白变异体在制造药剂的用途,其特征在于,该药剂用于治疗在一有需要的个体中与至少一选自由αvβ1、αvβ3、αvβ5、αvβ6、αvβ8、及α5β1整合蛋白所组成的群组的整合蛋白相关的一疾病。
说明书
优先权声明
本申请案依美国专利法35U.S.C.§119(e)主张于2014年8月22日提出申请的美国临时专利申请案第62/040,503号的权益,该美国临时专利申请案的全文并于此处以供参考。
参见电子送件序列表
本申请案包括一通过EFS-Web电子送件的序列表,该序列表为ASCII格式,档名为“688947-1PCT Sequence Listing.txt”,建档日期为2015年8月20日,档案大小为157,219字节。该通过EFS-Web电子送件的序列表为本说明书的一部分,且全文并于此处以供参考。
技术领域
本发明关于去整合蛋白变异体,其专一性结合至一个或多个α5β1及αv整合蛋白(例如αvβ1、αvβ3、αvβ5、αvβ6、及αvβ8),但具有与αIIbβ3的降低结合活性,以及该去整合蛋白变异体在治疗和预防与αv整合蛋白或α5β1整合蛋白相关的疾病上的用途。
背景技术
整合蛋白与邻近细胞上的膜外基质蛋白或其它黏着受器结合的穿膜受器。整合蛋白的α及β次单元的异二聚物配对(heterodimeric pairing)赋予与一个或多个基质结合的专一性(Weis等人,2011,Cold Spring Harb Perspect Med;1:a006478)。这个家族的黏着分子在生物学广泛的领域中扮演一重要的角色,包括发炎、先天性及抗源专一性免疫、恒定、伤口痊愈、组织成形(tissue morphogenesis)及细胞生长与分化的调控。整合蛋白的异常调控涉及于很多疾病状态(从自体免疫至血管栓塞疾病,再到癌症转移)的致病机转。业经投入广大的努力于发现和开发用于临床应用的整合蛋白拮抗剂。
这些αv整合蛋白各自具有一αv次单元与一β1、β3、β5、β6或β8次单元配对,其等似乎在有关伤口修复、血管新生及癌症的组织改造(tissue remodeling)过程中特别地重要(Weis等人,2011,见上文)。这些αv整合蛋白可做为癌症、眼科及骨科的适应症的标靶。整合蛋白αvβ3及αvβ5也与肿瘤、关节炎、干癣及老年性黄斑病变(age-related macular degeneration,AMD)有关。特别是,αvβ3整合蛋白在调节血管新生及抑制肿瘤转移中是重要的,且αvβ6整合蛋白在一些癌症中是增量表现的。其它存在于眼角膜中的αv整合蛋白(αvβ5、αvβ6及αvβ8)调节转化生长因子β(transforming growth factorβ,TGFβ)的活化。
整合蛋白α5β1、αvβ3及αvβ5已被报告其在血管新生的过程中扮演一重要角色且在多种恶性肿瘤中表现,包括(但不限于)黑色素瘤、乳癌、前列腺癌、结肠癌及脑瘤(Staunton等人,2006,Adv Immunol.,91:111-57)。这些整合蛋白的肿瘤内表现(intratumoral expression)与肿瘤(例如黑色素瘤、乳癌、及前列腺癌)的发展与转移相关(Staunton等人,2006,见上文)。其等已被显示通过多条途径传讯且帮助内皮细胞的转移与增生。在生物体内,其等在肿瘤的新生血管及肿瘤细胞自身上过度表现,此暗示其功能可通过多种机制使肿瘤的发展成为可能。对抗整合蛋白α5β1、αvβ3及αvβ5的拮抗性抗体及小分子在生物体外和在生物体内已显示可抑制血管新生。整合蛋白α5β1、αvβ3及αvβ5的抑制因子可以抑制通过ERK、Akt及FAK的传讯,导致内皮细胞及癌细胞的黏着、转移及增生减少。这些拮抗剂也被发现通过凋亡蛋白酶依赖(caspase-dependent)机制引起细胞凋亡。因此,整合蛋白α5β1、αvβ3及αvβ5在血管新生的关键性角色及与肿瘤发展的关联使其成为抗癌疗法的有吸引力的目标,且这些整合蛋白的许多拮抗剂已于临床试验测试。
αvβ3整合蛋白与αIIbβ3整合蛋白享有相同的β3次单元以及多个大分子配体(ligand),包括血纤维蛋白原(fibrinogen)、纤维连接蛋白(fibronectin)、凝血栓蛋白(thrombospondin)、温韦伯氏因子(von Willebrand factor)及玻璃黏结蛋白(vitronectin)。这些配体都含有三重组氨基酸序列:精氨酸-甘氨酸-天冬氨酸(RGD)。纤维连接蛋白及玻璃黏结蛋白也为α5β1及其它αv整合蛋白的配体。αIIbβ3整合蛋白为血小板上的一主要膜蛋白,且在血小板的凝集上扮演一重要的角色。多种αIIbβ3整合蛋白拮抗剂业经开发用于治疗患有急性冠心症(acute coronary syndrome,ACS)的病人。然而,因为广泛地抑制血小板凝集伴随出血风险的增加,发展中的研究着重于减少出血及其它αIIbβ3整合蛋白拮抗剂的副作用。通过阻断单一整合蛋白或者多重αv整合蛋白设计用于不同适应症的药物是必须的(Goodman,2012,Trends Pharmacol Sci.2012;33:405-412)。
去整合蛋白是一含RGD的低分子量胜肽家族,其与表现在血小板及其它细胞(包括血管内皮细胞及一些肿瘤细胞)上的整合蛋白(例如αIIbβ3、α5β1、及αvβ3)结合。除了其有效的抗血小板活性外,去整合蛋白的研究已呈现在心血管疾病的诊断中以及在动脉栓塞、骨质疏松及血管新生相关的肿瘤生长及转移的治疗药剂的设计中的新用途。马来亚蝮素(Rhodostomin,Rho),一种来自马来亚蝮蛇的毒液的去整合蛋白,业经发现通过阻断血小板醣蛋白αIIbβ3以在生物体外及生物体内抑制血小板凝集。也发现,Rho可与整合蛋白αIIbβ3、α5β1及αvβ3以高亲和力结合且与癌细胞互相作用。举例而言,Rho被报告其以剂量依存的方式抑制乳房及前列腺恶性肿瘤细胞对未矿物化及矿物化的骨细胞外基质的黏着性,但其不影响肿瘤细胞的存活力。Rho也可抑制乳房及前列腺恶性肿瘤细胞的转移及入侵。
然而,由于马来亚蝮素非专一性地与整合蛋白αIIbβ3、α5β1及αvβ3结合,马来亚蝮素的医药用途可能造成严重的副作用,例如因抑制血小板凝集造成出血。因此,在本技术领域中存在对整合蛋白α5β1及αvβ3具选择性但对αIIbβ3具有降低的结合活性的去整合蛋白变异体的需求。本发明可满足此一需求。
发明内容
本发明关于在一个或多个去整合蛋白(例如马来亚蝮素)的连接符区域、RGD环及C-端中,具有一个或多个突变的去整合蛋白变异体,其具有对αIIbβ3整合蛋白降低的结合活性,因而对血小板凝集造成弱抑制,但却与一个或多个α5β1及αv整合蛋白(例如αvβ1、αvβ3、αvβ5、αvβ6、及αvβ8)专一性地结合。
因此,在一总体方面上,本发明关于一包含选自由以下所组成的群组的至少一个的去整合蛋白变异体:
(a)一突变连接符(mutant linker),其包含至少一位于SEQ ID NO:332(SRAGKIC)氨基酸序列的1至5位点上的突变;
(b)一突变RGD环(mutant RGD loop),其包含选自由SEQ ID NO:329至331所组成的群组的氨基酸序列;以及
(c)一突变C-端(mutant C-terminus),其包含至少一位于SEQ ID NO:334(PRYH)氨基酸序列的1至4位点上的突变,
其中,相较于一不具有选自由该突变连接符、该突变RGD环以及该突变C-端所组成的群组的至少一个的去整合蛋白,该去整合蛋白变异体具有与αIIbβ3整合蛋白的降低结合活性。较佳的,相较于一不具有选自由该突变连接符、该突变RGD环以及该突变C-端所组成的群组的至少一个的去整合蛋白,该去整合蛋白变异体也具有与αvβ1、αvβ3、αvβ5、αvβ6、αvβ8及α5β1整合蛋白的至少一个的提高结合活性。
根据本发明的实施例,该去整合蛋白变异体可以为任何去整合蛋白的变异体,该任何去整合蛋白包括(但不限于)选自由以下所组成的群组的去整合蛋白:马来亚蝮素(rhodostomin)、白唇竹叶青蛇素(albolabrin)、百步蛇素(applagin)、墨西哥西海岸响尾蛇素(basilicin)、矛头蝮素(batroxostatin)、鼓腹巨蛇素(bitistatin)、西部亚种响尾蛇素(cereberin)、角响尾蛇素(cerastin)、西部菱背响尾蛇素(crotatroxin)、南美响尾蛇素(duressin)、丽纹龟壳花蛇素(elegantin)、黄绿龟壳花蛇素(flavoredin)、黄绿龟壳花蛇毒解离素(flavostatin)、日本蝮蛇素(halysin)、西伯利亚蝮蛇毒解离素(halystatin)、巴西蝮素(jararacin)、巴西蝮蛇毒解离素(jarastatin)、马来亚红口蝮素(kistrin)、亚马逊巨蝮素(lachesin)、西部亚种响尾蛇素(lutosin)、黑尾响尾蛇素(molossin)、韩国亚种短尾蝮素(salmosin)、白眉蝮素(saxatilin)、北美侏儒响尾蛇素(tergeminin)、黄绿龟壳花蛇毒解离素(trimestatin)、台湾龟壳花素(trimucrin)、台湾龟壳花去整合蛋白(trimutase)、乌苏里蝮素(ussuristatin)及草原响尾蛇素(viridin)。较佳的,该去整合蛋白变异体具有选自由SEQ ID NO:1至6所组成的群组的氨基酸序列的去整合蛋白的变异体。更佳的,该去整合蛋白具有SEQ ID NO:1氨基酸序列的马来亚蝮素的变异体。
在一较佳实施例中,该去整合蛋白变异体包含一突变RGD环、以及该突变连接符及该突变C-端中的至少一个,该突变RGD环包含至少一位于SEQ ID NO:333(RIPRGDMP)氨基酸序列的1至3、5、7及8位点上的突变。
在本发明的另一较佳实施例中,该去整合蛋白变异体包含一具有选自由SEQ ID NO:306至SEQ ID NO:318所组成的群组的氨基酸序列的突变连接符。
在本发明的又另一较佳实施例中,该去整合蛋白包含一具有选自该由SEQ ID NO:319至SEQ ID NO:328所组成的群组的氨基酸序列的突变C-端。
在本发明的一较佳实施例中,该去整合蛋白变异体包含一突变RGD环、以及一突变连接符及一突变C-端中的至少一个,该突变RGD环具有选自由SEQ ID NO:329至331所组成的群组的氨基酸序列,该突变连接符具有选自由SEQ ID NO:306至SEQ ID NO:318所组成的群组的氨基酸序列,该突变C-端具有选自由SEQ ID NO:319至SEQ ID NO:328所组成的群组的氨基酸序列。更佳的,该去整合蛋白包含阐述于本文中的突变RGD环、突变连接符以及突变C-端。
根据本发明的实施例,该去整合蛋白变异体包含选自由SEQ ID NO:7至SEQ ID No:179所组成的群组的氨基酸序列。较佳的,该根据本发明的一实施例的去整合蛋白变异体包含选自由SEQ ID NO:123、124、147、149及171所组成的群组的氨基酸序列。
较佳的,根据本发明的一实施例的去整合蛋白变异体经修饰,例如用以改善输送或稳定性。举例而言,该去整合蛋白变异体接上聚乙二醇(pegylated)或与一融合伴侣(fusion partner),例如白蛋白或抗体的可结晶区(Fc)结合(conjugated)。
在另一总体方面上,本发明关于一编码(encoding)如本发明所述的去整合蛋白变异体的多核苷酸,其可为一包含实际上可连接至编码该去整合蛋白变异体的DNA序列的调控序列(例如启动子)的表现载体(expression vector)。
本发明也关于一包含一编码如本发明所述的去整合蛋白变异体的多核苷酸的重组宿主细胞(recombinant host cell)。该宿主细胞可为一原核细胞、一酵母菌细胞、一昆虫细胞或一哺乳动物细胞。
本发明更关于一用以制造本发明的去整合蛋白变异体的方法,包含自根据本发明的一实施例的重组宿主细胞中生产该去整合蛋白变异体。
也提供一包含一本发明的去整合蛋白变异体及一药学上可接受的载体的医药组合物。
在又另一总体方面上,本发明关于治疗在一有需要的个体中与αvβ1、αvβ3、αvβ5、αvβ6、αvβ8及α5β1整合蛋白的至少一个相关的疾病,较佳为治疗与α5β1及αvβ3整合蛋白的至少一个相关的疾病的方法。该方法包含向该个体投予本发明的医药组合物。
在本发明的一实施例中,该整合蛋白相关的疾病是一选自由以下所组成的群组的血管新生相关的眼部疾病(angiogenesis-related eye disease):老年性黄斑病变(age-related macular degeneration)、糖尿病视网膜病变(diabetic retinopathy)、角膜神经血管增生病变(corneal neovascularizing disease)、局部缺血导致的神经血管增生视网膜病变(ischaemia-induced neovascularizing retinopathy)、高度近视(high myopia)及早熟性视网膜病变(retinopathy of prematurity)。
在本发明的另一实施例中,该整合蛋白相关的疾病是一选自由以下所组成的群组的癌症:转移性黑色素瘤、转移性前列腺癌、转移性乳癌、结肠直肠癌、肝癌、卵巢癌、子宫颈癌、胰脏癌、非小细胞肺癌及多形性神经胶母细胞瘤。
在另一总体方面上,本发明关于利用本发明的去整合蛋白变异体制造可治疗有需要的个体中与αvβ1、αvβ3、αvβ5、αvβ6、αvβ8及α5β1整合蛋白中至少一个相关的疾病的药剂。
附图说明
上述发明内容及以下实施方式应搭配附图阅读以获得更清楚的理解。应了解,本发明不限于附图所示的明确实施例。
在附图中:
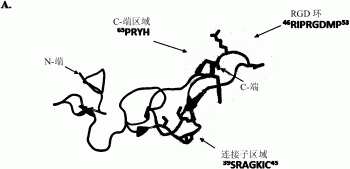
图1说明马来亚蝮素的相互作用图:(A)说明马来亚蝮素的连接符区域、RGD环及C-端区域之间的相互作用;以及(B)参与在马来亚蝮素与整合蛋白之间相互作用区域的氨基酸序列,根据本发明的一实施例的去整合蛋白变异体,其中可被突变的氨基酸残基被标示为“X”;
图2显示多种试剂对A375人类黑色素瘤细胞迁移所产生的抑制性:(A)野生型Rho、(B)AR-NP,一种根据本发明的一实施例的去整合蛋白变异体及(C)磷酸盐缓冲生理食盐水(PBS);
图3A是照片,其显示与未处理的控制组小鼠相较,以AR-NP蛋白或ARLDDL蛋白处理的C57BL/6小鼠在基质胶(MATRIGELTM plug)中的血管密度降低;
图3B是一直方图,其显示与未处理的控制组小鼠相较,以AR-NP蛋白或ARLDDL蛋白一天处理两次,5天后的C57BL/6小鼠在基质胶中的血红素含量降低;
图3C是一直方图,其显示与未处理的控制组小鼠相较,以AR-NP蛋白或ARLDDL蛋白一天处理一次,服用5天的C57BL/6小鼠在基质胶中的血红素含量降低;
图4A显示在一早熟性视网膜病变(ROP)老鼠模式中的血管新生,及以AR-NP蛋白处理可减少ROP老鼠的血管新生的照片,箭头处显示新血管的血管轮廓(BVPs);
图4B是一直方图,其显示以AR-NP蛋白处理可减少ROP老鼠的新血管的BVPs;
图4C是一直方图,其显示以AR-NP蛋白处理可减少ROP老鼠的内皮细胞的BVPs;
图5显示相较于未处理的控制组,以AR-NP蛋白(0.1μM)处理7天可抑制小鼠主动脉环上的生长:上图:以20倍放大倍率拍摄的影像;下图:以100倍放大倍率拍摄的影像;
图6显示ARLDDL蛋白(0.1μM&1μM)及AR-NP蛋白(0.1μM&1μM)两者都可抑制4-T1乳癌细胞的群落产生;
图7显示相较于未处理的控制组,AR-NP蛋白或ARLDDL蛋白可抑制RANKL引发的蚀骨细胞生成(RANKL-induced osteoclastogenesis):AR-NP蛋白(B及C);ARLDDL蛋白(D);控制组(A);
图8显示ARLDDL蛋白(0.1μM)及AR-NP蛋白(0.1μM)两者都可明显地抑制神经胶瘤入侵;
图9显示在Wistar大鼠中5mg/kg的AR-NP蛋白对血压及心跳速率影响并不显著;
图10显示在SCID小鼠中A375黑色素瘤的生长被AR-NP蛋白所抑制,比例尺:1公分;
图11显示在K-rasG12D基因转殖小鼠中肿瘤的生长被AR-NP(KG)蛋白所抑制;以及
图12显示在患U87肿瘤小鼠(U87-bearing mice)中脑肿瘤的生长被AR-NP(KG)蛋白所抑制。
具体实施方式
在背景技术及整篇说明书中引用或阐述了许多出版品、文章及专利;这些文献的全文各自并于此处以供参考。包括在本发明说明书中的文件、技术、材料、设备、文章或诸如此类的讨论是为了提供本发明的内容。这些讨论并非承认任意或所有这些材料成为任何所公开或请求的发明的背景技术。
除非另外定义,此处所用的所有技术及科学术语具有与本领域技术人员通常所了解的相同意义。否则,此处所用的这些术语具有如本发明书所定的意义。本文所引用的所有专利、已公开专利申请案及出版品并于此处以供参考,如全文阐述于此。须注意除非内文另外明确指出,否则本文及前述的权利要求书所用的单数形式的“一”、“该”包括复数形式。
如本文所用,“去整合蛋白”意指一类富含半胱氨酸的蛋白质,其为整合蛋白的有效的可溶性配体,且参与调控许多过程,例如细胞-细胞以及细胞-细胞外基质黏着、转移及入侵、细胞周期进程、许多后生动物生长过程中的分化及细胞形式特化、细胞死亡及凋亡。氨基酸主体的RGD(精氨酸-甘氨酸-天冬氨酸)在大多数单体去整合蛋白中是保守的,且位于弯曲环(整合蛋白结合环)的尖端上,其借由双硫键而稳定并自多胜肽炼的主体上凸出。所有自蛇毒中纯化的去整合蛋白都选择性地结合至血纤维蛋白原受器或标记血纤维蛋白原受器(例如αv-整合蛋白、α5β1整合蛋白及整合蛋白αIIbβ3),与其结合将会导致血纤维蛋白原依赖的血小板(fibrinogen-dependent platelet)凝集及其他由这些血纤维蛋白原受器所调节的生物活性被抑制。在本发明中有用的去整合蛋白的例子包括(但不限于):马来亚蝮素、黄绿竹叶青素(triflavin)、锯鳞蝰素(echistatin)、台湾龟壳花素、丽纹龟壳花蛇素、赤尾鲐素(trigramin)、百步蛇素。可用于本发明的去整合蛋白的例示性胜肽序列提供于SEQ ID NO:1至6。
如本文所用,“去整合蛋白变异体”意指经设计、功能性活化的蛋白质、或其多胜肽或任意衍生物,其包含自野生型去整合蛋白衍生或修饰或突变的氨基酸序列。相较于自然存在的去整合蛋白,去整合蛋白变异体含有一个或多个突变。该一个或多个突变可以是对自然存在的去整合蛋白取代(substitution)、删除(deletion)、或插入(insertion)一个或多个氨基酸。在一实施例中,相较于不具有该一个或多个突变的自然存在的去整合蛋白,去整合蛋白变异体对αIIbβ3整合蛋白具有较低的结合活性。更佳的,一去整合蛋白变异体与去整合蛋白αvβ1、αvβ3、αvβ5、αvβ6、αvβ8的一个或多个整合蛋白α5β1专一性地结合。最佳地,相较于自然存在的不具有该一个或多个突变的去整合蛋白,该去整合蛋白变异体具有与变异体αvβ3及变异体α5β1的一个或两个的较高的结合活性。
在某些实施例中,去整合蛋白变异体包含一来自毒液的经修饰Rho蛋白,其相较于自然存在的Rho含有至少一个氨基酸的取代、插入或删除。经修饰的Rho变异体及/或不同的去整合蛋白还包含转译后的修饰。
在一实施例中,本发明的去整合蛋白变异体包含一突变RGD环。于本文中,“突变RGD环”或“突变RGD区域”意指一包含一个或多个横跨去整合蛋白RGD环的氨基酸序列中的突变的胜肽。野生型去整合蛋白的RGD环包含与整合蛋白结合的RGD残基。举例而言,Rho的RGD环包含SEQ ID NO:333(RIPRGDMP)氨基酸序列。在本发明的较佳实施例中,一突变RGD环包含至少一个位于SEQ ID NO:333氨基酸序列1至3、5、7及8位点上的突变。更佳的,突变RGD环包含选自由SEQ ID NO:329至331所组成的群组的氨基酸序列。
在另一实施例中,本发明的去整合蛋白变异体包含突变连接符。在本文中,“突变连接符”或“突变连接符区域”意指一包含一个或多个横跨去整合蛋白连接符区域的氨基酸序列中的突变的胜肽。去整合蛋白的连接符区域位于紧邻RGD环的N端。举例而言,Rho的连接符区域包含SEQ ID NO:332(SRAGKIC)的氨基酸序列。在本发明的较佳实施例中,突变连接符包含至少一个位于SEQ ID NO:332氨基酸序列1至5位点上的突变。更佳的,突变连接符包含选自由SEQ ID NO:306至SEQ ID NO:318所组成的群组的氨基酸序列。
在又另一实施例中,本发明的一去整合蛋白变异体包含突变C-端。在本文中,“突变C-端”或“突变C-端区域”意指一包含一个或多个在去整合蛋白C-端区域的氨基酸序列中的突变的胜肽。去整合蛋白的C-端区域位于去整合蛋白的羧基端。举例而言,Rho的C-端包含SEQ ID NO:334(PRYH)的氨基酸序列。在本发明的较佳实施例中,突变C-端包含至少一个位于SEQ ID NO:334氨基酸序列1至4位点上的突变。更佳的,突变C-端包含选自由SEQ ID NO:319至SEQ ID NO:328所组成的群组的氨基酸序列。
在较佳实施例中,本发明的一去整合蛋白变异体包含去整合蛋白的突变RGD环、以及去整合蛋白的突变连接符及突变C-端的至少一个。
在更多较佳实施例中,本发明的一去整合蛋白变异体包含如本文所述的去整合蛋白的突变RGD环、突变连接符以及突变C-端。
本发明的一去整合蛋白变异体可包括自然存在及非自然存在的氨基酸。自然存在的氨基酸的例子包括(但不限于)一般形成胜肽、多胜肽及蛋白质的20个基本、自然存在的氨基酸的任一个。下表1表列20个自然存在的氨基酸。
表1
非自然存在的氨基酸自然产生或者化学合成的非蛋白氨基酸。非自然存在的氨基酸的例子包括(但不限于)β-氨基酸(β3及β2)、同源氨基酸、脯氨酸及丙酮酸的衍生物、三取代丙氨酸衍生物、甘氨酸衍生物、环取代苯丙氨酸及酪氨酸衍生物、线性核心氨基酸、N-甲基氨基酸等。
在本文中,“保守性取代”是指以另一个具有相同净电荷及接近相同大小与形状的氨基酸对一氨基酸进行取代。当其在侧链中的碳及杂原子的总数差距不超过约4时,具有脂肪族或经取代脂肪族氨基酸侧链的氨基酸具有接近相同的大小。当其侧链的分支数差距不超过1时,其具有接近相同的形状。在其侧链具苯基或经取代苯基的氨基酸被认为是具有大约相同的大小与形状。下列为五组氨基酸。以另一来自同一组的氨基酸取代一多胜肽中的氨基酸导致保守性取代:第1组:甘氨酸、丙氨酸、缬氨酸、亮氨酸、异亮氨酸、丝氨酸、苏氨酸、半胱氨酸及具有C1-C4脂肪族或C1-C4经羟基取代的脂肪族侧链(直链或单分支)的非自然存在氨基酸;第2组:谷氨酸、天门冬氨酸及具有经羧酸取代的C1-C4脂肪族侧链(未分支或一分支点)的非自然存在氨基酸;第3组:赖氨酸、鸟氨酸、精氨酸及具有经胺或胍基取代的C1-C4脂肪族侧链(未分支或一分支点)的非自然存在氨基酸;第4组:谷氨酰氨酸、天冬酰氨酸及具有经酰胺取代的C1-C4脂肪族侧链(未分支或一分支点)的非自然存在氨基酸;第5组:苯丙氨酸、苯甘氨酸、酪氨酸及色氨酸。
在本文中,“高度保守性取代”是指以另一个在侧链具有相同官能基且大小与形状几乎相同的氨基酸对一氨基酸进行取代。当其在侧链中的碳及杂原子的总数差距不超过约2时,具有脂肪族或经取代脂肪族氨基酸侧链的氨基酸具有几乎相同的大小。当其在侧链具有相同数目的分支时,其具有几乎相同的形状。高度保守性取代的例子包括缬氨酸取代亮氨酸、苏氨酸取代丝氨酸、天门冬氨酸取代谷氨酸及苯甘氨酸取代苯丙氨酸。
在本文中,术语“分离蛋白(isolated protein)”或“分离多胜肽(isolated polypeptide)”意指通过核酸(包括,特别是,基因体DNA、cDNA、重组DNA、重组RNA、或合成起始点的核酸、或其组合)编码的蛋白质,其中(1)不包含至少某些常见的蛋白质、(2)实质上不包含来自相同来源,例如来自相同细胞或物种的其它蛋白质、(3)由来自不同物种的细胞所表现、(4)由自然存在于来源细胞所分离的至少50%的多核苷酸、脂质、碳水化合物或其他材料、(5)与自然状态下连接“分离蛋白”的全部或部分多胜肽不相连(通过共价或非共价相互作用)、(6)与在自然状态下不相连的多胜肽协同性连接(通过共价或非共价相互作用)、或(7)在自然状态下不存在。较佳的,该分离蛋白本质上不含其他污染性蛋白质或多胜肽或者在其自然环境发现会干扰其医药、诊断、预防或研究的用途的其他污染物。
在本文中,术语“多核苷酸”、“核苷酸”、“寡核苷酸”及“核酸”可交换使用来意指包含DNA、RNA、其衍生物、或其组合的核酸。
在本文中,可交换使用术语“多胜肽”及“蛋白质”来表示由自然存在且非重组细胞、基因改造或重组细胞、或化学合成所产生,且包含具有原生蛋白质的氨基酸序列或在原生序列上删除、添加、及/或取代一个或多个氨基酸的分子的蛋白质。根据本发明,该去整合蛋白特别涵盖经修饰Rho蛋白或其片段或其变异体的多胜肽或蛋白质。在某些具体实施例中,去整合蛋白涵盖抑制整合蛋白活性的Rho蛋白或其片段或其变异体。在某些具体实施例中,去整合蛋白以αv-整合蛋白同功型(例如选自αvβ1、αvβ3、αvβ5、αvβ6、αvβ8、及整合蛋白α5β1的任意群组)为标靶。在某些其它具体实施例中,整合蛋白不为αIIbβ3。
在本文中,“宿主细胞”是个别细胞或者细胞培养物,该细胞培养物可为或已为任意重组载体或多核苷酸的一接受者。宿主细胞包括单一宿主细胞的子代,且该子代因自然、偶发、或蓄意的突变及/或改变而不须与原亲代细胞完全相同(在形态上或在总DNA补体上)。宿主细胞包括以本发明的重组载体或多核苷酸在生物体外或生物体内转染(transfect)或感染(infect)的细胞。包含本发明的重组载体的宿主细胞可称作“重组宿主细胞”。合适的宿主细胞包括原核或真核细胞,包括,举例而言,细菌、酵母菌、真菌、植物、昆虫、及哺乳动物细胞。
在本文中,术语“结合活性”意指去整合蛋白或去整合蛋白变异体与整合蛋白的结合,其导致对整合蛋白活性的抑制、阻断、中和、降低、消除、或影响的一个或多个。在某些实施例中,去整合蛋白或去整合蛋白变异体通过结合至整合蛋白及隔绝整合蛋白而与其它分子(例如其它ECM蛋白)结合来抑制整合蛋白活性。在某些其它实施例中,去整合蛋白或去整合蛋白变异体通过结合至整合蛋白及阻止整合蛋白触发细胞内下游讯息传递活动来抑制整合蛋白活性。
在本文中,术语“抑制”在本文的整合蛋白活性的上下文中,意指去整合蛋白或去整合蛋白变异体的性质,其降低整合蛋白的活性,可通过多种功能性检测方法,包括但不限于结合分析法、转移分析法、凋亡分析法、及细胞黏着分析法进行分析。在本发明的某些实施例中,整合蛋白是一包括αvβ1、αvβ3、αvβ5、αvβ6、αvβ8的αv-整合蛋白同功型。在某些其它具体实施例中,整合蛋白为α5β1。在某些进一步的实施例中,相较于不具有去整合蛋白或去整合蛋白变异体的控制组,去整合蛋白或去整含蛋白变异体可抑制大约0%至100%的整合蛋白活性。
在本文中,术语“选择性结合”、“选择性抑制”、“差别性结合”、“差别性抑制”意指对一特定标的整合蛋白分子展现与其它一个或多个整合蛋白不同的专一性的去整合蛋白或去整合蛋白变异体的性质。举例而言,本发明的去整合蛋白变异体选择性地结合至整合蛋白αvβ1、αvβ3、αvβ5、αvβ6、α5β1的一个或多个,因此对整合蛋白αvβ1、αvβ3、αvβ5、αvβ6、α5β1的一个或多个具有较其它整合蛋白(例如αIIbβ3)为高的亲和力。在某些实施例中,包含经修饰Rho片段的去整合蛋白变异体选择性地抑制选自由整合蛋白αvβ1、αvβ3、αvβ5、αvβ6、及整合蛋白α5β1所组成的群组的一个或多个整合蛋白的活性。在较佳实施例中,去整合蛋白变异体包含专一性抑制整合蛋白αvβ3及整合蛋白α5β1两个、抑制整合蛋白αvβ5及整合蛋白α5β1两个、或抑制整合蛋白αvβ6及整合蛋白α5β1两个的活性的经修饰Rho片段。
术语“同源性”、“同源的”在本文意指在对应去整合蛋白片段(例如Rho片段)之间,整个序列相似性及/或相同性的程度。高度序列同源性表示保有蛋白质活性。一些公开可取得的算法或软件程序可用于决定序列同源性。决定额外保守性或非保守性氨基酸取代的适当性及序列同源性的程度在本领域技术人员的能力范围内。
在本文中,“个体”意指任意动物,包括(但不限于)人类及其他灵长目动物、啮齿动物(例如小鼠、大鼠、及天竺鼠)、兔类动物(lagomorphs)(例如兔子)、牛属动物(例如牛)、绵羊(ovine)(例如绵羊(sheep))、山羊(caprine)(例如山羊(goat))、猪(porcine)(例如猪(swine))、马科动物(例如马)、犬(例如狗)、猫(feline)(例如猫(cat))、家禽(例如鸡、火鸡、鸭、鹅、其它鹑鸡类鸟等)及野生的或野生动物,包括(但不限于)动物,例如有蹄动物(例如鹿)、熊、兔类动物、啮齿动物、鸟等。该术语不倾向被限制于特定年纪或性别。因此,成年及新生个体以及胎儿,无论是雄性或雌性,都包含于该术语中。“有治疗需要”的个体是指通过抑制一个或多个整合蛋白活性治疗疾病及/或情况,以达到有利的治疗及/或预防的结果的个体。有利的结果包括减缓症状的严重性或延迟症状的开始、延长寿命及/或更快或更完全消除该疾病或情况。
“药学上可接受的载体”意指任意现有形式的非毒性固体、半固体或液体填料、稀释剂、封装原料、配方助剂、或赋形剂。药学上可接受的载体在所利用的剂量及浓度下对接受者呈非毒性且与配方中的其它成份相容。
在本文中,“药学上可接受的盐”意指化合物的衍生物,其中该亲代化合物通过产生其酸或碱盐来进行修饰。
在本文中,“与整合蛋白相关的疾病”意指任何需要医学介入或对其而言医学介入合意者的与整合蛋白相关的病况、病症、或症候群。此医学介入可包括治疗、诊断、及/或预防。
在本文中,“有效量”或“足够量”意指本发明所述去整合蛋白变异体的有效剂量以抑制、预防、或治疗特定疾病、病症、病况、或副作用的症状。
术语“治疗”意指降低特定疾病、病症、病况、或副作用的症状的发生频率、范围、严重性及/或持续时间。
术语“预防”意指抑制或避免特定疾病、病症、情况、或副作用的症状。
去整合蛋白变异体
在本发明中已发现多种来自蛇毒的去整合蛋白(例如来自马来亚蝮蛇的马来亚蝮素(Rho))的变异体,表现与一个或多个αv-整合蛋白(例如αvβ1、αvβ3、αvβ5、αvβ6、αvβ8中一个或多个)及其它整合蛋白(例如α5β1)选择性结合,及与αIIbβ3的降低的结合活性的不同能力。通过在感兴趣的去整合蛋白的连接符区域、RGD环及C-端的一处或多处上突变氨基酸序列,使其可具有与某些整合蛋白选择性结合的能力。
因此,本发明的一总体方面关于去整合蛋白变异体。根据本发明的一实施例,去整合蛋白变异体具有与αIIbβ3的降低的结合活性,且专一性地结合至α5β1、αvβ1、αvβ3、αvβ5、αvβ6、及αvβ8的至少一个。
较佳的,相较于衍生出该去整合蛋白变异体的野生型去整合蛋白,该去整合蛋白变异体具有与αIIbβ3的降低的结合活性,但具有与α5β1、αvβ3的至少一个的提高的结合活性。
举例而言,已发现在RGD环上的Rho突变(例如46XXXRXDXX53)可增加对αvβ3及/或α5β1整合蛋白的专一性,在C-端区域的突变(例如65XXXX68)可造成与αIIbβ3的较少结合(因此对血小板凝集的抑制较弱及较少的出血副作用),及在连接符区域的突变(例如39XXXXXIC45)也可减少与αIIbβ3的结合,其中三个区域各自以在野生型Rho中的氨基酸残基数目来辨别,且根据本发明的实施例,可被修饰(例如通过插入、删除、或取代)的氨基酸残基独立地被标示为“X”。
根据本发明的实施例,去整合蛋白变异体包含在RGD环中的突变(例如46XXXRXDXX53),即,一突变RGD环。
在一实施例中,一去整合蛋白变异体包含一具有共通序列(consensus sequence)49RXD51的突变RGD环。这些变异体的例子包括但不限于那些具有氨基酸序列选自由SEQ ID NO:7至24所组成的群组。
在另一实施例中,一去整合蛋白变异体包含一具有共通序列48XRGD51的突变RGD环。这些变异体的例子包括但不限于那些具有氨基酸序列选自由SEQ ID NO:25至42所组成的群组。
在另一实施例中,一去整合蛋白变异体包含一具有共通序列48XRGDXP53的突变RGD环。这些变异体的例子包括但不限于那些具有氨基酸序列选自由SEQ ID NO:43至61所组成的群组。
在另一实施例中,一去整合蛋白变异体包含一具有共通序列48XRGDMX53的突变RGD环。这些变异体的例子包括但不限于那些具有氨基酸序列选自由SEQ ID NO:62至78所组成的群组。
在另一实施例中,一去整合蛋白变异体包含一具有共通序列46XXPRGD51的突变RGD环。这些变异体的例子包括但不限于那些具有氨基酸序列选自由SEQ ID NO:79至94所组成的群组。
在另一实施例中,一去整合蛋白变异体包含一具有共通序列48XRXDXP53的突变RGD环。这些变异体的例子包括但不限于那些具有氨基酸序列选自由SEQ ID NO:95至101所组成的群组。
根据本发明的其它实施例,一去整合蛋白变异体包含一在C-端区域中的突变(例如65XXXX68),即,突变C-端。
在一实施例中,一去整合蛋白变异体包含一具有共通序列65PRXXXXX71的突变C-端。这些变异体的例子包括但不限于那些具有氨基酸序列选自由SEQ ID NO:102至107所组成的群组。
在另一实施例中,一去整合蛋白变异体包含一具有共通序列65PRXXXXX71的突变C-端,且更包含一如本文所述的突变RGD环。举例而言,该突变RGD环可具有48ARGDMP53(SEQ ID NO:335)共通序列。这些变异体的例子包括但不限于那些具有氨基酸序列选自由SEQ ID NO:115至119所组成的群组。
根据本发明的又其它实施例,一去整合蛋白变异体包含一在连接符区域中的突变(例如39XXXXXIC45),即,突变连接符。
在一实施例中,一去整合蛋白变异体包含一具有共通序列39KKKRTIC47(SEQ ID NO:306)的突变连接符。较佳的,该去整合蛋白变异体还包含一如本文所述的突变RGD环。举例而言,该突变RGD环可具有48XRXDXP53共通序列。这些变异体的例子包括但不限于那些具有氨基酸序列选自由SEQ ID NO:108至114所组成的群组。
根据本发明进一步的实施例,一去整合蛋白变异体包含一在连接符区域中的突变(例如39XXXXXIC45)、一在RGD环中的突变(例如46XXXRXDXX53)及一在C-端区域中的突变(例如65XXXX68)。这些变异体的例子包括但不限于那些具有氨基酸序列选自由SEQ ID NO:120至179所组成的群组。
鉴于本公开内容,适合本发明的目的的任意方法可用来制造本发明的去整合蛋白变异体。举例而言,去整合蛋白变异体可通过定点突变(site-directed mutagenesis)方法来建构。鉴于本公开内容,本发明的去整合蛋白变异体可利用本技术领域已知的方法表现。以细胞为基础(cell-based)的方法及无细胞(cell-free)方法适用于生产本发明的胜肽。以细胞为基础的方法一般涉及将核酸构筑(nucleic acid construct)在生物体外引入宿主细胞中及在适合表现的条件下培养该宿主细胞,然后自培养基或者宿主细胞中(例如通过打破宿主细胞),或自两者中收取胜肽。本发明也提供使用广为本技术领域所知在体外转录/转译的无细胞方法去生产去整合蛋白变异体的方法。
去整合蛋白变异体可通过一能编码经修饰氨基酸序列的经修饰去整合蛋白核苷酸序列来编码,而使得该多胜肽实质上降低对整合蛋白αIIbβ3受器阻断活性及/或提高对αvβ1、αvβ3、αvβ5、αvβ6、及αvβ8、及其它整合蛋白(例如α5β1)的一个或多个的专一性。通过修饰用于衍生自蛇毒的去整合蛋白的编码序列,可获得用于去整合蛋白变异体的编码序列。去整合蛋白变异体可选自马来亚蝮素、白唇竹叶青蛇素、百步蛇素、墨西哥西海岸响尾蛇素、矛头蝮素、鼓腹巨蛇素、西部亚种响尾蛇素、角响尾蛇素、西部菱背响尾蛇素、南美响尾蛇素、丽纹龟壳花蛇素、黄绿龟壳花蛇素、黄绿龟壳花蛇毒解离素、日本蝮蛇素、西伯利亚蝮蛇毒解离素、巴西蝮素、巴西蝮蛇毒解离素、马来亚红口蝮素、亚马逊巨蝮素、西部亚种响尾蛇素、黑尾响尾蛇素、韩国亚种短尾蝮素、白眉蝮素、北美侏儒响尾蛇素、黄绿龟壳花蛇毒解离素、台湾龟壳花素、台湾龟壳花去整合蛋白、乌苏里蝮素及草原响尾蛇素。
因此,本发明的另一总体方面关于一编码如本发明所述的去整合蛋白变异体的多核苷酸。本发明的又另一总体方面关于一包含一编码如本发明所述的去整合蛋白变异体的多核苷酸的宿主细胞。
一般而言,不论经修饰或未经修饰的异源胜肽可如上所述由其自身表现,或以融合蛋白表现,且不仅可包括分泌信号,而且可包括分泌性前导序列(leader sequence)。本发明的分泌性前导序列可引导某些蛋白质至内质网(endoplasmic reticulum,ER)或间质体(periplasma)。ER将膜结合蛋白与其他蛋白质分开。一旦被定位于ER,蛋白质可进一步被引导至高基氏体(Golgi apparatus)以分配至液胞(vesicle)(包括分泌性液胞、细胞膜、溶小体(lysosome)及其他胞器)。在间质体的状况下,蛋白质分泌至葛兰氏阴性菌(Gram negative bacterium)(例如大肠杆菌)之间质空间(periplasma space)中。
此外,去整合蛋白变异体可额外添加胜肽官能基(peptide moiety)及/或纯化标签。这些区域可在多胜肽的最终制备前移除。为了引发分泌或排出、改善稳定性、及促进纯化等诸多原因而对多胜肽添加胜肽官能基为本领域熟悉且例行的技术。合适的纯化标签包括,举例而言,V5、多组氨酸(polyhistidine)、抗生物素(avidin)、生物素(biotin)。将胜肽与化合物,例如生物素结合可使用本技术领域中所熟知的技术来达成。(Hermanson编着(1996)Bioconjugate Techniques;Academic Press)。也可使用本技术领域已知的技术将胜肽与放射性同位素、毒素、酵素、荧光标签、胶态金、核酸、温诺平(vinorelbine)及艾徽素(doxorubicin)结合。(Hermanson编着(1996)Bioconjugate Techniques;Academic Press;Stefano等人(2006))。
适合用于本发明的融合伴侣包括,举例而言,胎球蛋白(fetuin)、人类血清白蛋白、免疫球蛋白CH2/CH3区域(Fc)、及/或其一个或多个片段。也提供经结合的蛋白质,例如聚乙二醇的结合物。
本发明的胜肽也可以本领域已知的技术化学合成(例如,见Hunkapiller等人Nature,310:105 111(1984);Grant编着(1992)Synthetic Peptides,A Users Guide,W.H.Freeman and Co.;美国专利6,974,884))。举例而言,可以使用胜肽合成器或通过使用本领域已知的固相方法合成一对应多胜肽片段的多胜肽。
此外,如果需要,可以取代或插入的方式在多胜肽序列中加入非典型氨基酸或化学氨基酸类似物。非典型氨基酸包括但不限于常见氨基酸的D-异构物、2,4-二胺基丁酸、a-胺基异丁酸、4-胺基丁酸、胺基丁酸(Abu)、2-胺基丁酸、γ-胺基丁酸、ε-胺基己酸(Ahx)、6-胺基己酸、胺基异丁酸(Aib)、2-胺基异丁酸、3-胺基丙酸、鸟氨酸、正亮氨酸、正缬氨酸、羟脯氨酸、肌氨酸、瓜氨酸、高瓜氨酸、磺基丙氨酸、三级丁基甘氨酸、三级丁基丙氨酸、苯甘氨酸、环己基丙氨酸、b-丙氨酸、氟氨基酸、设计者氨基酸(designer amino acid),例如b-甲基氨基酸、钙-甲基氨基酸、钠-甲基氨基酸及一般氨基酸类似物。此外,氨基酸可以为D(右旋的)或L(左旋的)。
本发明的去整合蛋白变异体可通过标准方法而自化学合成及重组细胞培养物中回收及纯化,该方法包含但不限于硫酸铵或乙醇沉淀、酸萃取、阴离子或阳离子交换层析法、磷酸纤维素层析法、疏水作用层析法、亲合力层析法、氢氧基磷灰石层析法、及凝集素层析法。在一实施例中,选用高效液相层析法(HPLC)来纯化。当多胜肽在分离及/或纯化的过程中发生变性时,可选用熟知用于再折叠(refolding)蛋白质的技术以产生具活性的构型。
本发明的去整合蛋白变异体可以一个或多个各样亲水性聚合物进行修饰或与其共价结合以增加该胜肽的可溶性及循环半衰期。用于与胜肽结合的适宜非蛋白亲水性聚合物包括但不限于聚烷基醚,如以下例子所列示:聚乙二醇、聚丙二醇、聚乳酸、聚乙醇酸、聚氧化烯烃、聚乙烯醇、聚乙烯吡咯烷酮、纤维素及纤维素衍生物、聚葡萄糖及聚葡萄糖衍生物。一般而言,这些亲水性聚合物的平均分子量在约500道尔顿(dalton)至约100,000道尔顿,约2,000道尔顿至约40,000道尔顿,或约5,000道尔顿至约20,000道尔顿的范围。该胜肽可利用下列文献所述的任意方法而与这些聚合物一起衍生或与的结合:Zallipsky,S.(1995)Bioconjugate Chem.,6:150-165;Monfardini,C.等人(1995)Bioconjugate Chem.,6:62-69;美国专利4,640,835;4,496,689;4,301,144;4,670,417;4,791,192;4,179,337,或WO 95/34326。
医药组合物
本发明的另一总体方面关于一包含一本发明的去整合蛋白变异体及一药学上可接受载体的医药组合物。视需要,该医药组合物可被调配成固体、半固体、液体或气态形态的制剂,例如锭片、胶囊、粉末、颗粒、软膏、溶液、栓剂、注射剂、吸入剂、喷雾剂。以下方法及赋形剂仅为示例且不具任何限制性。
在一些实施例中,本发明的去整合蛋白变异体与本技术领域所知的广泛的药学上可接受的载体、赋形剂及稀释剂一起形成配方而提供。这些医药载体、赋形剂及稀释剂包括于USP药学赋形剂一览表所列者。USP and NF Excipients,Listed by Categories,p.2404-2406,USP 24NF 19,United States Pharmacopeial Convention Inc.,Rockville,Md.(ISBN 1-889788-03-1)。药学上可接受的赋形剂,例如载剂、佐剂、载体、或稀释剂大众可轻易取得。此外,药学可接受的辅助物质,例如pH调整剂及缓冲剂、张力调整剂、稳定剂、润湿剂及诸如此类大众可轻易取得。
适宜的载体包括(但不限于)水、葡萄糖、海藻糖、组氨酸、甘油、生理食盐水、乙醇、及其组合。该载体可包含额外的辅剂,例如润湿剂或乳化剂、pH缓冲剂、或促进该配方的效果的佐剂。外用的载体包括液体石油、十六酸异丙脂、聚乙二醇、乙醇(95%)、聚氧乙烯单月桂酸酯(polyoxyethylene monolaurate)(5%)于水中的溶液、或月桂基硫酸钠(sodium lauryl sulfate)(5%)于水中的溶液。视需要可添加其它材料,例如抗氧化剂、保湿剂、黏度安定剂、及相似剂。也可包括透皮促进剂(percutaneous penetration enhancer),例如月桂氮酮(Azone)。
用于制备这些剂型的实际方法对本领域技术人员是已知的,或是显然的。所投用的组合物或配方,不论在何情况下,包含足以在接受治疗的个体内达到所需状态的剂量。
根据某些实施例,本发明的去整合蛋白变异体可借由在水性或非水性溶剂,例如植物或其他相似的油、合成的脂肪酸甘油酯、较高脂肪酸的酯类、或丙二醇内溶解、悬浮或乳化而调配成供注射用的制剂,并如需要,可添加现有添加物,例如助溶剂、等张剂、悬浮剂、乳化剂、稳定剂及防腐剂。也可使用如本技术领域中所现有的其它以口服或注射方式递送的配方。
在医药剂型中,本发明的医药组合物可以以其药学上可接受盐类的形式投药,或其也可单独使用或适当地与其它具药学活性的化合物联合与组合。该组合物根据可能的投药方式的形态来调配。在一较佳实施例中,该医药组合物调配成以注射的方式投药,例如调配成供注射的液体形式。
治疗方法
本发明也关于对有需求的个体使用该去整合蛋白变异体来治疗及/或预防与一或多种选自由α5β1、αvβ1、αvβ3、αvβ5、αvβ6及αvβ8所组成的群组的整合蛋白相关的疾病。这些疾病包括但不限于骨质酥松症、骨肿瘤或骨癌生长及与其相关的症状、血管新生相关的肿瘤生长及转移、骨骼中的肿瘤转移、恶性肿瘤引起的高血钙症、血管新生相关的眼部疾病、派杰氏症(Paget’s disease)、风湿性关节炎、及退化性关节炎。该方法包含对该有治疗需求的个体投予一有效治疗剂量的医药组合物,包含本发明的去整合蛋白变异体及药学上可接受载体。
在本发明的一实施例中,本发明的去整合蛋白变异体用于治疗及/或预防一血管新生相关的眼部疾病,其包括但不限于老年性黄斑病变、糖尿病视网膜病变、角膜神经血管增生病变、局部缺血导致的神经血管增生视网膜病变、高度近视、及早熟性视网膜病变。
在本发明的另一实施例中,本发明的去整合蛋白变异体用于治疗及/或预防一血管新生相关的疾病,包括但不限于癌症、眼部相关疾病、例如黄斑部退化、水肿。
在另一实施例中,本发明的去整合蛋白变异体与存在于眼角膜的αv-整合蛋白(αvβ5、αvβ6、及αvβ8)结合,调节转化生长因子β(TGFβ)的活化以治疗相关疾病。这些疾病包括眼部疾病、关节炎及癌症。在另一方面,该发明的多胜肽一抗血管新生药物,用于缓解关节炎疼痛并预防因这些疾病引起且具破坏性血管所造成的关节损坏。证据也证实该发明的多胜肽与现有化学疗法或放射性疗法结合时,可同时通过不同策略成为有用攻击癌症的“多重弹头”方法的一部分。
在本发明的又另一实施例中,本发明的去整合蛋白变异体用于治疗及/或预防骨质酥松症。骨质酥松症与选自由以下所组成的群组的病理状态有关:停经后雌激素不足、续发性骨质酥松症、风湿性关节炎、卵巢切除、派杰氏症、骨癌、骨肿瘤、退化性关节炎、蚀骨细胞形成增加、蚀骨细胞活性增加。此外,该骨质酥松症包括但不限于卵巢切除引起的骨质酥松症或骨质流失、及停经后骨质酥松症或骨质流失。
本发明的又另一实施例是一利用该去整合蛋白变异体于治疗及/或预防在哺乳类(包括人类)中因卵巢切除或停经后骨质酥松症所引起的病理性变化的方法。该方法包括对该有需要的哺乳类投予有效治疗剂量的分离多胜肽、或其药学上可接受的盐类,其相较于野生型去整合蛋白具有对整合蛋白αvβ1、αvβ3、αvβ5、αvβ6、或α5β1受器的拮抗活性,及实质上降低对整合蛋白αIIbβ3受器的阻断活性,因此可治疗及/或预防哺乳类动物因卵巢切除所引起的生理变化。
在另一方面,本发明提供一用于抑制血小板凝集的方法,包含对一有这些治疗需求的个体投予有效量的本发明的去整合蛋白变异体或本发明的医药组成物。
本发明的去整合蛋白变异体可通过全身性注射,例如通过静脉注射;或通过注射或施加至相关位点,例如通过直接注射、或当该位点在手术中暴露时直接施加至该位点;或举例而言,如果该疾病位于皮肤上,可通过局部施用而投予至一有治疗需求的个体。
本发明的去整合蛋白变异体可作为单一药物治疗。或者,本发明的去整合蛋白变异体可与标准方案结合使用以治疗整合蛋白相关疾病。举例而言,本发明的多胜肽可与具有效治疗剂量的一种或多种其它药剂一并使用。较佳的,另一药剂选自由以下所组成的群组:抗癌药剂、抗发炎药剂、免疫调整药剂及抗骨质酥松药剂。较佳的,抗癌药剂选自由以下所组成的群组:抗血管新生药剂、细胞毒性药剂及抗肿瘤药剂。其它药剂可以在本发明的胜肽投予之前、同时、或之后投予。
在一些实施例中,本发明的去整合蛋白变异体对于对抗与高度表现造骨蛋白(osteopontin)有关的癌症特别有效。在较佳实施例中,本发明的多胜肽可抑制造骨蛋白所引起的肿瘤入侵。
去整合蛋白变异体可以多种方式投予,包括经口、口腔、鼻腔、直肠、肠胃外、腹膜、皮内、经皮、皮下、静脉、动脉、心内、心室内(intraventricular)、颅内、气管内、及脊髓投药等,或除此之外可通过植入或吸入方式投药。
以下本发明的实例为进一步说明本发明的本质。应了解以下实例并非用以限制本发明,且本发明的保护范围由前述权利要求书来界定。
实例
实例1:表现野生型Rho及Rho突变种(去整合蛋白变异体)的表现载体的建构
编码Rho的脱氧核醣核酸(DNA)是由在毕赤酵母(Pichia pastoris)中优先使用的密码子所组成。Rho DNA通过聚合酶连锁反应(PCR)与具有EcoR1辨认区(recognition site)以及编码六个组氨酸残基以用于促进纯化的正股引子(sense primer)5’-GAATTCGAATTCCATCATCATCATCATCATCATGGTAAGGAATGTGACTGTTCT-3’(SEQ ID NO:183)放大。反股引子(antisense primer)具有5’-CCGCGGCCGCGGTCAGTGGTATCTTGGACAGTCAGC-3’(SEQ ID NO:180)或5’-CCGCGGCCGCGGTTAGTGGTATCTTGGACAGTCAGC-3’(SEQ ID NO:184)序列,包含Sac II辨认区及TCA(或TTA)终止密码子。纯化PCR产物然后接合(ligate)至酵母菌重组载体(pPICZαA)的Eco R1及Sac II区。该重组质体用来转殖(transform)DH5α菌株,且以低盐溶菌肉汤(LB)(在pH 7.0下1%胰化蛋白、0.5%酵母菌萃取物、0.5%氯化钠、1.5%琼脂)及25微克/毫升(μg/ml)抗生素吉欧霉素(Zeocin)在琼脂平板上筛选群落。
编码Rho的突变体的多种DNA构成物(DNA construct)是通过利用重叠寡核苷酸策略的PCR与含有EcoRI及SacII限制酶切位点的引子来合成及放大。为了说明目的,表2列出一些去整合蛋白变异体的共通序列,及根据本发明的实施例用于建构这些变异体的引子,其中引子序列以5’至3’呈现(左至右)。
鉴于本公开内容,编码包含于本发明的其它变异体的表现载体已经用相似的方式建构或可用相似的方式建构。多种用于合成或确认去整合蛋白变异体的引子列于SEQ ID NO:180至305。
实例2 Rho突变体的表现及纯化
在Pichia pastoris中马来亚蝮素突变体及变异体的蛋白质表现是根据稍微修饰的Pichia EasyCompTM套组操作说明进行。简言之,含有编码马来亚蝮素或去整合蛋白的变异体的DNA的共10微克质体以SacI酵素作用后将形成线性质体。Pichia菌株X33通过热休克方法,使用来自 的EasyCompTM套组将线性质体转殖到Pichia基因体。该转殖株通过单一交叉在5’AOX1基因座整合。使用PCR扩增技术分析转殖的Pichia菌株以确定Rho基因是否已整合入该Pichia基因体,且菌株通过酶解酶(Lyticase)(Sigma)溶解。群落在含有酵母浸出蛋白胨葡萄糖(YPD)(1%酵母菌萃取物、2%蛋白胨、2%葡萄糖、及2%琼脂)及100微克/毫升吉欧霉素的琼脂平板上筛选。为了挑选表现最高去整合蛋白的变异体的群落,筛选若干具多复本去整合蛋白插入的群落。
重组Rho突变体如下制造:经筛选的群落是在30℃下含有100微克/毫升吉欧霉素的YPD培养基(1%酵母菌萃取物、2%蛋白胨、及2%葡萄糖)中生长。48小时后,通过离心收集细胞及在1升的最小甲醇培养基(含有1.34%具硫酸铵不具氨基酸的酵母菌氮基底及4x10-5%生物素)中生长。每24小时添加一次总共1%的甲醇以引发Rho或变异体的表现,历时2天。通过离心收集上清液并以5升的缓冲液A(5mM EDTA、8M尿素、10mM钠-磷酸盐缓冲液、pH 7.7)透析。该最终溶液装入镍-螯合管柱且以200mM咪唑(imidazole)的梯度洗涤。通过HPLC(反相C18HPLC)进一步纯化该重组马来亚蝮素及去整合蛋白的变异体。经纯化的去整合蛋白的重组变异体,通过tricine-SDS-PAGE判断,具有大于95%的纯度。
表2用于建构Rho及Rho变异体的引子的说明
实例3通过抑制细胞黏附实验分析Rho突变种对不同αv整合蛋白及α5β1整合蛋白的选择性
Rho突变体及变异体的抑制活性通过如前所述的细胞黏着抑制实验来评估(Zhang等人,1998J Biol Chem 73:7345-7350)。CHO-αIIbβ3细胞至血纤维蛋白原、CHO-αvβ3细胞至血纤维蛋白原、K562细胞至纤网蛋白(fibronectin)、HT-29细胞至玻璃黏结蛋白及HT-29细胞至纤网蛋白的黏结用来测定受试蛋白对整合蛋白αIIbβ3、αvβ3、α5β1、αvβ5及αvβ6的抑制活性。简言之,96-孔Immulon-2微量滴定板(Costar,纽约州康宁市(Corning,NY))以含有50至500nM的上述基质蛋白的100微升经磷酸盐缓冲生理食盐水(PBS:10mM磷酸盐缓冲液,0.15M氯化钠、pH 7.4)涂覆,且在4℃下过夜培养。基质及其涂覆浓度血纤维蛋白原(Fg)200微克/毫升、玻璃黏结蛋白(Vn)50微克/毫升及纤网蛋白(Fn)25微克/毫升。实验中具非专一性蛋白质的结合作用通过在每个孔中加入200微升的热变性1%牛血清白蛋白(BSA)(Calbiochem)在室温下共同培养1.5小时来阻断,之后去除热变性BSA且以200微升的PBS清洗每个孔两次。
表现整合蛋白αvβ3(CHO-αvβ3)及αIIbβ3(CHO-αIIbβ3)的CHO细胞由Y.Takada博士(斯克里普斯学术机构(Scripps Research Institute))所提供且保存于DMEM中。人类红血球性白血病K562及结肠直肠腺癌HT-29细胞购自ATCC且培养于含有5%FCS的洛斯维-帕克纪念研究所(Roswell Park Memorial Institute,RPMI)-1640培养基中。在含有1mM EDTA的PBS缓冲液中清洗收获的K562及HT-29细胞,且在含有1mM MgSO4、2mM CaCl2及500μM MnCl2的台氏缓冲液(Tyrode’s buffer)(150mM NaCl、5mM KCl、及10mM Hepes,pH7.35)中再悬浮。稀释细胞(CHO、K562、及HT-29)至3x105细胞/毫升,且100微升的该细胞用于该实验。添加Rho及其突变体至经培养细胞且在37℃、5%CO2下培养15分钟。Rho及其变异体作为抑制剂在0.001至500μM下使用。然后将该经处理细胞添加进该经涂覆盘并在37℃、5%CO2下反应1小时。之后去除该培养溶液,且通过以200微升的PBS清洗两次来移除未黏着细胞。
通过结晶紫染色法计量黏结细胞。简言之,以100微升的10%福尔马林固定该孔10分钟并干燥。然后添加50微升的0.05%结晶紫进入该孔在室温下20分钟。以200微升的蒸馏水清洗每个孔四次并干燥。染色通过添加150微升的染色溶液(50%酒精及0.1%乙酸)达成。吸亮度的结果在600纳米吸收光谱下读取,且该读取值对应黏结细胞的数量。抑制被定义为%抑制=100–[OD600(Rho野生型或去整合蛋白处理的样品)/OD600(未处理的样品)]x100。
IC50被定义为抑制50%由特定整合蛋白所调节的细胞黏结所需的去整合蛋白变异体浓度(nM)。因此,具较低的IC50的去整合蛋白变异体表示其在抑制各自的整合蛋白的细胞黏结活性中具有较好的专一性与活性效力,因此去整合蛋白变异体对该各自的整合蛋白有较高的结合活性(或选择性)。IC50的结果总结如下述表3至14。
一系列涉及RGD环区域(R50XD、48XRGD、ARGD52XP、ARGDM53X、46X47XPRGD、及ARGD51X52X)、连接符区域(39X40X41X42X43X)及C-端区域(66X67X68X69X70X、66XLYG、D67XY)的Rho突变体重组地表现及纯化至一致性。使用细胞黏结及血小板凝集实验测定其整合蛋白-结合亲合力。已发现,马来亚蝮素的变异体或在这些区域具一个或多个修饰的去整合蛋白对αvβ3、αvβ5、αvβ6、α5β1及αIIbβ3具有不同的选择性结合亲合力(表3至14)。
举例而言,已发现在RXD结构区域(motif)具有某些突变的Rho变异体,其中,该“Gly50(G)”残基被Leu(L)、Val(V)、Ile(I)、Glu(E)、Asp(D)、Gln(Q)、Phe(F)、Trp(W)、His(H)、Lys(K)、或Arg(R)取代,依以下顺序具有其最高的对整合蛋白效果:αIIbβ3(~1686倍)>α5β1(~586倍)>αvβ5(~348倍)>αvβ6(~179倍)>αvβ3(~26倍),显示其对αvβ3的结合选择性(表3)。在XRGD结构区域具有突变的Rho变异体,其中该P48残基被其他氨基酸取代,依以下顺序具有其最高的对整合蛋白效果:α5β1(~71倍)>αIIbβ3(~41倍)>αvβ3(~5倍)(表4)。在ARGDXP结构区域具有突变的Rho变异体,其中该M52残基被其他氨基酸取代,依以下顺序具有其最高的对整合蛋白效果:αIIbβ3(~209倍)>α5β1(~122倍)>αVβ3(~14倍)(表5)。在ARGDMX结构区域具有突变的Rho变异体,其中该P53残基被其他氨基酸取代,依以下顺序具有其最高的对整合蛋白效果:αIIbβ3(~258倍)>α5β1(~45倍)>αVβ3(~40倍)(表6)。在XXPRGD结构区域具有突变的Rho变异体,其中,该R46及I47残基是被其他氨基酸取代,依以下顺序具有其最高的对整合蛋白效果:αIIbβ3(~73倍)>α5β1(~19倍)>αVβ3(~10倍)(表7)。这些结果显示在RGD环中的突变在整合蛋白αIIbβ3及α5β1中展现对抑制活性的显著影响,但对αVβ3整合蛋白则否。
马来亚蝮素的突变体或具有除RGD结构区域外的一个或多个修饰(例如在连接符区域或C-端中)的去整合蛋白展现选择性结合至αVβ3、αVβ5、αVβ6、α5β1、或αIIbβ3的能力(表8至14)。举例而言,在连接符区域(39X40X41X42X43X)具有突变的Rho变异体,其中,该SRAGK被KKKRT、KKART、MKKGT、IEEGT、MKEGT、AKKRT、KAKRT、KKART、KKKAT、KKKRA、KAKRA及SKAGT氨基酸取代,依以下顺序具有其最高的对整合蛋白效果:αIIbβ3(~2倍)>α5β1(~5倍)>αVβ3(~14倍)(表8)。这些结果显示在Rho连接符区域的突变展现在整合蛋白αVβ3中对抑制活性的显著影响。
在C-端区域(66X67X68X69X70X)具有突变的Rho变异体,其中,该RYH被RYH、RNGL、RGLYG、RGLY、RDLYG、RDLY、RNGLYG、及RNPWNG氨基酸取代,依以下顺序具有其最高的对整合蛋白效果:αIIbβ3(~13倍)>αVβ5(~8倍)=αVβ6(~8倍)>αVβ3(~4倍)>α5β1(~2倍)(表9)。这些结果显示在Rho的C-端区域的突变展现在整合蛋白αIIbβ3、αVβ5、αVβ6中对抑制活性的显著影响。
在C-端区域66XLYG具有突变的Rho变异体,其中该残基66位置被G、P、R、K、Y、D及E氨基酸取代,依以下顺序具有其最高的对整合蛋白效果:αIIbβ3(~6493倍)>α5β1(~40倍)>αvβ5(~8倍)>αvβ6(~6倍)>αvβ3(~1倍),显示其对整合蛋白αIIbβ3及α5β1的显著影响(表10)。
通过修饰去整合蛋白(Rho)的RGD环区域、连接符区域及C-端区域,成功地得到对整合蛋白αvβ3及α5β1具专一性的去整合蛋白(Rho)变异体。举例而言,突变体<
去整合蛋白变异体及其医药用途专利购买费用说明
![]()
Q:办理专利转让的流程及所需资料
A:专利权人变更需要办理著录项目变更手续,有代理机构的,变更手续应当由代理机构办理。
1:专利变更应当使用专利局统一制作的“著录项目变更申报书”提出。
2:按规定缴纳著录项目变更手续费。
3:同时提交相关证明文件原件。
4:专利权转移的,变更后的专利权人委托新专利代理机构的,应当提交变更后的全体专利申请人签字或者盖章的委托书。
Q:专利著录项目变更费用如何缴交
A:(1)直接到国家知识产权局受理大厅收费窗口缴纳,(2)通过代办处缴纳,(3)通过邮局或者银行汇款,更多缴纳方式
Q:专利转让变更,多久能出结果
A:著录项目变更请求书递交后,一般1-2个月左右就会收到通知,国家知识产权局会下达《转让手续合格通知书》。
动态评分
0.0