专利摘要
本发明公开了一种基于稀土金属化合物的交叉偶联反应及应用,属于有机合成技术领域。所述反应方程式如下:;其中,Ln是稀土金属中的一种;R1,R2和R3是与稀土金属相连的三个取代基团;-R1、-R2、-R3分别独立为-C-型、-C=型、-C≡型、-NH-型、-N=型、-O-型、-S-型、-PH-型、-P=型中的任一种。所述反应步骤为:(1)将催化剂和配体溶解,得到混合物c;(2)向混合物c中加入反应物1,再加入溶解的反应物2;反应1~3h;(3)采用柱层析进行分离与提纯,得到目标产物。所述交叉偶联反应简单易操作,产率高,反应速度快,选择性好,分离提纯简单。
权利要求
1.一种基于稀土金属化合物的交叉偶联反应,其特征在于,所述反应方程式如下:
其中,反应物1中T=芳基、芳杂环基、烷基、烯基、炔基、烯丙基或环戊二烯基及它们衍生物中的任一种;X=H、F、Cl、Br、I、CN或OTf中的任一种;其中,OTf为三氟甲磺酸;
反应物2中Ln是稀土金属中的一种;R1,R2和R3是与稀土金属相连的三个取代基团,且三个取代基团相同或不同;
-R1、-R2、-R3分别独立为-C-型、-C=型、-C≡型、 -NH-型、-N=型、-O-型、-S-型、-PH-型、-P=型中的任一种;
R=氢、卤素、饱和脂肪烃、不饱和脂肪烃或芳香烃,X’=氮、氧、硫或磷;
催化剂为零价钯化合物、二价钯化合物或含钯的混合物;
L为含有碳、氮、氧、硫和磷原子中一种以上的中性配体;
溶剂为有机溶剂;
所述的交叉偶联反应的步骤如下:
(1)在无水无氧环境下,分别称取催化剂和配体,同时加入到干燥的反应器中,并用溶剂溶解,搅拌均匀,得到混合物c;
(2)向混合物c中加入反应物1,继续搅拌3~10min,得到混合物d;然后,将反应物2溶于溶剂中,得到浓度为0.3~0.6mol/L的溶液e,将溶液e滴加到混合物d中,滴加时间不少于1h;滴加完毕后,继续反应1~3h;
(3)用柱层析的方法进行分离与提纯,得到目标产物;
其中,步骤(1)中催化剂为反应物1的2.5~10%mol,配体为反应物1的5~15%mol;催化剂和配体的摩尔比为1:1~1:5;
步骤(2)中反应物1与反应物2的摩尔比为5:2;
步骤(1)和(2)所用溶剂相同;
步骤(3)柱层析中洗脱剂为石油醚和乙酸乙酯的混合溶液,其中,石油醚和乙酸乙酯的摩尔比为1:0~1:0.1;
步骤(2)中反应在-30~120℃下进行。
2.根据权利要求1所述的一种基于稀土金属化合物的交叉偶联反应,其特征在于,所述反应物1为以下物质中的一种:
3.根据权利要求1所述的一种基于稀土金属化合物的交叉偶联反应,其特征在于,所述反应物2为以下物质中的一种:
4.根据权利要求1所述的一种基于稀土金属化合物的交叉偶联反应,其特征在于,催化剂为Pd/C、Pd[P(t-Bu)3]2、Pd(PPh3)4、Pd(dba)2、Pd2(dba)3、Pd(acac)2、PdCl2、Pd(OAc)2、PdCl2(PhCN)2、PdBr2(PhCN)2、Pd(OCOCF3)2、PdCl2(PPh3)和PdCl2(NH3)2中的一种;
其中,t-Bu为叔丁基;Ph为苯基;dba为二亚苄基丙酮;acac为乙酰丙酮;OAc为醋酸根;Pd/C催化剂中Pd的化合价为0价,以Pd/C催化剂的总质量为100%计,Pd的质量百分含量为5%或10%。
5.根据权利要求1所述的一种基于稀土金属化合物的交叉偶联反应,其特征在于,催化剂为Pd2(dba)3,Pd[P(t-Bu)3]2和Pd(OAc)2中的一种。
6.根据权利要求1所述的一种基于稀土金属化合物的交叉偶联反应,其特征在于,所述配体为以下物质中的一种:
其中,iPr为异丙基,Ph为苯基,Bn为苄基,Me为甲基,Et为乙基,X”为氮原子、氧原子、硫原子或磷原子。
7.根据权利要求1所述的一种基于稀土金属化合物的交叉偶联反应,其特征在于,所述配体结构如下:
8.根据权利要求1所述的一种基于稀土金属化合物的交叉偶联反应,其特征在于,所述溶剂为正己烷、N,N—二甲基甲酰胺、四氢吠喃、l,4—二氧六环、甲苯、甲醇、乙醚、苯、二氯甲烷、1,2—二氯乙烷、氯仿、乙腈和二甲基亚砜溶剂中的一种。
9.根据权利要求1所述的一种基于稀土金属化合物的交叉偶联反应,其特征在于,所述溶剂为甲苯。
10.一种如权利要求1所述的基于稀土金属化合物的交叉偶联反应的应用,其特征在于,所述交叉偶联反应应用于生物、医药、农药、有机材料和精细化工学科领域。
说明书
技术领域
本发明涉及一种基于稀土金属化合物的交叉偶联反应及应用,具体涉及一种基于稀土金属化合物为底物及助催化剂的交叉偶联反应及应用,属于有机合成技术领域。
背景技术
碳原子是构成生命及有机大分子骨架的基本元素。在有机合成化学中,通过碳原子之间或碳原子与其他原子之间的偶联反应,可以轻松合成出几千万种具有高层次碳基骨架结构的新的有机物质。偶联反应,也作偶连反应、耦联反应、氧化偶联,是由两个有机化学单位进行某种化学反应而得到一个有机分子的过程,通常具体是指有机金属试剂和亲电子有机试剂在由第Ⅷ副族的过渡金属主催化剂和第Ⅰ、第Ⅱ副族的助催化剂作为联合催化体系的作用下,从而形成碳-碳键,碳-氧键,碳-氮键,碳-硫键,或者碳-M(M指金属)键的反应。自从1845年Kolbe通过乙酸的合成而构建出一个碳-碳键以后,碳-碳键的构建就开始在有机合成领域充当了一个非常重要的角色。然而,碳原子本身是十分稳定的,在化学反应中并不活泼,从而就得想办法能够激活碳原子,使之更容易参与反应,与其他原子相连接。近几十年来,通过过渡金属(特别是钯催化剂和助催化剂)的使用使得碳-碳键的发展尤为迅速。过渡金属催化碳-碳交叉偶联反应通常是指在过渡金属催化剂作用下弱亲核试剂(烯烃/有机金属/元素化合物)和亲电试剂(有机卤、拟卤等)反应产生新的碳-碳单键的过程,是现代有机合成中形成碳-碳键的重要方法之一。
事实上,早在1971年日本化学家Mizoroki等人就首次报道了在醋酸钾存在下,氯化钯催化碘苯与苯乙稀在甲醇中、120℃和加压条件下偶联为二苯乙烯的反应。
随后,Heck等人发表了一系列论文来说明在室温下发生的碳碳加成反应。他们将PhPdCl与乙烯反应直接得到苯乙烯。后来,Fitton和Mckeon等人发现Pd(0)的膦配体与卤代芳烃氧化加成可以形成Ar-Pd(L2)-X配合物,受这一发现的启发,1972年Heck等人发展了用催化剂Pd催化烯烃的芳基化反应,也就是现在被广泛使用的Heck反应。
1976年,Negishi等人在有机卤化物的钯催化交叉偶联方向开展了一系列的研究以开发更具化学选择性的有机金属试剂。1977年,Negishi等人取得了突破性进展,反应利用有机锌试剂和卤代芳香烃的偶联来增长碳链,副产物很少。锌试剂可以有多种方法来制备,一般是在反应过程中原位生成使用。该反应对于多种官能团都是稳定的,并且反应条件温和,选择性和产率较高,唯一的不足就是锌试剂对水敏感,致使其使用范围受到限制。
1979年,Suzuki和Miyaura等人将硼酸衍生物作为亲核试剂引入钯催化的联芳香烃制备中,相比于之前的Heck反应,这样的改进拓宽了钯催化剂的使用范围。
1999年,Fu小组报道了使用大位阻、富电子的P(t-Bu)3作为配体结合Pd2(dba)3,能有效地催化氯苯与双键的偶联,产率可达到80%,但由于P(t-Bu)3配体易被氧化,且此催化剂对于含有吸电子基团的氯苯活性较低,因此很快又发展了环钯化合物。最早的环钯催化剂是Herrmann催化剂,因其含磷量低、高效及结构新颖而成为很好的催化剂,其催化反应15h可达到90%的转化率,此后还有研究学者对卡宾类配体以及纳米钯催化的Heck反应进行深入探讨。
在诸多的碳-碳以及碳-杂催化偶联反应之中,过渡金属的催化作用尤为关键,过渡金属的存在可以将简单的反应前体转变成为结构复杂的分子,因而其应用范围非常广泛。最早关于过渡金属的研究是在Kharasch时代,在他之后的Kochi等人的研究陆续的向世人展示了Fe、Co、Ni等多种过渡金属作为催化剂在偶联反应中的作用。而在过渡金属之中,钯及其化合物是非常重要的有机合成催化剂,因此使用金属钯及其化合物是实现碳-碳键偶联的最为有效的途径。我们容易得到的都是氧化态的钯,在催化剂中钯主要以Pd(0)、Pd(II)和Pd(IV)三种氧化态存在,而且在催化过程中钯可以在这三种不同价态之间发生相互的转化。由于每一种氧化态的钯的化学性质并不相同,所以在钯在作为催化剂所参与的有机化学反应中也具有独特的多样性。钯催化剂相较于其它过渡金属催化剂有以下三个优点:第一,高效、低量、高选择性的特点;第二,反应条件温和;第三,可循环利用,环境污染少。2010年10月6日,瑞典皇家科学院宣布将2010年度诺贝尔化学奖授予美国和日本的3位科学家理查德·海克(Richard F.Heck)、根岸英一(Ei-ichi Negishi)和铃木章(Akira Suzuki),以表彰他们在“有机合成中钯催化交叉偶联反应”方面所做出的杰出贡献,可见钯催化的交叉偶联反应是一种可靠而又实用的工具,对有机合成具有长久和深远的影响力。
偶联反应中,钯试剂有时可以作为催化剂单一使用,有时必须要有助催化剂的帮助。最初Lunsford等人首次报道以MgO做催化剂,Li作为助催化剂下的甲烷氧化偶联反应,之后的很多偶联反应都加入或用本身的反应物来作为助催化剂,如:Suzuki-Miyaura反应在弱碱Ba(OH)2作为助催化剂的条件下有较高的产率、较快的反应速率和较好的选择性,Sonogashira反应要在CuI作为助催化剂的条件下才能很好的进行不同助催化剂的出现,另外Kumada反应是有机镁试剂即作为反应物又作为助催化剂、Negishi反应是有机锌试剂即作为反应物又作为助催化剂、Stille反应是有机锡试剂即作为反应物又作为助催化剂、Hiyama-Denmark反应是有机硅试剂即作为反应物又作为助催化剂,其它偶联反应也是如此。
目前,金属催化的碳-碳偶联反应因为催化效率高、选择性好、底物来源广泛以及反应条件温和等优点,使得该类反应成为有机合成的研究热点之一。并且,由于交叉偶联反应能促使碳-碳键形成,而且简单易操作且高效等原因,目前已经广泛应用于生物、医药、农药、有机材料和精细化工等学科领域。不过,虽然钯/助催化剂使得交叉偶联反应得到了很广泛的应用,但也存在原子经济性不好、选择性差、反应条件苛刻、反应时间长等问题。而且到目前为止该反应所用的有机金属弱亲核试剂全部集中在主族,没有过渡金属尤其是稀土金属作为弱亲核试剂的报道,因此开发一种新型的交叉偶联反应很有价值和意义。
发明内容
针对现有的交叉偶联反应存在原子经济性不好、选择性差、反应条件苛刻、反应时间长等问题,本发明的目的在于提供一种基于稀土金属化合物的交叉偶联反应及应用。所述交叉偶联反应简单易操作,产率高,反应速度快,选择性好,分离提纯简单。
本发明的目的由以下技术方案实现:
一种基于稀土金属化合物的交叉偶联反应,所述反应方程式如下:
反应物1反应物2
其中,反应物1中T=芳基、芳杂环基、烷基、烯基、炔基、烯丙基或环戊二烯基及它们衍生物中的任一种;X=H、F、Cl、Br、I、CN或OTf中的任一种;其中,OTf为三氟甲磺酸。
所述反应物1优选以下物质中的一种:
反应物2中Ln是稀土金属中的一种,即Ln为钪(Sc)、钇(Y)、镧(La)、铈(Ce)、镨(Pr)、钕(Nb)、钷(Pm)、钐(Sm)、铕(Eu)、钆(Gd)、铽(Tb)、镝(Dy)、钬(Ho)、铒(Er)、铥(Tm)、镱(Yb)和镥(Lu)中的一种;
反应物2中R1,R2和R3是与稀土金属相连的三个取代基团,且三个取代基团可以相同也可以不相同;
-R1、-R2、-R3分别独立为-C-型、-C=型、-C≡型、 -NH-型、-N=型、-O-型、-S-型、-PH-型、-P=型中的任一种;
R=氢、卤素、饱和脂肪烃、不饱和脂肪烃或芳香烃,X’=氮、氧、硫或磷;
所述反应物2优选以下物质中的一种:
催化剂为零价钯化合物、二价钯化合物或含钯的混合物,具体优选Pd/C(0)、Pd[P(t-Bu)3]2(0)、Pd(PPh3)4(0)、Pd(dba)2(0)、Pd2(dba)3(0)、Pd(acac)2(Ⅱ)、PdCl2(Ⅱ)、Pd(OAc)2(Ⅱ)、PdCl2(PhCN)2(Ⅱ)、PdBr2(PhCN)2(Ⅱ)、Pd(OCOCF3)2(Ⅱ)、PdCl2(PPh3)(Ⅱ)和PdCl2(NH3)2(Ⅱ)中的一种,括号中为Pd的化合价;
其中,t-Bu为叔丁基;Ph为苯基;dba为二亚苄基丙酮;acac为乙酰丙酮;OAc为醋酸根;以Pd/C催化剂的总质量为100%计,Pd的质量百分含量为5%或10%。
催化剂优选为Pd2(dba)3(0),Pd[P(t-Bu)3]2(0)和Pd(OAc)2(Ⅱ)中的一种,进一步优选Pd2(dba)3(0),结构式如下:
L为含有碳、氮、氧、硫和磷原子中一种以上的中性配体,如以下物质中的一种:
其中,iPr为异丙基,Ph为苯基,Bn为苄基,Me为甲基,Et为乙基,X”为氮原子、氧原子、硫原子或磷原子;
配体优选为2c结构。
溶剂为有机溶剂,如正己烷、N,N—二甲基甲酰胺(DMF)、四氢吠喃(THF)、l,4—二氧六环、甲苯、甲醇、乙醚、苯、二氯甲烷、1,2—二氯乙烷(DCE)、氯仿、乙腈和二甲基亚砜(DMSO)溶剂中的一种,优选为甲苯。
所述衍生物是指一种简单化合物中的氢原子或原子团被其他原子或原子团取代而衍生的较复杂的产物。
所述中性配体是指在配位化学中向中心原子或离子提供孤对电子的中性分子,并且形成配合物后不发生价态的变化。
所述的交叉偶联反应的步骤如下:
(1)在无水无氧环境下,分别称取催化剂和配体,同时加入到干燥的反应器中,并用溶剂溶解,搅拌均匀,得到混合物c;
(2)向混合物c中加入反应物1,继续搅拌3~10min,得到混合物d;然后,将反应物2溶于溶剂中,得到浓度为0.3~0.6mol/L的溶液e,将溶液e滴加到混合物d中,滴加时间不少于1h;滴加完毕后,继续反应1~3h;
(3)用柱层析的方法进行分离与提纯,得到目标产物;
其中,步骤(1)中催化剂为反应物1的2.5~10%mol,配体为反应物1的5~15%mol;催化剂和配体的摩尔比为1:1~1:5;
步骤(2)中反应物1与反应物2的摩尔比为5:2;
步骤(1)和(2)所用溶剂相同;
步骤(3)柱层析中洗脱剂为石油醚和乙酸乙酯的混合溶液,其中,石油醚和乙酸乙酯的摩尔比为1:0~1:0.1。
步骤(2)中反应在-30~120℃下进行。
本发明所述的基于稀土金属化合物的交叉偶联反应的应用,所述交叉偶联反应应用于生物、医药、农药、有机材料和精细化工学科领域。
有益效果
(1)本发明所述的交叉偶联反应,是以常见的溴化物(反应物1)为初始原料,一步反应即能得到碳-碳键的有机化合物,反应简单易操作;
(2)本发明所述的交叉偶联反应,得到的碳-碳键的有机化合物,产率高,反应速度快,选择性好,分离提纯简单;
(3)本发明所述的交叉偶联反应,原子经济性好,反应物1与反应物2的摩尔比为5:2,反应物2的用量显著低于其它交叉偶联反应,如:Kumada、Negishi、Stille、Sonogashira、Suzuki-Miyaura、Hiyama-Denmark等;
(4)本发明所述的交叉偶联反应,可应用于生物、医药、农药、有机材料和精细化工等学科领域,并可解决用其它催化体系产生的相关反应副产物多,难以纯化的问题。
附图说明
图1是实施例1中交叉偶联反应的产物1A的H谱图;
图2是实施例1中交叉偶联反应的产物1A的C谱图;
图3是实施例1中交叉偶联反应的产物1A的气相-质谱图;
图4是实施例2中交叉偶联反应的产物2A的H谱图;
图5是实施例2中交叉偶联反应的产物2A的C谱图;
图6是实施例3中交叉偶联反应的产物3A的H谱图;
图7是实施例3中交叉偶联反应的产物3A的C谱图;
图8是实施例4中交叉偶联反应的产物4A的H谱图;
图9是实施例4中交叉偶联反应的产物4A的C谱图;
图10是实施例5中交叉偶联反应的产物5A的H谱图;
图11是实施例5中交叉偶联反应的产物5A的C谱图;
图12是实施例6中交叉偶联反应的产物6A的H谱图;
图13是实施例6中交叉偶联反应的产物6A的C谱图;
图14是实施例7中交叉偶联反应的产物7A的H谱图;
图15是实施例7中交叉偶联反应的产物7A的C谱图;
图16是实施例8中交叉偶联反应的产物8A的H谱图;
图17是实施例8中交叉偶联反应的产物8A的C谱图;
图18是实施例9中交叉偶联反应的产物9A的H谱图;
图19是实施例9中交叉偶联反应的产物9A的C谱图;
图20是实施例10中交叉偶联反应的产物10A的H谱图;
图21是实施例10中交叉偶联反应的产物10A的C谱图;
图22是实施例11中交叉偶联反应的产物11A的H谱图;
图23是实施例11中交叉偶联反应的产物11A的C谱图;
图24是实施例12中交叉偶联反应的产物12A的H谱图;
图25是实施例12中交叉偶联反应的产物12A的C谱图;
图26是实施例13中交叉偶联反应的产物13A的H谱图;
图27是实施例13中交叉偶联反应的产物13A的C谱图;
图28是实施例14中交叉偶联反应的产物14A的H谱图;
图29是实施例14中交叉偶联反应的产物14A的C谱图。
图中,f1为化学位移。
具体实施方式
下面结合附图和具体实施例来详述本发明,但不限于此。
主要试剂
主要仪器与设备
以下实施例柱层析采用具砂板闪式层析柱。
所用三(三甲基硅甲基)钇制备如下:
在手套箱中,称取无水三氯化钇(2.50g)于舒郎克瓶中,并用四氢呋喃(35mL)溶解,100℃条件下回流10h。在手套箱中,称取三甲基硅甲基锂(4.53g),并用四氢呋喃(20mL)将其溶解。
用注射器将三甲基硅甲基锂的四氢呋喃溶液滴加到三氯化钇的四氢呋喃悬浮液中,滴加时间为1h。滴加完成后,35℃条件下,继续反应30min。待反应完成后,真空抽干溶剂,并用正己烷洗涤残渣5次,每次使用正己烷15mL。将洗涤后得到的正己烷溶液真空抽干,得到白色晶体产品三(三甲基硅甲基)钇。
三(三甲基硅甲基)钪的制备步骤与三(三甲基硅甲基)钇相同,不同之处为:将无水三氯化钇更换成无水三氯化钪,三甲基硅甲基锂的质量更换成3.51g。
以下实施例中“Xphos”表示配体2c,结构为:
实施例1
首先,在手套箱中,用天平分别称取催化剂Pd2(dba)321.06mg和配体Xphos42.80mg,同时加入到干燥的25ml茄瓶中,并用甲苯溶解,搅拌均匀。其中,催化剂为反应物1的2.5%mol,配体为反应物1的10%mol;催化剂和配体的摩尔比为1:4。
其次,在35℃条件下,往茄瓶中加入对溴苯甲醚(反应物1)168.36mg,继续搅拌3min。然后,用甲苯将三(三甲基硅甲基)钇(反应物2)293.95mg溶解,得到浓度为0.3mol/L的溶液,并用注射器将该溶液滴加到反应液中,滴加时间为1h。滴加完毕后,继续反应1h。其中,三(三甲基硅甲基)钇和对溴苯甲醚的摩尔比为2:5。
最后,用柱层析的方法进行分离与提纯,得到黄色液体的产物对(三甲基硅甲基)苯甲醚1A,质量为139.96mg,产率为80%,转化率为100%。其中柱层析所用洗脱剂为石油醚和乙酸乙酯的混合溶液,石油醚和乙酸乙酯的摩尔比为1:0。
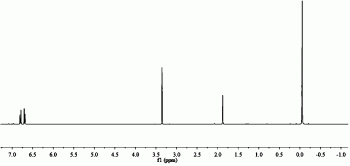
本实施例中,产物的分子结构经核磁共振仪测试H-NMR结果如图1所示,具体分析如下:
核磁氢谱:1H NMR(400MHz,C7D8)δ6.80(d,2H),6.69(d,2H),3.35(s,3H),1.88(s,2H),-0.05(s,9H)。
本实施例中,产物的分子结构经核磁共振仪测试C-NMR结果如图2所示,具体分析如下:
核磁碳谱:13C NMR(101MHz,C7D8)δ156.98,137.07,131.66,128.53,127.56,124.73,113.73,54.24,25.41,20.04,-2.28。
以上数据说明1A为对(三甲基硅甲基)苯甲醚。
1A的气相-质谱图见图3,通过气相-质谱分析可得1A的选择性为100%。
实施例2
首先,在手套箱中,用天平分别称取催化剂Pd2(dba)321.06mg和配体Xphos42.80mg,同时加入到干燥的25ml茄瓶中,并用甲苯溶解,搅拌均匀。其中,催化剂为反应物1的2.5%mol,配体为反应物1的10%mol;催化剂和配体的摩尔比为1:4。
其次,在35℃条件下,往茄瓶中加入4-溴苯甲腈(反应物1)167.20mg,继续搅拌10min。然后,用甲苯将三(三甲基硅甲基)钇(反应物2)293.95mg溶解,得到浓度为0.6mol/L的溶液,并用注射器将该溶液滴加到反应液中,滴加时间为1h。滴加完毕后,继续反应1h。其中,三(三甲基硅甲基)钇和4-溴苯甲腈的摩尔比为2:5。
最后,用柱层析的方法进行分离与提纯,得到淡黄色液体的产物对(三甲基硅甲基)苯甲腈2A,质量为132.18mg,产率为76%,转化率为100%。其中柱层析所用层析液为石油醚和乙酸乙酯的混合溶液,石油醚和乙酸乙酯的摩尔比为1:0.005。
本实施例中,产物的分子结构经核磁共振仪测试H-NMR结果如图4所示,具体分析如下:
核磁氢谱:1H NMR(400MHz,C7D8)δ6.97(d,J=8.2Hz,2H),6.49(d,J=8.2Hz,2H),1.68(s,2H),0.26(s,1H),-0.21(s,9H)。
本实施例中,产物的分子结构经核磁共振仪测试C-NMR结果如图5所示,具体分析如下:
核磁碳谱:13C NMR(101MHz,C7D8)δ137.09,131.57,128.38,127.85–127.09,125.32–124.13,27.46,20.02,-2.64(s)。
以上数据说明2A为对(三甲基硅甲基)苯甲腈。
通过气相-质谱分析2A的选择性为95%。
实施例3
首先,在手套箱中,用天平分别称取催化剂Pd2(dba)384.24mg和配体Xphos42.80mg,同时加入到干燥的25ml茄瓶中,并用甲苯溶解,搅拌均匀。其中,催化剂为反应物1的10%mol,配体为反应物1的10%mol;催化剂和配体的摩尔比为1:1。
其次,在-30℃条件下,往茄瓶中加入2-溴芴(反应物1)232.20mg,继续搅拌3min。然后,用甲苯将三(三甲基硅甲基)钇(反应物2)293.95mg溶解,得到浓度为0.5mol/L的溶液,并用注射器将该溶液滴加到反应液中,滴加时间为1h。滴加完毕后,继续反应1h,之后恢复到35℃。其中,三(三甲基硅甲基)钇和2-溴芴的摩尔比为2:5。
最后,用柱层析的方法进行分离与提纯,得到黄色固体的产物2-(三甲基硅甲基)芴3A,质量为186.52mg,产率为78%,转化率可达100%。其中柱层析所用洗脱剂为石油醚和乙酸乙酯的混合溶液,石油醚和乙酸乙酯的摩尔比为1:0。本实施例中,产物的分子结构经核磁共振仪测试H-NMR结果如图6所示,具体分析如下:
核磁氢谱:1H NMR(400MHz,C7D8)δ7.57(d,J=7.5,1H),7.51(d,J=7.8,1H),7.29–7.18(m,2H),7.15–7.08(m,1H),6.98(s,1H),6.91(d,J=7.8,1H),3.49(s,2H),2.02(s,2H),0.00(s,9H)。
本实施例中,产物的分子结构经核磁共振仪测试C-NMR结果如图7所示,具体分析如下:
核磁碳谱:13C NMR(101MHz,C7D8)δ143.91,143.26,142.57,139.23,138.57,137.47,128.98,127.46,126.94,126.21,125.13,119.69,36.91,27.22,-1.82。
以上数据说明3A为2-(三甲基硅甲基)芴。
通过气相-质谱分析3A的选择性为97%。
实施例4
首先,在手套箱中,用天平分别称取催化剂Pd2(dba)321.06mg和配体Xphos21.40mg,同时加入到干燥的25ml茄瓶中,并用甲苯溶解,搅拌均匀。其中,催化剂为反应物1的2.5%mol,配体为反应物1的5%mol;催化剂和配体的摩尔比为1:2。
其次,在35℃条件下,往茄瓶中加入4-溴苯丙酮(反应物1)201.90mg,继续搅拌3min。然后,用甲苯将三(三甲基硅甲基)钇(反应物2)293.95mg溶解,得到浓度为0.5mol/L的溶液,并用注射器将该溶液滴加到反应液中,滴加时间为1h。滴加完毕后,继续反应1h。其中,三(三甲基硅甲基)钇和4-溴苯丙酮的摩尔比为2:5。
最后,用柱层析的方法进行分离与提纯,得到无色液体的产物对(三甲基硅甲基)苯乙酮4A,质量为154.53mg,产率为74%,转化率可达100%。其中柱层析所用洗脱剂为石油醚和乙酸乙酯的混合溶液,石油醚和乙酸乙酯的摩尔比为1:0.01。本实施例中,产物的分子结构经核磁共振仪测试H-NMR结果如图8所示,具体分析如下:
核磁氢谱:1H NMR(400MHz,C7D8)δ7.27–7.20(m,2H),6.97–6.92(m,2H),0.97(d,J=14.3Hz,3H),,0.54(s,3H),-0.05(s,2H),-0.15(s,2H),-0.17(s,9H)。
本实施例中,产物的分子结构经核磁共振仪测试C-NMR结果如图9所示,具体分析如下:
核磁碳谱:13C NMR(101MHz,C7D8)δ146.71,137.09,130.77,128.72,128.38,128.28–127.77,127.77–127.04,125.06,124.74(s),124.50,119.95,76.51,39.60,33.24(s),32.86,26.17,20.06,7.94(s),7.74,-0.15,-2.34。
以上数据说明4A为对(三甲基硅甲基)苯乙酮。
通过气相-质谱分析4A的选择性为94%。
实施例5
首先,在手套箱中,用天平分别称取催化剂Pd2(dba)321.06mg和配体Xphos42.80mg,同时加入到干燥的25ml茄瓶中,并用甲苯溶解,搅拌均匀。其中,催化剂为反应物1的2.5%mol,配体为反应物1的10%mol;催化剂和配体的摩尔比为1:4。
其次,在35℃条件下,往茄瓶中加入4-溴代联苯(反应物1)214.01mg,继续搅拌3min。然后,用甲苯将三(三甲基硅甲基)钇(反应物2)293.95mg溶解,得到浓度为0.5mol/L的溶液,并用注射器将该溶液滴加到反应液中,滴加时间为1h。滴加完毕后,继续反应3h。其中,三(三甲基硅甲基)钇和4-溴代联苯的摩尔比为2:5。
最后,用柱层析的方法进行分离与提纯,得到无色液体的产物4-(三甲基硅甲基)联苯5A,质量为178.78mg,产率为81%,转化率可达100%。其中柱层析所用洗脱剂为石油醚和乙酸乙酯的混合溶液,石油醚和乙酸乙酯的摩尔比为1:0。本实施例中,产物的分子结构经核磁共振仪测试H-NMR结果如图10所示,具体分析如下:
核磁氢谱:1H NMR(400MHz,C7D8)δ7.47–7.41(m,2H),7.37(d,J=8.1Hz,2H),7.24–7.16(m,2H),7.10(s,1H),6.93(d,J=8.1Hz,2H),1.95(s,2H),-0.04(s,9H)。
本实施例中,产物的分子结构经核磁共振仪测试C-NMR结果如图11所示,具体分析如下:
核磁碳谱:13C NMR(101MHz,C7D8)δ141.31,139.27,137.10,128.51,127.83,127.52,127.35,127.18–126.49,125.00,124.75,124.51,29.90,26.54,20.08,-2.24。
以上数据说明5A为4-(三甲基硅甲基)联苯。
通过气相-质谱分析5A的选择性为100%。
实施例6
首先,在手套箱中,用天平分别称取催化剂Pd2(dba)321.06mg和配体Xphos42.80mg,同时加入到干燥的25ml茄瓶中,并用甲苯溶解,搅拌均匀。其中,催化剂为反应物1的2.5%mol,配体为反应物1的10%mol;催化剂和配体的摩尔比为1:4。
其次,在35℃条件下,往茄瓶中加入3,5-二氯-1-溴苯(反应物1)205.4mg,继续搅拌3min。然后,用甲苯将三(三甲基硅甲基)钇(反应物2)293.95mg溶解,得到浓度为0.5mol/L的溶液,并用注射器将该溶液滴加到反应液中,滴加时间为1h。滴加完毕后,继续反应1h。其中,三(三甲基硅甲基)钇和3,5-二氯-1-溴苯的摩尔比为2:5。
最后,用柱层析的方法进行分离与提纯,得到黄色液体的产物1-(三甲基硅甲基)-3,5-二氯苯6A,质量为152.68mg,产率为72%,转化率可达100%。其中柱层析所用洗脱剂为石油醚和乙酸乙酯的混合溶液,石油醚和乙酸乙酯的摩尔比为1:0.1。本实施例中,产物的分子结构经核磁共振仪测试H-NMR结果如图12所示,具体分析如下:
核磁氢谱:1H NMR(400MHz,C7D8)δ6.92(dd,J=3.8,1.8Hz,2H),6.65(d,J=1.8Hz 1H),1.60(s,2H),-0.23(s,9H)。
本实施例中,产物的分子结构经核磁共振仪测试C-NMR结果如图13所示,具体分析如下:
核磁碳谱:13C NMR(101MHz,C7D8)δ144.13,137.06,134.57,129.58,128.47,127.49,126.15,124.60,26.41,0.98,-2.67。
以上数据说明6A为1-(三甲基硅甲基)-3,5-二氯苯。
通过气相-质谱分析6A的选择性为95%。
实施例7
首先,在手套箱中,用天平分别称取催化剂Pd2(dba)321.06mg和配体Xphos42.80mg,同时加入到干燥的25ml茄瓶中,并用甲苯溶解,搅拌均匀。其中,催化剂为反应物1的2.5%mol,配体为反应物1的10%mol;催化剂和配体的摩尔比为1:4。
其次,在35℃条件下,往茄瓶中加入2-溴代萘(反应物1)188.0mg,继续搅拌3min。然后,用甲苯将三(三甲基硅甲基)钇(反应物2)293.95mg溶解,得到浓度为0.5mol/L的溶液,并用注射器将该溶液滴加到反应液中,滴加时间为1h。滴加完毕后,继续反应1h。其中,三(三甲基硅甲基)钇和2-溴代萘的摩尔比为2:5。
最后,用柱层析的方法进行分离与提纯,得到白色固体的产物2-(三甲基硅甲基)萘7A,质量为163.49mg,产率为84%,转化率可达100%。其中柱层析所用洗脱剂为石油醚和乙酸乙酯的混合溶液,石油醚和乙酸乙酯的摩尔比为1:0。本实施例中,产物的分子结构经核磁共振仪测试H-NMR结果如图14所示,具体分析如下:
核磁氢谱:1H NMR(400MHz,C7D8)δ7.59(d,J=8.8,1H),7.53(d,J=8.4,2H),7.31–7.15(m,2H),7.00(dt,J=12.2,6.1,2H),2.07(s,2H),-0.06(s,9H)。
本实施例中,产物的分子结构经核磁共振仪测试C-NMR结果如图15所示,具体分析如下:
核磁碳谱:13C NMR(101MHz,C7D8)δ138.15,137.46,134.57,131.78,128.64,127.96,127.36(s),126.05,124.78,27.35,-1.85。
以上数据说明7A为2-(三甲基硅甲基)萘。
通过气相-质谱分析7A的选择性为97%。
实施例8
首先,在手套箱中,用天平分别称取催化剂Pd2(dba)325.27mg和配体Xphos64.20mg,同时加入到干燥的25ml茄瓶中,并用甲苯溶解,搅拌均匀。其中,催化剂为反应物1的3.0%mol,配体为反应物1的15%mol;催化剂和配体的摩尔比为1:5。
其次,在35℃条件下,往茄瓶中加入4-溴苄醇(反应物1)171.8mg,继续搅拌3min。然后,用甲苯将三(三甲基硅甲基)钇(反应物2)293.95mg溶解,得到浓度为0.5mol/L的溶液,并用注射器将该溶液滴加到反应液中,滴加时间为1h。滴加完毕后,继续反应1h。其中,三(三甲基硅甲基)钇和4-溴苄醇的摩尔比为2:5。
最后,用柱层析的方法进行分离与提纯,得到无色液体的产物对(三甲基硅甲基)苄醇8A,质量为146.39mg,产率为82%,转化率可达100%。其中柱层析所用洗脱剂为石油醚和乙酸乙酯的混合溶液,石油醚和乙酸乙酯的摩尔比为1:0。本实施例中,产物的分子结构经核磁共振仪测试H-NMR结果如图16所示,具体分析如下:
核磁氢谱:1H NMR(400MHz,C7D8)δ7.09(s,2H),6.86(s,2H),4.35(s,2H),1.91(s,2H),-0.07(s,9H)。
本实施例中,产物的分子结构经核磁共振仪测试C-NMR结果如图17所示,具体分析如下:
核磁碳谱:13C NMR(101MHz,C7D8)δ138.94,137.32,137.09,128.72,128.48,128.34–127.61,127.58,127.15,124.98,124.74,124.50,64.42,26.95–26.29,20.07,-2.40。
以上数据说明8A为对(三甲基硅甲基)苄醇。
通过气相-质谱分析8A的选择性为90%。
实施例9
首先,在手套箱中,用天平分别称取催化剂Pd2(dba)321.06mg和配体Xphos42.80mg,同时加入到干燥的25ml茄瓶中,并用甲苯溶解,搅拌均匀。其中,催化剂为反应物1的2.5%mol,配体为反应物1的10%mol;催化剂和配体的摩尔比为1:4。
其次,在35℃条件下,往茄瓶中加入7-溴吲哚(反应物1)180.0mg,继续搅拌5min。然后,用甲苯将三(三甲基硅甲基)钇(反应物2)293.95mg溶解,得到浓度为0.5mol/L的溶液,并用注射器将该溶液滴加到反应液中,滴加时间为1h。滴加完毕后,继续反应1h。其中,三(三甲基硅甲基)钇和7-溴吲哚的摩尔比为2:5。
最后,用柱层析的方法进行分离与提纯,得到无色液体的产物7-(三甲基硅甲基)吲哚9A,质量为147.51mg,产率为79%,转化率可达100%。其中柱层析所用洗脱剂为石油醚和乙酸乙酯的混合溶液,石油醚和乙酸乙酯的摩尔比为1:0.005。本实施例中,产物的分子结构经核磁共振仪测试H-NMR结果如图18所示,具体分析如下:
核磁氢谱:1H NMR(400MHz,C7D8)δ7.56(dd,J=22.9,8.6Hz,3H),7.35–7.14(m,3H),7.01(d,J=8.4Hz,1H),2.06(s,2H),-0.06(s,9H)。
本实施例中,产物的分子结构经核磁共振仪测试C-NMR结果如图19所示,具体分析如下:
核磁碳谱:13C NMR(101MHz,C7D8)δ137.13,134.75,128.75,128.44,128.28,128.04,127.84,127.60,127.60,125.00,124.76,124.52,123.34,122.28,121.25,120.05,119.77,117.06,102.83,59.88,21.17,20.08,1.01,-1.94。
以上数据说明9A为7-(三甲基硅甲基)吲哚。
通过气相-质谱分析9A的选择性为87%。
实施例10
首先,在手套箱中,用天平分别称取催化剂Pd2(dba)321.06mg和配体Xphos42.80mg,同时加入到干燥的25ml茄瓶中,并用甲苯溶解,搅拌均匀。其中,催化剂为反应物1的2.5%mol,配体为反应物1的10%mol;催化剂和配体的摩尔比为1:4。
其次,在35℃条件下,往茄瓶中加入4-溴氟苯(反应物1)160.7mg,继续搅拌10min。然后,用甲苯将三(三甲基硅甲基)钇(反应物2)293.95mg溶解,得到浓度为0.5mol/L的溶液,并用注射器将该溶液滴加到反应液中,滴加时间为1h。滴加完毕后,继续反应2h。其中,三(三甲基硅甲基)钇和对溴氟苯的摩尔比为2:5。
最后,用柱层析的方法进行分离与提纯,得到无色液体的产物对(三甲基硅甲基)氟苯10A,质量为142.30mg,产率为85%,转化率可达100%。其中柱层析所用洗脱剂为石油醚和乙酸乙酯的混合溶液,石油醚和乙酸乙酯的摩尔比为1:0.04。本实施例中,产物的分子结构经核磁共振仪测试H-NMR结果如图20所示,具体分析如下:
核磁氢谱:1H NMR(400MHz,C7D8)δ6.73(ddd,J=9.3,5.8,2.5,2H),6.66–6.61(m,2H),1.78(s,2H),-0.12(s,9H)。
本实施例中,产物的分子结构经核磁共振仪测试C-NMR结果如图21所示,具体分析如下:
核磁碳谱:13C NMR(101MHz,C7D8)δ161.66,159.26,137.08,135.56,128.94,128.47,12756,124.73,114.76,25.49,20.08,-2.49。
以上数据说明10A为对(三甲基硅甲基)氟苯。
通过气相-质谱分析10A的选择性为90%。
实施例11
首先,在手套箱中,用天平分别称取催化剂Pd2(dba)321.06mg和配体Xphos42.80mg,同时加入到干燥的25ml茄瓶中,并用甲苯溶解,搅拌均匀。其中,催化剂为反应物1的2.5%mol,配体为反应物1的10%mol;催化剂和配体的摩尔比为1:4。
其次,在35℃条件下,往茄瓶中加入1-溴-4-叔丁基苯(反应物1)195.7mg,继续搅拌3min。然后,用甲苯将三(三甲基硅甲基)钇(反应物2)293.95mg溶解,得到浓度为0.5mol/L的溶液,并用注射器将该溶液滴加到反应液中,滴加时间为1h。滴加完毕后,继续反应1h。其中,三(三甲基硅甲基)钇和4-叔丁基溴苯的摩尔比为2:5。
最后,用柱层析的方法进行分离与提纯,得到无色液体的产物对(三甲基硅甲基)叔丁基苯11A,质量为151.82mg,产率为75%,转化率可达100%。其中柱层析所用洗脱剂为石油醚和乙酸乙酯的混合溶液,石油醚和乙酸乙酯的摩尔比为1:0。本实施例中,产物的分子结构经核磁共振仪测试H-NMR结果如图22所示,具体分析如下:
核磁氢谱:1H NMR(400MHz,C7D8)δ7.17(s,2H),6.88(s,2H),1.93(s,2H),1.22(s,9H),-0.05(s,9H)。
本实施例中,产物的分子结构经核磁共振仪测试C-NMR结果如图23所示,具体分析如下:
核磁碳谱:13C NMR(101MHz,C7D8)δ146.35,136.96,128.69,128.46,128.22,127.77,127.55(s),127.31,124.95,124.72,124.48,33.89,31.20,26.07,20.04,-2.23。
以上数据说明11A为对(三甲基硅甲基)叔丁基苯。
通过气相-质谱分析11A的选择性为93%。
实施例12
首先,在手套箱中,用天平分别称取催化剂Pd2(dba)321.06mg和配体Xphos42.80mg,同时加入到干燥的25ml茄瓶中,并用甲苯溶解,搅拌均匀。其中,催化剂为反应物1的2.5%mol,配体为反应物1的10%mol;催化剂和配体的摩尔比为1:4。
其次,在120℃的条件下,往茄瓶中加入1-溴-4-乙基苯(反应物1)168.0mg,继续搅拌3min。然后,用甲苯将三(三甲基硅甲基)钇(反应物2)293.95mg溶解,得到浓度为0.5mol/L的溶液,并用注射器将该溶液滴加到反应液中,滴加时间为1h。滴加完毕后,继续反应1h,之后恢复到35℃。其中,三(三甲基硅甲基)钇和对溴乙基苯的摩尔比为2:5。
最后,用柱层析的方法进行分离与提纯,得到黄色液体的产物对(三甲基硅甲基)乙基苯12A,质量为132.83mg,产率为83%,转化率可达100%。其中柱层析所用洗脱剂为石油醚和乙酸乙酯的混合溶液,石油醚和乙酸乙酯的摩尔比为1:0。本实施例中,产物的分子结构经核磁共振仪测试H-NMR结果如图24所示,具体分析如下:
核磁氢谱:1H NMR(400MHz,C7D8)δ6.96(d,J=7.9,2H),6.85(d,J=8.0,2H),2.46(q,J=7.6,2H),1.92(s,2H),1.11(t,J=7.6,3H),-0.06(s,9H)。
本实施例中,产物的分子结构经核磁共振仪测试C-NMR结果如图25所示,具体分析如下:
核磁碳谱:13C NMR(101MHz,C7D8)δ139.42,137.07,128.46,127.87,127.49,124.72,28.37,26.18,20.12,15.52,-2.27。
以上数据说明12A为对(三甲基硅甲基)乙基苯。
通过气相-质谱分析12A的选择性为100%。
实施例13
首先,在手套箱中,用天平分别称取催化剂Pd2(dba)321.06mg和配体Xphos42.80mg,同时加入到干燥的25ml茄瓶中,并用甲苯溶解,搅拌均匀。其中,催化剂为反应物1的2.5%mol,配体为反应物1的10%mol;催化剂和配体的摩尔比为1:4。
其次,在35℃条件下,往茄瓶中加入4-溴苯乙烯(反应物1)166.2mg,继续搅拌3min。然后,用甲苯将三(三甲基硅甲基)钇(反应物2)293.95mg溶解,得到浓度为0.5mol/L的溶液,并用注射器将该溶液滴加到反应液中,滴加时间为1h。滴加完毕后,继续反应1h。其中,三(三甲基硅甲基)钇和对溴乙基苯的摩尔比为2:5。
最后,用柱层析的方法进行分离与提纯,得到黄色液体的产物对(三甲基硅甲基)苯乙烯13A,质量为146.91mg,产率为85%,转化率可达100%。其中柱层析所用洗脱剂为石油醚和乙酸乙酯的混合溶液,石油醚和乙酸乙酯的摩尔比为1:0。本实施例中,产物的分子结构经核磁共振仪测试H-NMR结果如图26所示,具体分析如下:
核磁氢谱:1H NMR(400MHz,C7D8)δ7.15(d,J=8.1,2H),6.81(d,J=8.5,1H),6.56(d,J=10.9,1H),5.56(d,J=1.0,2H),5.03(d,1H),1.90(d,J=11.0,2H),-0.08(s,9H)。
本实施例中,产物的分子结构经核磁共振仪测试C-NMR结果如图27所示,具体分析如下:
核磁碳谱:13C NMR(101MHz,C7D8)δ139.93,137.03,133.68,128.56,127.14,126.18,124.72,111.46,26.61,-2.27。
以上数据说明13A为对(三甲基硅甲基)苯乙烯。
通过气相-质谱分析13A的选择性为87%。
实施例14
首先,在手套箱中,用天平分别称取催化剂Pd2(dba)321.06mg和配体Xphos42.80mg,同时加入到干燥的25ml茄瓶中,并用甲苯溶解,搅拌均匀。其中,催化剂为反应物1的2.5%mol,配体为反应物1的10%mol;催化剂和配体的摩尔比为1:4。
其次,在35℃条件下,往茄瓶中加入5-溴吲哚(反应物1)178.0mg,继续搅拌3min。然后,用甲苯将三(三甲基硅甲基)钇(反应物2)293.95mg溶解,得到浓度为0.5mol/L的溶液,并用注射器将该溶液滴加到反应液中,滴加时间为1h。滴加完毕后,继续反应1h。其中,三(三甲基硅甲基)钇和5-溴吲哚的摩尔比为2:5。
最后,用柱层析的方法进行分离与提纯,得到无色液体的产物5-(三甲基硅甲基)吲哚14A,质量为151.41mg,产率为82%,转化率可达100%。其中柱层析所用洗脱剂为石油醚和乙酸乙酯的混合溶液,石油醚和乙酸乙酯的摩尔比为1:0。本实施例中,产物的分子结构经核磁共振仪测试H-NMR结果如图28所示,具体分析如下:
核磁氢谱:1H NMR(400MHz,C7D8)δ7.30–7.23(m,1H),6.95(d,J=8.4Hz,1H),6.89–6.83(m,1H),6.57(t,J=2.8Hz,1H),6.40–6.33(m,1H),3.33(s,2H),0.26(s,1H),-0.00(s,9H)。
本实施例中,产物的分子结构经核磁共振仪测试C-NMR结果如图29所示,具体分析如下:
核磁碳谱:13C NMR(101MHz,C7D8)δ157.72,137.11,130.66,128.89–128.35,128.25,127.58,127.34,124.90,124.75,124.51,123.56,122.82,119.14,110.44,103.20,101.75,54.43,26.39,20.04,1.00,-2.10。
以上数据说明14A为5-(三甲基硅甲基)吲哚。
通过气相-质谱分析14A的选择性为89%。
实施例15
首先,在手套箱中,用天平分别称取催化剂Pd2(dba)321.06mg和配体Xphos42.80mg,同时加入到干燥的25ml茄瓶中,并用甲苯溶解,搅拌均匀。其中,催化剂为反应物1的2.5%mol,配体为反应物1的10%mol;催化剂和配体的摩尔比为1:4。
其次,在35℃条件下,往茄瓶中加入对溴苯甲醚(反应物1)168.36mg,继续搅拌3min。然后,用甲苯将三(三甲基硅甲基)钪(反应物2)267.84mg溶解,得到浓度为0.3mol/L的溶液,并用注射器将该溶液滴加到反应液中,滴加时间为1h。滴加完毕后,继续反应1h。其中,三(三甲基硅甲基)钪和对溴苯甲醚的摩尔比为2:5。
最后,用柱层析的方法进行分离与提纯,得到黄色液体的产物对(三甲基硅甲基)苯甲醚15A,质量为128.56mg,产率为81%,转化率为100%。其中柱层析所用洗脱剂为石油醚和乙酸乙酯的混合溶液,石油醚和乙酸乙酯的摩尔比为1:0。
本实施例中,产物的分子结构经核磁共振仪测试H-NMR结果如下:
核磁氢谱:1H NMR(400MHz,C7D8)δ6.80(d,2H),6.69(d,2H),3.35(s,3H),1.88(s,2H),-0.05(s,9H)。
本实施例中,产物的分子结构经核磁共振仪测试C-NMR结果如下:
核磁碳谱:13C NMR(101MHz,C7D8)δ156.98,137.07,131.66,128.53,127.56,124.73,113.73,54.24,25.41,20.04,-2.28。
以上数据说明15A为对(三甲基硅甲基)苯甲醚。
通过气相-质谱分析15A的选择性为100%。
本发明包括但不限于以上实施例,凡是在本发明精神的原则之下进行的任何等同替换或局部改进,都将视为在本发明的保护范围之内。
一种基于稀土金属化合物的交叉偶联反应及应用专利购买费用说明
![]()
Q:办理专利转让的流程及所需资料
A:专利权人变更需要办理著录项目变更手续,有代理机构的,变更手续应当由代理机构办理。
1:专利变更应当使用专利局统一制作的“著录项目变更申报书”提出。
2:按规定缴纳著录项目变更手续费。
3:同时提交相关证明文件原件。
4:专利权转移的,变更后的专利权人委托新专利代理机构的,应当提交变更后的全体专利申请人签字或者盖章的委托书。
Q:专利著录项目变更费用如何缴交
A:(1)直接到国家知识产权局受理大厅收费窗口缴纳,(2)通过代办处缴纳,(3)通过邮局或者银行汇款,更多缴纳方式
Q:专利转让变更,多久能出结果
A:著录项目变更请求书递交后,一般1-2个月左右就会收到通知,国家知识产权局会下达《转让手续合格通知书》。
动态评分
0.0