专利摘要
本发明包括大环前药化合物、包含它们的药物组合物。本发明还包括这些化合物在治疗多种疾病中的用途,所述疾病包括自身免疫疾病、炎性疾病、神经疾病或神经变性疾病、癌症、心血管疾病、变态反应、哮喘、与激素相关的疾病以及由神经纤维瘤病导致的肿瘤或症状。
说明书
技术领域发明领域
本发明涉及天然产物根赤壳菌素和pochonin的新的衍生物、类似物和中间体的前药,以及它们的合成。本发明进一步涉及这些化合物在包括自身免疫疾病、炎性疾病、神经疾病或神经变性疾病、癌症、心血管疾病、变态反应、哮喘、与激素相关的疾病,以及由神经纤维瘤病导致的肿瘤或症状在内的多种疾病的治疗中的用途。
技术背景发明背景
在20世纪50年代中期,已发现磷酸化可以通过催化磷酸化的蛋白激酶或通过涉及脱磷酸化步骤的蛋白磷酸酶可逆地改变酶的功能。这些反应在调节许多细胞过程(特别是信号转导途径)中起重要作用。在20世纪70年代后期,发现劳氏肉瘤病毒(v-Src)转化因子是蛋白激酶,而且也发现肿瘤促进佛波醇酯是蛋白激酶C的有效激活剂,这揭示了首次了解的疾病和异常蛋白质磷酸化之间的联系。从那以后,已经发现转导机理的缺陷引起许多致癌过程并且在糖尿病、炎性病症和心血管疾病中起作用(T.Hunter,Cell,100:113-127(2000);P.Cohen,Nat.Rev.Drug Discov.,1:309(2002))。因此,选择性的激酶和磷酸酶抑制剂已呈现为重要的药物靶,并且抑制激酶磷酸化活性是化学疗法的最有希望的策略之一。已经批准了三种激酶抑制剂药物:Gleevec(其抑制Ab1)以及Iressa和Tarceva(后两者均抑制EGFR)。
通过丝氨酸、苏氨酸或酪氨酸残基的激酶介导的磷酸化或磷酸酶介导的去磷酸化来调节蛋白质活性是大多数信号转导机理的核心。(T.Hunter,Cell,100:113(2000))。小分子抑制剂(例如6-二甲基氨基嘌呤和星状孢子素)有助于阐明这样的磷酸化机理的重要性,并且阐明激酶的生物功能。激酶以0.1-10μM的Km结合于ATP,并将γ-磷酸酯基团选择性地转移至给定蛋白质的特定残基。激酶的核心结构域由所述ATP结合位点和涉及磷酸转移反应的残基组成,在整个激酶组中高度保守。(G.Manning等人,Science,298:1912(2002))。这导致了以下推测:针对该高度保守的ATP结合袋的抑制剂不仅必须与以高浓度(mM)存在的ATP竞争,而且必将缺乏选择性。修饰的嘌呤(例如(R)-细胞周期蛋白依赖激酶)是强效并具有相当选择性的抑制剂的发现(L.Meijer和E.Raymond,Acc.Chem.Res.,36:417(2003))驳斥了那种观点并且激发了合成围绕嘌呤骨架的组合库(Y.T.Chang等人,Chem.Biol.,6:361(1999);S.Ding等人,J.Am.Chem.Soc.,124:1594(2002)),获得了重要的先导物(lead)(N.S.Gray等人,Sciences,281:533(1998);M.Knockaert等人,Chem.Biol.,7:411(2000))。
在这方面也已研究了大环二羟基苯甲酸内酯。这类化合物的原型是根赤壳菌素和相关的pochonin,它们是从麦角菌目丝孢菌普可尼亚属(clavicipitaceous hyphomycete Pochonia genus),例如厚垣孢普可尼亚菌(Pochonia chlamydosporia)变异链状菌株P0297的培养物中分离的次级代谢物的结构相关的组。参见例如V.Hellwig等人,J.Natural Prod.,66(6):829-837(2003)。制备根赤壳菌素的卤代醇和肟衍生物并评估它们的v-src酪氨酸激酶抑制、抗增殖和抗肿瘤的体外活性(T.Agatsuma等人,Bioorg.& Med.Chem.,10(11):3445-3454(2002)。
像激酶一样,热激蛋白质(HSP)与ATP相互作用,并且是控制疾病的重要靶,然而它们具有不同的机理效应。接触应激(例如热、缺氧或酸中毒)后,大多数组织中的细胞立即迅速增加HSP的产生速率。目前认为热HSP是分子伴侣,即它们防止不合适的缔合并且帮助正确地折叠统称为客户(client)和底物的其它分子蛋白质。还发现HSP与肿瘤和其它病理生理学状态有关。事实上,伴侣蛋白通过促进对细胞内部变化的耐受性进而促进肿瘤细胞在应激环境中的存活。HSP是普遍存在的,在物种中高度保守,并且通常按照分子量分为以下主要的家族:HSP100、HSP90、HSP70、HSP60和小HSP。这些家族具有结构和功能差异,但是它们在蛋白质折叠的不同阶段协同工作。HSP90受到了特别的关注,因为它与许多类型的信号分子(例如v-Src和Raf)有关,所述信号分子在恶性转化和转移发展中起重要作用。因此,期望HSP90抑制剂用于设计化学治疗,并且还用于阐述复杂信号网络中的相互作用。
热激蛋白质90(Hsp90)是普遍存在的伴侣蛋白,其维持许多“客户”蛋白的合适的构象(参见Kamal等人,Trends Mol.Med.2004,10,283-290;Dymock等人,Expert Opin.Ther.Patents 2004,14,837-847;Isaacs等人,Cancer Cell,2003,3,213;Maloney等人,Expert Opin.Biol.Ther.2002,2,3-24和Richter等人,J.Cell.Physiol.2001,188,281-290)并且参与折叠、活化和装配大范围的蛋白质,包括涉及信号转导、细胞周期控制和转录调节的关键蛋白质。研究人员已经报道了HSP90伴侣蛋白与重要的信号蛋白有关,所述重要的信号蛋白诸如类固醇激素受体和蛋白激酶,包括例如Raf-1、EGFR、v-Src家族激酶、Cdk4和ErbB-2(Buchner,TIBS,1999,24,136-141;Stepanova等人,Genes Dev.1996,10,1491-502;Dai等人,J.Biol.Chem.1996,271,22030-4)。研究进一步指示某些辅陪伴蛋白(co-chaperone)(例如Hsp70、p60/Hop/Stil、Hip、Bag1、HSP40/Hdj2/Hsj1、抑免蛋白、p23和p50)可促进HSP90的功能(参见例如Caplan,Trends in Cell Biol.,1999,9,262-268)。抑制Hsp90引起这些客户蛋白质采用异常构象,并且这些异常折叠的蛋白质由细胞经泛素化(ubiquitinylation)和蛋白酶体降解迅速消除。有趣的是,Hsp90客户蛋白的列表包括一系列众人皆知的致癌基因。它们中的四种是临床验证的癌症靶:HER-2/neu( (曲妥著单抗))、Bcr-Abl( (甲磺酸伊马替尼))、雌激素受体(他莫昔芬)和雄激素受体( (比卡鲁胺)),而其它基因在癌症的产生中起重要的作用。一些最敏感的Hsp90客户涉及生长信号(Raf-1、Akt、cdk4、Src、Bcr-Abl等)。相比之下,似乎很少有肿瘤抑制基因(如果有)是Hsp90的客户(客户蛋白的列表参见Pratt等人,Exp.Biol.Med.2003,228,111-133;Workman等人Cancer Lett.2004,206,149-157和Zhang等人,J.Mol.Med.2004,82,488-499),因此抑制Hsp90具有全面的抗增殖效应。此外,一些客户蛋白涉及肿瘤发生的其它基本过程,即凋亡逃逸(apoptosis evasion)(例如Apaf-1、RIP、Akt)、永生性(immortality)(例如hTert)、血管发生(例如VEGFR、Flt-3、FAK、HIF-1)和转移(c-Met)。
然而,药用的HSP抑制剂必须是选择性的,因为HSP还起到构造(constructive)作用。在非应激条件下,HSP90是存在于真核细胞中的最大量的蛋白质之一,代表总细胞蛋白质含量的1-2%,并且当细胞受到应激时仅增加约两倍。当与天然客户结合时,HSP90主管例如折叠新生多肽、跨膜转运蛋白质以及正常的蛋白质周转。此外,HSP90在翻译后调节信号分子中起关键作用,导致它们的活化。HSP90很少单独起作用,而是与伴侣蛋白HSP70、辅陪伴蛋白(HSP40、CDC37/p50、AHA1、p23)和辅助蛋白一起工作。
HSP90的许多客户蛋白在生长控制、细胞存活和发育过程中起关键作用,且已知那些客户包括受体酪氨酸激酶、丝氨酸/苏氨酸激酶、类固醇激素受体、转录因子和端粒末端转移酶。客户的致癌突变体也是客户自身,只是对HSP90的功能具有更高的需求,例如突变体v-SRC酪氨酸激酶需要从蛋白质的HSP90协同装配中得到更强的蛋白质折叠能力(Y.Xu等人,Proc.Natl.Acad.Sci.U.S.A.,96:109(1999);H.Oppermann等人,同上,78:1067(1981);L.Whitesell等人,同上,91:8324(1994)。同样,肿瘤抑制蛋白p53的突变导致发现于人类癌症中的最普遍的分子遗传缺陷,并且大多数p53突变表现出与HSP90的扩大的相互作用(可能由于异常构象),这防止了它们通常的泛素化和随后被蛋白酶体降解(M.V.Blagosklonny等人,同上,93:8379(1996))。然而,尽管有HSP90客户的普遍参与,但是它们大多数是前生长信号蛋白(pro-growth signaling protein),并且其伴侣蛋白功能在肿瘤发生期间被破坏,这导致恶性转化的产生以及所转化表型的维持。
除了抗癌和抗肿瘤形成(antitumorgenic)活性外,HSP90抑制剂还涉及许多其它应用,包括用作抗炎剂、抗传染病剂、治疗自身免疫的药剂、治疗缺血的药剂和用于促进神经再生的药剂(参见例如Rosen等人,WO02/09696;PCT/US01/23640;Degranco等人,WO 99/51223;PCT/US99/07242;Gold,美国专利第6,210,974B1号)。文献报道了纤维形成病症(包括但不限于硬皮病、多肌炎、全身性狼疮(systemic lupus)、类风湿关节炎、肝硬化、瘢痕形成、间质性肾炎和肺纤维化)是可治疗的(Strehlow,WO 02/02123;PCT/US01/20578)。
因此,安沙霉素类和其它HSP90抑制剂对治疗和/或预防许多类型的病症是很有前途的。然而,许多天然产物衍生的Hsp90抑制剂表现出药学上的缺陷;它们的相对不溶性使它们难以配制和给药,并且它们不容易合成,而且目前必须(至少部分地)通过发酵生产。此外,安沙霉素的剂量限制毒性为肝毒性。例如半合成抑制剂17-烯丙基氨基,17-去甲氧基-格尔德霉素(17-AAG),目前在II期临床试验中,其造价昂贵,配制困难(NCI临床方案由注射17-AAG的DMSO溶液组成),且目前只能肠胃外给药。尽管17-二甲基氨基乙基氨基类似物(17-DMAG)更加易溶,但它表现出所有17-AAG的副作用,并且在临床前毒性研究中出现胃肠出血(Glaze等人,Proc.Am.Assoc.Cancer.Res.2003,44,162-162和Eiseman等人,Cancer Chemother.Pharmacol.2005,55,21-32)。另一种天然产物Hsp90抑制剂——根赤壳菌素(RC)的水溶性差,并且在肿瘤异种移植中没有活性。根赤壳菌素的半合成肟衍生物提供较好的溶解性并且大大改善了鼠科模型中的药理学特征,但是仍然仅限于静脉内给药(Ikuina等人,J.Med.Chem.2003,46,2534-2541)。此外,根赤壳菌素和其肟含有被视为对稳定性和毒性负责的环氧乙烷环,这促进了环丙根赤壳菌素(cycloproparadicicol)的合成:Yang等人,J.Am.Chem.Soc.2004,126,7881和2003,125,9602-9603)。尽管安沙霉素类具有潜力,但因此需要替代的HSP90抑制剂。
已经寻找Hsp90的全合成口服活性抑制剂,以便提供更加灵活的给药方案选择,并且可能避免天然产物抑制剂的副反应。Chiosis等人描述了嘌呤类似物的设计和合成,所述嘌呤类似物模拟格尔德霉素和其它安沙霉素类结合HSP90的ATP结合袋并因此抑制HSP90的能力。参见国际专利申请PCT/US01/46303(WO 02/36075;Chemistry & Biology 8:289-299(2001))。Chiosis等人描述的具体化合物包括在3、4和5位取代的三甲氧苄基实体。使用凝胶结合测定,证明这些化合物结合HSP90比17-AAG低近20倍。
最近,已经报道了其它新的非天然产物Hsp90抑制剂(例如PU3和CCT018159;参见Chiosis等人,Bioorg.Med.Chem.Lett.2002,10,3555-3564;Vilenchik等人,Chem.Biol.2004,11,787-797;Chiosis等人,WO 0236075,2002;Drysdale等人,WO 03/055860A1,2003;Wright等人,Chem.Biol.2004,11,775-785;Dymock等人,Bioorg.Med.Chem.Lett.2004,14,325-328;Dymock等人,J.Med.Chem.2005,48,4212-4215。Structure of Hsp90 in complex with PU3 pdb code 1UY6,and with PU24FCl:pdb code 1UYF和Clevenger等人,Org.Lett.2004,6,4459-4462)。使用与ATP、格尔德霉素或根赤壳菌素复合的Hsp90的晶体结构设计这些抑制剂的结构。将8-苄基腺嘌呤(例如PU3)设计成采取与格尔德霉素相同的C型构象(Chiosis等人,Current Cancer Drug Targets,2003,3,371-376),其具有指向腺嘌呤结合位点(铰链区)的腺嘌呤环,以及模拟格尔德霉素醌环的H键接受性质的三甲氧基苯环。(PU3的苯环没有设计成具有与格尔德霉素的醌环完全相同的方向。而是将所述三甲氧基苯基团设计成指向相同的一般方向,并且与Lys 112(与格尔德霉素的醌环形成氢键的氨基酸)形成氢键。)最近获得的与PU3复合的Hsp90的晶体结构确认了嘌呤环占据一般由ADP/ATP占据的位置,但是苯环指向与预期方向相反的方向,以形成与Phe138的r-堆积相互作用(r-stacking interaction)。然而,PU3抑制Hsp90(HER-2降解测定,HER-2IC50=40μM)并提供用于进一步优化的有价值的起始点。基于PU3的结构活性研究导致更具活性的PU24FCl(HER-2IC50=1.7μM),其随后还与Hsp90共结晶。当PU24FCl在DMSO/EtOH/磷酸盐缓冲盐水1∶1∶1中配制并向荷有(bearing)MCF-7异种移植肿瘤的小鼠腹膜内给药时,它在100-300mg/kg时诱导HER-2和Raf-1的下调(一种与Hsp90抑制一致的药效学应答),并且在200mg/kg时它显著抑制了肿瘤生长。当口服给药时,需要非常高剂量(500-1000mg/kg)的PU24FCl才能观察到类似的药效学应答,并且未报道8-苄基腺嘌呤通过口服途径抑制肿瘤生长。在我们手中,证实了PU24FCl过于难溶以至于不能有效地配制和口服递送。目前为止,尽管大量的SAR研究改善了效力和药学性质,但是还未证明当口服给药时,Hsp90抑制剂在人类癌症的动物模型(异种移植物)中具有活性。
8-苄基腺嘌呤的发现导致8-硫烷基腺嘌呤的设计(Kasibhatla等人,WO3037860,2003和Llauger等人,J.Med.Chem.2005,48,2892-2905),以8-(2-碘-5-甲氧基-苯基硫烷基)-9-戊-4-炔基-9H-嘌呤-6-基胺为例,其在几种基于细胞的测定中显示出优异的效能,但是在水中溶解性差,并且在临床可接受的制剂中没有足够的口服生物利用度。
当抑制HSP90时,其客户被降解,即未折叠的蛋白质被泛素化,随后是蛋白酶体介导的水解。到目前为止,大多数报道的抑制剂结合于N端的结构域(见下文),但是报道了一些抑制剂与C端结构域相互作用;HSP90在两个部位都具有ATP结合位点。不完全清楚HSP90的C端功能,但是化合物在该结构域相互作用明显地损害了HSP90功能并且具有抗癌效应。已发现一些二羟基苯甲酸内酯抑制HSP90,因此天然产物根赤壳菌素和格尔德霉素(分别见P.Delmotte和J.Delmotte-Plaquee,Nature(London),171:344(1953);和C.DeBoer等人,J Antibiot(Tokyo),23:442(1970))被证明抑制表达活化的Src的细胞的转化表型(H.J.Kwon等人,Cancer Research,52:6926(1992);Y.Uehara等人,Virology,164:294(1988))。已报道相关的化合物(例如除莠霉素)具有类似的效应(S.Omura等人,J Antibiot(Tokyo),32:255(1979)。
在这方面研究的其它二羟基苯甲酸内酯(RAL)包括17-烯丙基氨基-17-去甲氧基格尔德霉素(17AAG)(D.B.Solit等人,Clin.Cancer Res.,8:986(2002);L.R.Kelland等人,J.Natl.Cancer Inst.,91:1940(1999));17DMAG(J.L.Eiseman等人,Cancer Chemother.Pharmacol.,55:21-32(2005));IPI-504(J.Ge等人,J.Med.Chem.,49:4606(2006);肟衍生物例如KF25706(S.Soga等人,Cancer Res.,59:2931(1999))和KF55823(S.Soga等人,Cancer Chemotherapy and Pharmacology,48:435(2001));以及Danishefsky等人的环丙根赤壳菌素(A.Rivkin等人,同上,44:2838(2005))。结构相关的变体包括具有根赤壳菌素的羧基间苯二酚和格尔德霉素的苯醌的嵌合抑制剂(chimeric inhibitor)(R.C.Clevenger和B.S.Blagg,Org.Lett.,6:4459(2004);G.Shen和B.S.Blagg,同上,7:2157(2004);G.Shen等人,J.Org.Chem.,71:7618(2006))。
基于根赤壳菌素的HSP90抑制剂
HSP90的嵌合抑制剂
已经研究嘌呤(例如PU3),以便设计适合HSP90的ATP结合位点的小分子(G.Chiosis等人,Chem Biol 8,289-299(2001);G.Chiosis等人,Bioorg.Med.Chem.,10:3555(2002);L.LLauger等人,J.Med.Chem.,48:2892(2005);H.He等人,同上,49:381(2006);M.A.Biamonte等人,同上,49:817(2006))。
基于嘌呤设计的HSP90抑制剂
最近还报道了吡唑(1-35)(M.G.Rowlands等人,Anal.Biochem.,327:176(2004);B.W.Dymock等人,J.Med.Chem.,48:4212(2005))和苯并噻唑硫-嘌呤(1-36)(L.Zhang等人,J.Med.Chem.,49:5352(2006)作为这些酶的小分子抑制剂。
其它类HSP90抑制剂
根赤壳菌素已具有特别意义。根赤壳菌素(一种14元大环内酯,并且也称作单孢菌素)是HSP90的ATP结合袋的有效的、高竞争性和高选择性的配体。HSP90是ATP酶而不是激酶,并且它的ATP结合袋具有Bergerat折叠(A.Bergerat等人,Nature,386:414(1997);R.Dutta和M.Inouye,Trends Biochem.Sci.,25:24(2000)),其与激酶的ATP结合袋不同(S.M.Roe等人,J.Med.Chem.,42:260(1999))。在最初发现后,出现对根赤壳菌素的药物应用的极大关注。(参见美国专利6,946,456和美国专利申请公布2003-0211469、2004-0102458、2005-0074457、2005-0261263、2005-0267087、2006-0073151、2006-0251574、2006-0269618、2007-0004674和2007-0010432)。
引人注目地,已知一些二羟基苯甲酸(resorcylic)大环内酯类(其为根赤壳菌素的相近类似物)抑制激酶,但不抑制HSP90。确实,发现LL-Z1640-2是TAK1激酶的有效和选择性的抑制剂,而根赤壳菌素和其它二羟基苯甲酸酯(resorcylides)对所述TAK1激酶没有活性(J.Ninomiya-Tsuji等人,J.Biol.Chem.,278:18485(2003);P.Rawlins等人,Int.J.Immunopharma.,21:799(1999);K.Takehana等人,Biochem.Biophys.Res.Comm.,257:19(1999);A.Zhao等人,J.Antibiotics,52:1086(1999))。密切相关的LL-783,227(其中一个烯烃被还原)是MEK激酶的有效抑制剂(A.Zhao等人,J.Antibiotics,52:1086(1999))。发现化合物F87-2509.04诱导含有AU富集元素(ARE)的mRNA的降解(T.Kastelic等人,Cytokine,8:751(1996)),并且发现寄端霉素抑制Ras介导的细胞信号(H.Tanaka等人,Jap.J.Cancer Res.,90:1139(1999))。我们已经证明aigialomycin D是CDK抑制剂(S.Barluenga等人,Angew.Chem.,Int.Ed.,46(24):3951(2006))。
根赤壳菌素的其它相近类似物确实抑制HSP90。Pochonin D是HSP90的有效抑制剂。(E.Moulin等人,J.Am.Chem.Soc.,127(19):6999(2005))。并且,已报道pochonin A是HSP90的90nM抑制剂。据发现Pochonin C是疱疹的解旋酶-引发酶的抑制剂,所述解旋酶-引发酶是ATP酶而不是激酶(V.Hellwig等人,J.Nat.Prod.,66:829(2003))。虽然根赤壳菌素和pochonin C在结构上非常相似,但它们在溶液中具有非常不同的构象,并且具有不同的生物活性(S.Barluenga等人,Chem.Eur.J.,11:4935(2005)。因此,看来所述大环的“松弛(floppiness)”可能在二羟基苯甲酸大环内酯间的抑制差异中起到重要的作用,并且在任何情况下使得那些效应难以通过理论方法进行预测。
已知一些二羟基苯甲酸大环内酯是激酶或磷酸酶的抑制剂(美国专利5,674,892、5,728,726、5,731,343和5,795,910),或抑制其它的酶(美国专利5,710,174,抑制纤维蛋白交联的FXIIIa催化)。二羟基苯甲酸大环内酯还用于其它医学适应症(美国专利3,453,367、3,965,275、4,035,504、4,670,249、4,778,821、4,902,711和6,635,671)。
根赤壳菌素和pochonin是天然产物;用于合成它们的一些类似物的中间体可通过发酵获得,然而仅仅依靠那些天然产物或它们的发酵衍生物严重限制了化合物的范围。因此,已经合成了许多新的二羟基苯甲酸大环内酯。这些中的许多是玉米赤霉烷和相关化合物,其中所述大环除了苯环的几个碳之间外,不含有碳-碳双键。(美国专利序列号3,373,038、3,586,701、3,621,036、3,631,179、3,687,982、3,704,249、3,751,431、3,764,614、3,810,918、3,836,544、3,852,307、3,860,616、3,901,921、3,901,922、3,903,115、3,957,825、4,042,602、4,751,239、4,849,447;和2005-0256183)。还报道了具有以下特征的二羟基苯甲酸大环内酯的合成:苯环外的环上的碳之间存在一个双键(美国专利序列号3,196,019;3,551,454;3,758,511;3,887,583;3,925,423;3,954,805;和4,088,658)。那些二羟基苯甲酸大环内酯中的大部分是14元大环,但是还报道了12元大环类似物的合成(美国专利序列号5,710,174;6,617,348;和2004-0063778,以及PCT公布WO 02/48135)。
还报道了根赤壳菌素相关化合物的合成,所述化合物在大环上具有两个非芳族双键和卤化物或1,2-桥氧基(即环氧化物)。(美国专利序列号4,228,079;5,597,846;5,650,430;5,977,165;7,115,651以及日本专利文件号JP 6-279279A、JP 6-298764A、JP 9-202781A、JP 10-265381A2和JP2000-236984)。根赤壳菌素相关化合物的肟的合成公开于美国专利序列号5,977,165;6,239,168;6,316,491;6,635,662;2001-0027208;2004-0053990;日本专利文件号JP 2003-113183A2;和PCT公布WO 99/55689中。根赤壳菌素的环丙类似物的合成公开于美国专利7,115,651和PCT公布WO05/061481中。一些其它二羟基苯甲酸大环内酯类似物的合成公开于美国专利公布2006-0247448和PCT公布WO 02/48135中。还合成了根赤壳菌素以及Pochonin A和C(S.Barluenga等人,Angew.Chemie,43(26):3467-3470(2004);S.Barluenga等人,Chemistry-A European Journal,11(17):4935-4952(2005年8月19日);E.Moulin等人,Organic Letters,7(25):5637-5639(2005年12月8日)。
尽管有上述进展,但化学生物学家仍然受到敲除特定激酶活性的有限能力的困扰,其中敲除特定激酶活性是为了揭示(deconvolute)特定激酶在复杂信号网络中的作用。可渗入细胞的小分子有望解决该问题。而且越来越明显的是:激酶的生物功能通常受它们的构象调节,所述构象转而由它们的磷酸化水平并且由分子内和分子间的缔合指示。小分子抑制剂还具有辨别给定激酶的不同构象的潜力,因此小分子提供了详细分析那些构象的各自功能的方法。不幸的是,已知激酶抑制剂的资料(portfolio)还不能支持在分析激酶组(kinome)的不同成员的作用中所要做的全部工作。这不仅是学术研究,因为直到了解激酶的机理和它们的选择性为止,药物设计的合理性会继续受到困扰。
因此对不仅具有改善的效能和选择性,而且具有改善的溶解性和生物利用度的激酶抑制剂和HSP90抑制剂有持续需求。
发明内容发明概述
本发明提供具有结构式I、II、III、IV和V的化合物,或其药学可接受的盐、溶剂合物和/或酯;包含所述化合物或其药学可接受的盐、溶剂合物和/或酯的药物组合物;以及所述化合物或其药学可接受的盐、溶剂合物和/或酯在治疗激酶介导或HSP90介导的病症中的用途。
在一实施方案中,本发明提供式I的化合物,或其药学可接受的盐、溶剂合物和/或酯:
其中:
R1、R2、R3和R4各自独立地为氢、卤素、硝基、氰基、烷基、烯基、炔基、芳基烷基、芳基、杂烷基、烷基杂芳基、杂环基、杂芳基、OR、NR2、SR、S(O)R、S(O)2R、-SO2N(R)2、-N(R)SO2R、-N(CO)R、-N(CO)NR2、-N(CO)OR、-O(CO)R、-(CO)R、-(CO)OR、-(CO)NR2、-O(CO)OR、-O(CO)NR2,或选自以下的结构式:
条件是R1、R2、R3和R4中的至少一个具有选自(Ia)、(Ib)、(Ic)、(Id)、(Ie)和(If)的结构式;
L1和L2各自独立地为共价键、-O-或-NR3a-;
p是0、1或2;
R1a和R2a各自独立地为氢、烷基、杂烷基、杂芳基、杂环基、烯基、炔基、芳基烷基、杂芳基烷基、杂环基烷基、-亚烷基-C(O)-O-R4a或-亚烷基-O-C(O)-O-R4a;并且
R3a和R4a各自独立地为氢、烷基、杂烷基、环烷基、杂环基、芳基、杂芳基、烯基、炔基、芳基烷基、杂环基烷基或杂芳基烷基;
L3和L4各自独立地为氢、卤素、硝基、氰基、烷基、烯基、炔基、芳基烷基、芳基、杂烷基、杂环基、杂芳基、杂环基烷基、杂芳基烷基、OR、NR2或SR;
R5a、R6a和R7a各自独立地为氢、烷基、烯基、炔基、烷基芳基、芳基烷基、芳基、杂烷基、烷基杂芳基、杂环基或杂芳基;
R5是氢、卤素、硝基、氰基、烷基、烯基、炔基、芳基烷基、芳基、杂烷基、烷基杂芳基、杂环基、杂芳基、OR、NR2、SR、S(O)R、S(O)2R、-SO2N(R)2、-N(R)SO2R、-N(CO)R、-N(CO)NR2、-N(CO)OR、-O(CO)R、-(CO)R、-(CO)OR、-(CO)NR2、-O(CO)OR或-O(CO)NR2;
Z具有选自(Ia)、(Ib)、(Ic)、(Id)和(Ie)的结构式;
A1与A2一起为-CH2-CH2-、-CH=CH-、-CH(OH)-CH(OH)-、-CH(OH)-CH(卤素)-、-CH(卤素)-CH(OH)-、1,2-环丙二基(1,2-cyclopropadiyl)或1,2-环氧乙烷;
B1与B2一起为-CH2-CH2-,或B1和B2一起表示共价键;
X1是氢、卤素、OR、NR2、NH-OR、SR、S(O)R、S(O)2R、-N-O-(CH2)n-CO2-R;或者X1与X2或X3一起表示共价键;
X2和X3均为氢,或X2和X3中的一个是氢且另一个与X1一起表示共价键;
X4与X5一起为=O、=S、=N-OR、=N-O-(CH2)nCOOR、=N-O-(CH2)nCONR2、=N-NR2、=N-N-SOR或=N-N-SO2R;或者X4和X5中的一个是氢,且另外一个是OH、OR、O(CO)R、O(CO)OR、O(CO)NR2、-(CH2)n-O(CO)OR、-(CH2)n-O(CO)NR2;或者X4和X5中的一个与X6一起表示共价键,且X4和X5中的另外一个是OH、OR、O(CO)R、O(CO)OR或O(CO)NR2;
X6是氢,或者X6与X4和X5中的一个一起表示共价键;并且
每一个R独立地为氢、烷基、酰基、芳基、烷芳基、芳基烷基、杂烷基、杂芳基、杂环基、保护基;或者当两个R基团与同一个氮键合时,所述两个R基团与所述氮一起形成5-8元杂环或杂芳基环;并且
n是1、2或3。
在一实施方案中,本发明提供式II的化合物,或其药学可接受的盐、溶剂合物和/或酯:
其中,R7是=O、=S、=N-OR、=N-O-(CH2)nCOOR、=N-O-(CH2)nCONR2、=N-NR2、=N-N-SOR或=N-N-SO2R。
在一实施方案中,本发明提供式III的化合物,或其药学可接受的盐、溶剂合物和/或酯:
其中R是氢、烷基、芳基烷基、酰基或保护基。
在一实施方案中,本发明提供式IV的化合物,或其药学可接受的盐、溶剂合物和/或酯:
其中R6是氢、OR或NR2.
在一实施方案中,本发明提供式V的化合物,或其药学可接受的盐、溶剂合物和/或酯:
其中R6是(CH2)nC(O)OR或-(CH2)nC(O)NR2;并且n是1、2或3。
在另一实施方案中,本发明提供药物组合物,其包含式I、II、III、IV或V的化合物或其药学可接受的盐、溶剂合物和/或酯,以及药学可接受的载体。
在一实施方案中,本发明提供治疗、预防或改善患有II型神经纤维瘤病(NF2)或与NF2功能丧失相关的病状、或者患有I型神经纤维瘤病(NF1)或与NF1功能丧失相关的病状的个体中的由神经纤维瘤病导致的肿瘤或症状的方法,其包括向所述个体给药治疗有效剂量的至少一种式I、II、III、IV或V的化合物,或其药学可接受的互变异构体、盐、溶剂合物、酯和/或前药。
在一实施方案中,本发明提供式I的化合物,或其药学可接受的互变异构体、盐、溶剂合物、酯和/或前药在制备药物中的用途,所述药物用于治疗、预防或改善患有II型神经纤维瘤病(NF2)或与NF2功能丧失相关的病状、或者患有I型神经纤维瘤病(NF1)或与NF1功能丧失相关的病状的个体中的由神经纤维瘤病导致的肿瘤或症状。
在一实施方案中,本发明提供治疗、预防或改善患者的神经变性疾病的方法,其包括向所述患者给药治疗有效剂量的至少一种式I、II、III、IV或V的化合物,或其药学可接受的互变异构体、盐、溶剂合物、酯和/或前药。
在一实施方案中,本发明提供式I、II、III、IV或V的化合物或其药学可接受的互变异构体、盐、溶剂合物、酯和/或前药在制备用于治疗、预防或改善神经变性疾病的药物中的用途。
在另一实施方案中,本发明提供抑制或减少缺乏NF2的肿瘤细胞或缺乏NF1的肿瘤细胞的生长或数量的方法,其包括使所述缺乏NF2的肿瘤细胞或缺乏NF1的肿瘤细胞与至少一种式I、II、III、IV或V的化合物,或其药学可接受的互变异构体、盐、溶剂合物、酯和/或前药相接触。
在另一实施方案中,本发明提供包含与药学可接受的载体组合的有效HSP 90抑制量的式I、II、III、IV或V的化合物的药物组合物。在一些实施方案中,所述载体适于口服、肠胃外、吸入、局部或真皮内给药。
在其它实施方案中,所述包含式I、II、III、IV或V的化合物的药物组合物包含平均粒度小于约2微米的颗粒。在其它实施方案中,将所述组合物掺入到可生物降解或不能生物降解的聚合物中。
在一实施方案中,所述组合物包含选自抗氧化剂、缓冲剂、抑菌剂、液体载体、溶质、助悬剂、增稠剂、矫味剂、明胶、甘油、粘合剂、润滑剂、惰性稀释剂、防腐剂、表面活性剂、分散剂、可生物降解的聚合物,或它们的任意组合的添加剂。
在另一实施方案中,本发明提供治疗患有疾病的患者的方法,其包括向所述患有疾病的患者给药有效量的式I、II、III、IV或V的化合物,其中所述疾病是自身免疫疾病、炎性疾病、神经疾病或神经变性疾病、癌症、心血管疾病、变态反应、哮喘或与激素相关的疾病。
在一实施方案中,本发明提供治疗患有癌症的患者的方法,其包括向所述患有癌症的患者给药有效癌症治疗量的式I、II、III、IV或V的化合物,其中所述癌症可以是实体瘤、血源性肿瘤(blood borne tumor)、乳腺癌、卵巢癌、宫颈癌、前列腺癌、睾丸癌、尿道癌、食道癌、喉癌、胶质母细胞瘤、胃癌、皮肤癌、角化棘皮瘤、肺癌、表皮样癌、大细胞癌、小细胞癌、肺腺癌、骨癌、结肠癌、腺瘤、胰腺癌、腺癌、甲状腺癌、滤泡癌、未分化癌、乳头状癌、精原细胞瘤、黑素瘤、肉瘤、膀胱癌、肝癌和胆道癌、肾癌、髓性病症(myeloid disorder)、淋巴病症、霍奇金病、毛细胞(hairycells)、口腔(buccal cavity)癌、咽癌(pharynx cancer)、唇癌、舌癌、口(mouth)癌、咽癌(cancer of the pharynx)、小肠癌、结肠-直肠癌、大肠癌、直肠癌、脑癌和中枢神经系统癌症,或白血病。
在另一实施方案中,本发明提供治疗患有与不期望的新生血管形成相关的疾病的患者的方法,其包括向所述患有不期望的新生血管形成的患者给药有效量的式I、II、III、IV或V的化合物。
与不期望的新生血管形成相关的疾病包括眼新生血管性疾病(ocular neovascular disease)、糖尿病性视网膜病变、早产儿视网膜病、角膜移植片排斥、新生血管性青光眼和晶体后纤维增生症、流行性角膜结膜炎、维生素A缺乏病、接触镜超戴症(contact lens overwear)、异位性角膜炎、上角膜缘角膜炎(superior limbic keratitis)、翼状胬肉干燥性角膜炎、干燥综合征( syndrome)、红斑痤疮、小水疱病(phylectenulosis)、梅毒、分枝杆菌(Mycobacteria)感染、脂质变性、化学烧伤、细菌性溃疡、真菌性溃疡、单纯疱疹(Herpes simplex)感染、带状疱疹(Herpes zoster)感染、原虫感染、卡波西肉瘤、莫伦溃疡、角膜Terrien边缘性变性、边缘性角质层分离(marginal keratolysis)、创伤、类风湿性关节炎、全身性狼疮、多动脉炎、韦格内结节病(Wegener′s sarcoidosis)、巩膜炎、斯-琼二氏病(Steven-Johnson disease)、类天疱疮、放射状角膜切开术或角膜移植排斥、镰状细胞性贫血、结节病、弹性假黄色瘤、佩吉特病、静脉阻塞、动脉阻塞、颈动脉阻塞性疾病(carotid obstructive disease)、慢性葡萄膜炎/玻璃体炎、Lyme’s病、全身性红斑狼疮、伊尔斯病、白塞病、引起视网膜炎或脉络膜炎的感染、眼假组织胞浆菌病、贝斯特病、近视、视窝、Stargart病、睫状体扁平部炎、慢性视网膜脱离、高粘滞综合征、弓形体病或激光治疗后并发症(post-laser complications)。
在另一实施方案中,本发明提供治疗患有炎性疾病的患者的方法,其包括向所述患有炎性疾病的患者给药有效量的式I、II、III、IV或V的化合物。
所述炎性疾病可以是内皮细胞的过度或异常刺激、动脉粥样硬化、血管功能障碍、伤口愈合异常、炎性和免疫病症、白塞病、痛风或痛风性关节炎、伴随异常血管发生的类风湿性关节炎、皮肤疾病、银屑病、糖尿病性视网膜病变、早产儿视网膜病、晶体后纤维增生症、黄斑变性、角膜移植片排斥、新生血管性青光眼或Osler Weber综合征。
附图说明附图简述
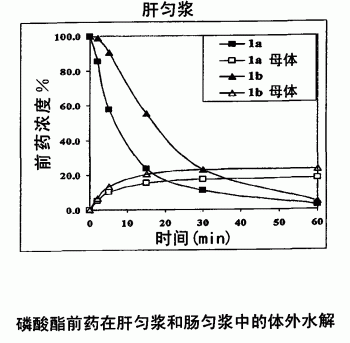
图1A和1B显示磷酸酯前药1a和1b在肝匀浆和肠匀浆中体外水解为它们的母体化合物。
图2A和2B显示磷酸酯前药1a和1b在血浆和人工胃液中体外水解为它们的母体化合物。
具体实施方式发明详述
本发明提供用作激酶抑制剂和HSP90抑制剂的基于二羟基苯甲酸内酯的新化合物。还提供包含所述化合物的组合物和制备所述化合物的方法。本发明提供所述化合物在抑制激酶和HSP-90中的用途,以及治疗激酶介导或HSP90介导的疾病的方法,所述方法包括向患有激酶介导或HSP90介导的疾病的患者给药有效激酶抑制量或有效HSP90抑制量的式I、II、III、IV或V的化合物。
化合物
在一实施方案中,本发明提供式I的化合物,或其药学可接受的盐、溶剂合物和/或酯:
其中:
R1、R2、R3和R4各自独立地为氢、卤素、硝基、氰基、烷基、烯基、炔基、芳基烷基、芳基、杂烷基、烷基杂芳基、杂环基、杂芳基、OR、NR2、SR、S(O)R、S(O)2R、-SO2N(R)2、-N(R)SO2R、-N(CO)R、-N(CO)NR2、-N(CO)OR、-O(CO)R、-(CO)R、-(CO)OR、-(CO)NR2、-O(CO)OR、-O(CO)NR2,或选自以下的结构式:
条件是R1、R2、R3和R4中的至少一个具有选自(Ia)、(Ib)、(Ic)、(Id)、(Ie)和(If)的结构式;
L1和L2各自独立地为共价键、-O-或-NR3a-;
p是0、1或2;
R1a和R2a各自独立地为氢、烷基、杂烷基、杂芳基、杂环基、烯基、炔基、芳基烷基、杂芳基烷基、杂环基烷基、-亚烷基-C(O)-O-R4a或-亚烷基-O-C(O)-O-R4a;并且
R3a和R4a各自独立地为氢、烷基、杂烷基、环烷基、杂环基、芳基、杂芳基、烯基、炔基、芳基烷基、杂环基烷基或杂芳基烷基;
L3和L4各自独立地为氢、卤素、硝基、氰基、烷基、烯基、炔基、芳基烷基、芳基、杂烷基、杂环基、杂芳基、杂环基烷基、杂芳基烷基、OR、NR2或SR;
R5a、R6a和R7a各自独立地为氢、烷基、烯基、炔基、烷基芳基、芳基烷基、芳基、杂烷基、烷基杂芳基、杂环基或杂芳基;
R5是氢、卤素、硝基、氰基、烷基、烯基、炔基、芳基烷基、芳基、杂烷基、烷基杂芳基、杂环基、杂芳基、OR、NR2、SR、S(O)R、S(O)2R、-SO2N(R)2、-N(R)SO2R、-N(CO)R、-N(CO)NR2、-N(CO)OR、-O(CO)R、-(CO)R、-(CO)OR、-(CO)NR2、-O(CO)OR或-O(CO)NR2;
Z具有选自(Ia)、(Ib)、(Ic)、(Id)和(Ie)的结构式;
A1与A2一起为-CH2-CH2-、-CH=CH-、-CH(OH)-CH(OH)-、-CH(OH)-CH(卤素)-、-CH(卤素)-CH(OH)-、1,2-环丙二基或1,2-环氧乙烷;
B1与B2一起为-CH2-CH2-,或B1和B2一起表示共价键;
X1是氢、卤素、OR、NR2、NH-OR、SR、S(O)R、S(O)2R、-N-O-(CH2)n-CO2-R;或者X1与X2或X3一起表示共价键;
X2和X3均为氢,或X2和X3中的一个是氢且另一个与X1一起表示共价键;
X4与X5一起为=O、=S、=N-OR、=N-O-(CH2)nCOOR、=N-O-(CH2)nCONR2、=N-NR2、=N-N-SOR或=N-N-SO2R;或者X4和X5中的一个是氢,且另外一个是OH、OR、O(CO)R、O(CO)OR、O(CO)NR2、-(CH2)n-O(CO)OR、-(CH2)n-O(CO)NR2;或者X4和X5中的一个与X6一起表示共价键,且X4和X5中的另外一个是OH、OR、O(CO)R、O(CO)OR或O(CO)NR2;
X6是氢,或者X6与X4和X5中的一个一起表示共价键;并且
每一个R独立地为氢、烷基、酰基、芳基、烷芳基、芳基烷基、杂烷基、杂芳基、杂环基、保护基;或者当两个R基团与同一个氮键合时,所述两个R基团与所述氮一起形成5-8元杂环或杂芳基环;并且
n是1、2或3。
在另一实施方案中,本发明提供式II的化合物:
其中,R7是=O、=S、=N-OR、=N-O-(CH2)nCOOR、=N-O-(CH2)nCONR2、=N-NR2、=N-N-SOR或=N-N-SO2R。
在式II化合物的一实施方案中,R1是H、卤素或杂环基。
在式II化合物的一实施方案中,R5是氢、烷基、芳基、杂芳基或芳基烷基。
在式II化合物的一实施方案中,A1与A2一起为-CH=CH-。
在式II化合物的一实施方案中,A1与A2一起为-CH(OH)-CH(OH)-、-CH(OH)-CH(卤素)-或-CH(卤素)-CH(OH)-。
在式II化合物的一实施方案中,A1与A2一起为1,2-环氧乙烷。
在式II化合物的一实施方案中,R1是H、Cl或杂环基;R5是氢、烷基、芳基或芳基烷基;A1与A2一起为-CH=CH-或-C(OH)-C(OH)-;X1是氢、卤素或NH-OR;并且R7是=O、=S、=N-OR、=N-O-(CH2)nCOOR、=N-O-(CH2)nCONR2、=N-NR2、=N-N-SOR、=N-N-SO2R。优选地,R7是=O。还优选R7为=N-OR、=N-O-(CH2)nCOOR或=N-O-(CH2)nCONR2。
在式II化合物的一实施方案中,R1是H、Cl或杂环基;R5是氢、烷基、芳基或芳基烷基;A1与A2一起为1,2-环氧乙烷;X1是氢、卤素或NH-OR;并且R7是=O、=S、=N-OR、=N-O-(CH2)nCOOR、=N-O-(CH2)nCONR2、=N-NR2、=N-N-SOR、=N-N-SO2R。
在式II化合物的一实施方案中,R1是H、Cl或杂环基;R5是氢、烷基、低级烷基、芳基或芳基烷基;A1与A2一起为-CH=CH-或-C(OH)-C(OH)-;X1与X2一起表示键;并且R7是=O、=S、=N-OR、=N-O-(CH2)nCOOR、=N-O-(CH2)nCONR2、=N-NR2、=N-N-SOR、=N-N-SO2R。优选地,R1是H或Cl;R5是氢、甲基、丙基、异丙基或苯基;并且R7是=N-OR、=N-O-(CH2)nCOOR或=N-O-(CH2)nCONR2。还优选R1是Cl且R5是氢。还优选n为1。还优选R5是氢且R7是=N-O-(CH2)nCOOR或=N-O-(CH2)nCONR2。还优选R5是氢且R7是=N-OR。
在式II化合物的一实施方案中,R1是H、Cl或杂环基;R5是氢、烷基、低级烷基、芳基或芳基烷基;A1与A2一起为1,2-环氧乙烷;X1与X2一起表示键;并且R7是=O、=S、=N-OR、=N-O-(CH2)nCOOR、=N-O-(CH2)nCONR2、=N-NR2、=N-N-SOR、=N-N-SO2R。优选地,R7是=O。还优选R7是=N-OR、=N-O-(CH2)nCOOR或=N-O-(CH2)nCONR2。
在另一实施方案中,本发明提供式III的化合物:
其中R是氢、烷基、芳基烷基、酰基或保护基。
在式III化合物的一实施方案中,R是氢或酰基;并且R1是H、卤素或杂环基。
在式III化合物的一实施方案中,R5是氢、烷基、芳基、杂芳基或芳基烷基。
在式III化合物的一实施方案中,X1与X2一起表示共价键。
在式III化合物的一实施方案中,X1是氢、卤素、NH-OR、NH-O-(CH2)nCOOR或NH-O-(CH2)nCONR2。
在式III化合物的一实施方案中,A1与A2一起为-CH=CH-。
在式III化合物的一实施方案中,A1与A2一起为-CH(OH)-CH(OH)-、-CH(OH)-CH(卤素)-或-CH(卤素)-CH(OH)-。
在式III化合物的一实施方案中,A1与A2一起为1,2-环氧乙烷。
在另一实施方案中,本发明提供式IV的化合物:
其中R6是氢、OR或NR2。
在式IV化合物的一实施方案中,R是氢或酰基。
在式IV化合物的一实施方案中,R1是H、卤素或杂环基。
在式IV化合物的一实施方案中,R5是氢、烷基、芳基、杂芳基或芳基烷基。
在式IV化合物的一实施方案中,A1与A2一起为-CH=CH-。
在式IV化合物的一实施方案中,A1与A2一起为-CH(OH)-CH(OH)-、-CH(OH)-CH(卤素)-或-CH(卤素)-CH(OH)-。
在式IV化合物的一实施方案中,A1与A2一起为1,2-环氧乙烷。
在另一实施方案中,本发明提供式V的化合物:
其中R6是(CH2)nC(O)OR或-(CH2)nC(O)NR2;并且n是1、2或3。
在式V化合物的一实施方案中,R6是-CH2C(O)N(Me)OMe。
在式V化合物的一实施方案中,R1是H、卤素或杂环基。
在式V化合物的一实施方案中,R5是氢、烷基、芳基、杂芳基或芳基烷基。
在式V化合物的一实施方案中,A1与A2一起为-CH=CH-。
在式V化合物的一实施方案中,A1与A2一起为-CH(OH)-CH(OH)-、-CH(OH)-CH(卤素)-或-CH(卤素)-CH(OH)-。
在式V化合物的一实施方案中,A1与A2一起为1,2-环氧乙烷。
在本发明的某些实施方案中,任意一个以上式结构中的R2和R4独立地为OR或选自(Ia)、(Ib)、(Ic)、(Id)、(Ie)和(If)的结构式;R独立地为烷基、酰基、芳基、烷芳基、芳基烷基、杂烷基、杂芳基、杂环基、保护基;条件是R2和R4中的至少一个为选自(Ia)、(Ib)、(Ic)、(Id)、(Ie)和(If)的结构式。
在某些实施方案中,本发明提供具有选自以下结构式的化合物:
或其药学可接受的盐、溶剂合物或酯。
在一实施方案中,本发明提供化合物,其中R2和R4中的一个具有结构式(Ia),L1和L2中的至少一个是-O-,并且p是0或1。优选地,L1和L2均为-O-。
在一实施方案中,本发明提供化合物,其中R2和R4中的一个具有结构式(Ib),并且R5a和R6a独立地为氢或低级烷基。
在一实施方案中,本发明提供化合物,其中R2和R4中的一个具有结构式(Ic),并且R5a、R6a和R7a独立地为氢或低级烷基。
在一实施方案中,本发明提供化合物,其中R2和R4中的一个具有结构式(Id),并且L1为-O-。
在一实施方案中,本发明提供化合物,其中R2和R4中的一个具有结构式(Ie),并且L1为-O-。
在一实施方案中,本发明提供化合物,其中R2和R4中的一个具有结构式(If),并且R5a和R6a独立地为氢或低级烷基。
在一些具体实施方案中,本发明提供具有选自以下结构式的化合物:
或其药学可接受的盐、溶剂合物或酯。
其它具体化合物
一方面,本发明还提供具有选自以下结构式的具体化合物:
或其药学可接受的盐、溶剂合物或酯。
这些具体化合物可以配制于本文所述的药物组合物中,并且可用于治疗本文所述的各种疾病。
立体异构和同质多晶
具有手性中心的本发明的化合物可以以旋光和外消旋形式存在并分离。本发明涵盖了本发明化合物的任何外消旋、旋光、非对映异构、多晶型或立体异构形式,或其混合物,其具有本文所述的有用性质。
在一实施方案中,通过不对称合成,使用本文所述的方法或本领域技术人员已知的合成转化来制备旋光形式的化合物。
获得旋光物质的方法的实例为本领域所已知,并且至少包括下述方法:
i)晶体的物理分离——手工分离单个对映异构体的宏观晶体的技术。如果存在不同对映异构体的晶体,即所述物质是混合体(conglomerate)并且所述晶体在视觉上不同,可使用这一技术;
ii)同时结晶——将单个对映异构体从外消旋物的溶液中分别结晶的技术,该技术只有在外消旋物是固态的混合体时才可使用;
iii)酶法拆分——根据多种对映异构体与酶的不同反应速率来部分或完全分离外消旋物的技术;
iv)酶促不对称合成——合成的至少一个步骤使用酶促反应以获得期望的对映异构体的对映异构纯的或富集的合成前体的合成技术;
v)化学不对称合成——在产生产品的不对称性(即手性)的条件下从非手性前体合成期望的对映异构体的合成技术,其可通过使用手性催化剂或手性助剂来实现;
vi)非对映异构体分离——使外消旋化合物与对映异构纯的试剂(手性助剂)反应的技术,所述对映异构纯的试剂将单个对映异构体转化为非对映异构体。然后根据它们目前更加不同的结构差异,通过色谱或结晶来分离得到的非对映异构体,并随后除去所述手性助剂以获得期望的对映异构体;
vii)一级和二级不对称转化——使其中非对映异构体从外消旋物平衡中产生非对映异构体相对于期望的对映异构体在溶液中的优势,或使其中非对映异构体相对于期望的对映异构体的优先结晶破坏所述平衡,以致最终基本上将所有物质从期望的对映异构体转化为结晶非对映异构体的技术。然后从所述非对映异构体中释放期望的对映异构体;
viii)动力学拆分——该技术是指在动力学条件下根据所述对映异构体与手性非外消旋的试剂或催化剂的不同反应速率来实现对外消旋物的部分或完全拆分(或对被部分拆分的化合物的进一步拆分);
ix)从非外消旋前体的对映特异性(enantiospecific)合成——从非手性原料获得期望的对映异构体并在所述合成过程中没有或仅很少地危及立体化学完整性的合成技术;
x)手性液相色谱法——由于不同对映异构体与固定相的不同相互作用,在液体流动相中分离外消旋物中的对映异构体的技术。所述固定相可由手性材料制成,或者所述流动相可含有其它手性材料以引起不同的相互作用;
xi)手性气相色谱法——挥发外消旋物,并由于不同对映异构体在气体流动相中与含有不挥发的非外消旋手性吸附相的柱的不同相互作用来分离对映异构体的技术;
xii)用手性溶剂萃取——根据一种对映异构体在特定手性溶剂中的优先溶解来分离所述对映异构体的技术;或者
xiii)跨手性膜转运——将外消旋物与薄膜屏障接触的技术。所述屏障通常分离两种混溶液体,一种含有外消旋物,并且驱动力(例如浓度或压力差)引起跨膜屏障的优先转运。发生分离是由于所述膜只允许外消旋物中的一种对映异构体通过的非外消旋手性性质。
定义
无论何时本说明书中的术语被确定为一个范围(即C1-4烷基),所述范围独立地指所述范围的每个要素。作为非限定性实例,C1-4烷基独立地指C1、C2、C3或C4烷基。类似地,当一个或多个取代基被称为“独立地选自”某组时,这是指每个取代基可以是该组的任何要素,并且这些组的任何组合可以从所述组分离。例如,如果R1和R2可独自地选自X、Y和Z,这分别包括以下组:R1是X且R
![]()
Q:办理专利转让的流程及所需资料
A:专利权人变更需要办理著录项目变更手续,有代理机构的,变更手续应当由代理机构办理。
1:专利变更应当使用专利局统一制作的“著录项目变更申报书”提出。
2:按规定缴纳著录项目变更手续费。
3:同时提交相关证明文件原件。
4:专利权转移的,变更后的专利权人委托新专利代理机构的,应当提交变更后的全体专利申请人签字或者盖章的委托书。
Q:专利著录项目变更费用如何缴交
A:(1)直接到国家知识产权局受理大厅收费窗口缴纳,(2)通过代办处缴纳,(3)通过邮局或者银行汇款,更多缴纳方式
Q:专利转让变更,多久能出结果
A:著录项目变更请求书递交后,一般1-2个月左右就会收到通知,国家知识产权局会下达《转让手续合格通知书》。
动态评分
0.0