IPC分类号 : C12N1/18,C12N13/00,C12N15/04,C12R1/865
专利摘要
本发明涉及一种多耐性高产酒精酵母突变株TT31及其筛选方法,利用基因组改组技术筛选耐高温、耐酒精、耐酸的高产酒精酵母诱变株的方法,步骤如下:对三株酵母菌株进行紫外线诱变,采用TTC法一级筛选、杜氏管发酵法二级筛选、摇瓶发酵法三级筛选,选出具有三种耐性且酒精产量明显提高的10株酵母突变株,对其进行原生质体制备,经过三轮的基因组改组,最终得到了对温度、酒精和酸耐性都有较大提高的酵母突变菌株TT31,该突变株在35℃条件下,以蔗糖为碳源进行酒精发酵72h,酒精产量达到了101.9g/L。
说明书
技术领域
本发明属于微生物育种领域,尤其是一种多耐性高产酒精酵母突变株TT31及其筛选方法。
技术背景背景技术
乙醇(俗称酒精)是一种重要的工业原料,广泛用于化工、食品、饮料工业、军工、日用化工和医药卫生等领域。近年来,由于石油基燃料作为汽车燃油的过度消费,已经引起了严重的环境污染。乙醇作为清洁和可再生能源,在汽油中添加乙醇用作液体燃料替代或部分替代汽油,不但可以减少汽油用量,还可以降低环境污染。目前,将甘蔗、玉米、木薯和纤维类废弃物等转化为燃料乙醇,已成为解决能源危机的一条理想途径,而选育优良的微生物菌种是提高乙醇转化生产效率、降低生产成本的关键。
酿酒酵母是传统的酒精生产菌株,具备良好的工业生产性状,耗糖快、乙醇耐受力较高、对水解糖液中有毒物质的抗性强。酿酒酵母属于子囊菌亚门中的酵母菌科成员,主要以芽殖方式繁殖,是一种形态结构较为简单的单细胞真核微生物。在自然界中,酵母主要分布在含糖量较高的偏酸性环境中。
发酵工业是以微生物菌种为核心组织生产的,菌种是发酵工业的关键。酒精发酵过程中,通过糖酵解途径,酵母菌将葡萄糖转化为乙醇和二氧化碳。但是,酵母菌传统的最适发酵温度一般在28-35℃间,一般不超过36℃,该因素增加了发酵法生产乙醇的生产成本,甚至在部分气温较高地区无法进行正常生产;在酒精发酵过程中,发酵液中的酒精逐步积累,当其浓度达到一定值时,便会抑制细胞生长、存活与发酵作用,酵母菌发酵生产酒精能力便受到抑制;为避免染菌,可在酸性条件下进行酒精发酵。诱变、原生质体融合等传统育种技术,可在酵母耐性机制尚不明确时选育耐性菌株,克服酸性(低pH)条件发酵时酒精生产效率低的缺陷,因此,选育优良的多耐性酵母菌株,既能大幅度地提高乙醇的发酵产率,又能提高乙醇产业的经济效益,对推动乙醇发酵工业发展具有重要意义。
工业微生物遗传育种的主要方法包括传统的自然选育和诱变育种,使菌种发生突变,存优去劣;另一方法是进行基因重组,使目的基因高效表达。传统的菌种改良技术,时间长,劳动强度大,需要多轮重组诱变和筛选。本研究所用菌株尚未被遗传表征,直接采用基因工程技术进行育种,同时提高其耐性和酒精产量存在诸多困难。基因组改组(Genome shuffling)技术是一种新型的育种技术,它将包含若干正突变株的突变体库作为每一轮原生质体融合的出发菌株,经过递推式的多轮融合,最终使引起正向突变的不同基因重组到同一个细胞株中,达到筛选优良酵母菌株的目的。相对于常规育种技术,利用基因组改组技术对微生物细胞进行选育,遗传信息量大,可大幅度提高微生物细胞的正向突变频率及正向突变速度,使人们能够在较短的时间内获得高效的正向突变的菌株,不需要了解亲本的详细遗传背景,便于操作。
发明内容发明内容
本发明的目的在于克服现有技术的不足之处,提供一种在高温、低pH条件下酒精产量高的高产酒精酵母突变株TT31及其筛选方法。
本发明实现目的的技术方案如下:
一种多耐性高产酒精酵母突变株TT31,其特征在于:保藏编号为:CGMCC No.4518保藏日期:2010年12月29日,保藏地址为:中国微生物菌种保藏管理委员会普通微生物中心,保藏单位地址:北京市朝阳区北辰西路1号院3号,分类命名为酿酒酵母Saccharomycescrevisiae。
而且,所述突变株TT31最适发酵温度为35℃,最适发酵pH 4.5,耐高温49℃,耐酒精20%,耐酸为pH2.6。
一种多耐性高产酒精酵母突变株TT31的筛选方法,步骤如下:
(1)出发菌株的紫外线诱变:对Saccharomyces crevisiae spc1,Saccharomyces crevisiaeY14,Saccharomyces crevisiae S16三株酵母菌株进行紫外线诱变,取10mL培养至对数期的菌悬液,加至带磁力棒的直径90mm的培养皿中,置于磁力搅拌器载物台上,距离为20cm,开启紫外灯,预热20min,开启搅拌器,打开皿盖,在紫外灯照射下搅拌并计时,分别于0s、15s、30s、45s、60s、75s、90s各取1mL菌液,进行10倍系列稀释后,取0.1mL涂布于平板上,30℃培养2~3d后计数观察结果,选取80%致死率的诱变剂量,spc1为2分钟,Y14、S16为30s,再进行诱变;
(2)诱变株的筛选:酵母菌经紫外线诱变后,取0.1mL涂布于含乙醇浓度分别为9%,10%,11%,12%,13%,14%的平板上,分别置于30℃、35℃培养箱中,培养2~3d,挑取生长较快的菌株进行杜氏管耐酒精、耐酸及酒精发酵试验,从中选出耐酒精,耐酸及酒精产量较高的突变株t1、t2、......、t10用于基因组改组;
(3)诱变菌株的原生质体制备:将t1、t2、......、t10菌株分别接种于50mL YEPD液体培养基中,30℃,120r/min摇床培养12~16h,收集对数生长期细胞,各取5mL加入离心管中,3500r/min离心5min,用生理盐水洗涤两次,加入0.2%β-巯基乙醇溶液,30℃,120r/min振荡处理10min,用KCl高渗缓冲液(pH6.0的磷酸氢二钠-柠檬酸缓冲液,添加KCl至0.7mol/L)洗涤三次,离心弃去上清液,加入2%的蜗牛酶液5mL,渗透压稳定剂为0.5mol/L蔗糖,30℃,120r/min振荡下酶解1.5h,每隔0.5h取样进行镜检观察,待视野中90%以上为原生质体时,2000r/min离心10min,用KCl高渗缓冲液洗涤两次,离心收集原生质体;
(4)第一轮基因组改组:各取0.5mL t1、t2、......、t10菌株的原生质体,浓度为106个/mL,混合,30℃振荡处理15min,2000r/min离心10min,收集细胞,加入2mL 35%PEG-4000促融剂,30℃,120r/min振荡处理20min,2000r/min离心10min,用KCl高渗缓冲液洗涤两次,取0.1mL菌液涂布于再生培养基(YEPD琼脂培养基,添加蔗糖至0.5mol/L)平板上,分别置于44℃、45℃、46℃和47℃恒温培养箱中培养2~3d,待长出菌落后覆盖一层TTC上层培养基,避光保温2~3h,比较各菌株间颜色深浅,实验重复3次,从中筛选出颜色较深的菌株,接种到内含杜氏管的酒精梯度试管中,酒精浓度分别为13%~17%,30℃培养36h。从中选出产气较快的株菌株进行摇瓶发酵试验,获得10株性状稳定的菌株,即第一轮融合菌株T1(T10、T11、......、T19);
(5)第二轮基因组改组:将T1代(T10、T11、......、T19)融合菌株进行原生质体融合,涂布在再生培养基平板上,分别置于46℃、47℃、48℃和49℃恒温培养箱中培养2~3d,待长出菌落后覆盖一层TTC上层培养基,避光保温2~3h,比较各菌株间颜色深浅,实验重复3次,从中筛选出颜色较深的菌株,接种到内含杜氏管的酒精梯度试管中,酒精浓度分别为15%~19%,30℃培养36h。从中选出产气较快的菌株进行摇瓶发酵试验,获得10株性状稳定的菌株,即第二轮融合菌株T2(T20、T21、......、T29);
(6)第三轮基因组改组:将T2代融合菌株(T20、T21、......、T29)进行原生质体融合,涂布在再生培养基平板上,分别置于47℃、48℃、49℃和50℃恒温培养箱中培养2~3d,待长出菌落后覆盖一层TTC上层培养基,避光保温2~3h,比较各菌株间颜色深浅,实验重复3次,从中筛选出颜色较深的菌株,接种到内含杜氏管的酒精梯度试管中,酒精浓度分别为17%~21%,30℃培养36h。从中选出产气较快的菌株进行摇瓶发酵试验。经过三轮基因组改组操作,最终得到一株耐高温49℃,耐酒精20%,耐酸(pH2.6)的突变株TT31,在35℃发酵条件下,以蔗糖为碳源进行发酵72h,酒精产量达到了101.9g/L。
而且,所述TTC法一级筛选的筛选方法如下:
将在YEPD琼脂培养基平板上生长的酵母菌落加入一层含有TTC显色剂的TTC上层培养基,培养后能够显示不同颜色,产酒精能力强的酵母菌落一般成深红色,次之为粉红色。将融合得到的菌株依次接入TTC下层培养基平皿中,35~50℃培养48h,长出菌落后再倒入TTC上层培养基,将菌落覆盖,移至暗处35~50℃培养2~3h,迅速比较菌落颜色深浅,选出色较深的菌落,从对应的平皿上挑出相应的菌落接种至YEPD琼脂培养基平板上,重复3次进行平板初筛,挑出菌落颜色深的酵母菌进行斜面保存。
而且,所述杜氏管发酵法二级筛选法如下:
将一级筛选得到的酵母菌株分别按5%~15%接种量接种到装有杜氏管的YEPD液体培养基试管中,在无菌条件下分别加入不同体积的无水乙醇,25~35℃静置培养,35~50h后观察产气情况,选择产气快且产气量大的菌株进行三级筛选。
而且,所述摇瓶发酵法三级筛选法如下:
将二级筛选得到的酵母菌株活化后进行扩大培养,以8%的接种量转入发酵培养基,30~40℃,75~85r/min发酵70~75h,测定发酵液中的酒精含量,比较酒精产量。
本发明的优点和效果是:
1.本发明根据基因组改组技术原理,将包含若干正突变株的突变体作为每一轮原生质体融合的出发菌株,经过递推式的多轮融合,最终将正向突变的不同基因重组到同一个细胞株中,最终筛选得到性状优良的酵母菌株。
2.本发明在筛选菌种过程中采用三级筛选方法,分别为TTC法一级筛选;杜氏管发酵法二级筛选;摇瓶发酵法三级筛选。原生质体制备条件为:菌种培养时间12h,蜗牛酶液浓度为2.0%,酶解时间1.5h,渗透压稳定剂为0.5mol/L蔗糖,有效地提高了原生质体的形成率和再生率。
3.本发明将具有一定耐高温、耐酒精、耐酸及酒精产量较高的spc1,Y14,S16三株酿酒酵母菌作为出发菌株,对其进行改造,最终得到了耐高温、耐酒精分别提高了22.5%,66.7%,而耐酸达到pH2.6,在较低pH条件下蔗糖发酵酒精产量提高21.5%的酒精酵母突变株TT31。
4.本发明筛选出的酒精酵母突变株TT31适于以蔗糖为碳源的酒精发酵,具有耐高温、耐酒精、耐酸等特点,酒精产量也达到了先进水平,其最适发酵温度为35℃,最适发酵pH4.5,解决了高温、低pH条件下酒精产量较低的问题,有利于工业化生产。
附图说明附图说明
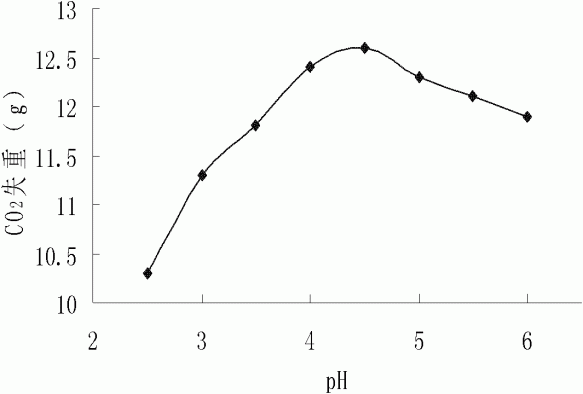
图1为本发明pH对突变株TT31发酵的影响。
具体实施方式具体实施方式
下面结合具体实施方案对本发明进一步说明,其具体实施方案应该理解为仅为举例说明,不是限定性的,不能以下述举例说明来限定本发明的保护范围。
本发明的技术路线为:对出发菌株进行紫外线诱变,筛选出耐性及低pH发酵时酒精产量有一定提高的诱变菌株,然后对其进行原生质体制备和三轮基因组改组,经过TTC法一级筛选,杜氏管发酵法二级筛选,摇瓶发酵法三级筛选,最终筛选出对酸、温度和酒精耐性都有较大提高的酵母突变株。
一种多耐性高产酒精酵母突变株TT31,分类命名为Saccharomyces crevisiae,保藏编号为:CGMCC No.4518,保藏日期:2010年12月29日,保藏地址为:中国微生物菌种保藏管理委员会普通微生物中心。最适发酵温度为35℃,最适发酵pH4.5,耐高温49℃,耐酒精20%,耐酸为pH2.6;在35℃条件下,以蔗糖为碳源进行酒精发酵72h,酒精产量达到101.9g/L。
一种多耐性高产酒精酵母突变株TT31的筛选方法,步骤如下:
1.出发菌株的紫外线诱变:出发菌株的紫外线诱变:对Saccharomyces crevisiae spc1,Saccharomyces crevisiaeY14,Saccharomyces crevisiae S16三株酵母菌株进行紫外线诱变,取10mL培养至对数期的菌悬液,加至带磁力棒的直径90mm的培养皿中,置于磁力搅拌器载物台上,距离为20cm,开启紫外灯,预热20min,开启搅拌器,打开皿盖,在紫外灯照射下搅拌并计时,分别于0s、15s、30s、45s、60s、75s、90s各取1mL菌液,进行10倍系列稀释后,取0.1mL涂布于平板上,30℃培养2~3d后计数观察结果,选取80%致死率的诱变剂量,spc1为2分钟,Y14、S16为30s,再进行诱变。
2.诱变株的筛选:酵母菌经紫外线诱变后,取0.1mL分别涂布于含乙醇浓度为9%,10%,11%,12%,13%,14%平板上,分别放于30℃、35℃培养箱中,培养2~3d,挑取生长较快的菌株进行杜氏管耐酒精、耐酸及酒精发酵试验,从中选出耐酒精,耐酸及酒精产量较高的突变株t1、t2、t3、t4、t5、t6、t7、t8、t9、t10用于基因组改组;
3.诱变菌株的原生质体制备:将t1、t2、t3、t4、t5、t6、t7、t8、t9、t10菌株分别接种于50mL YEPD液体培养基中,30℃,120r/min摇床培养12~16h,收集对数生长期细胞,各取5mL加入离心管中,3500r/min离心5min,用生理盐水洗涤两次,加入0.2%β-巯基乙醇溶液,30℃,120r/min振荡处理10min,用KCl高渗缓冲液(pH6.0的磷酸氢二钠-柠檬酸缓冲液,添加KCl至0.7mol/L)洗涤三次,离心弃去上清液,加入2%的蜗牛酶液5mL,渗透压稳定剂为0.5mol/L蔗糖,30℃,120r/min振荡下酶解1.5h,每隔0.5h取样进行镜检观察,待视野中90%以上为原生质体时,2000r/min离心10min,用KCl高渗缓冲液洗涤两次,离心收集原生质体;
4.第一轮基因组改组:各取0.5mL t1、t2、t3、t4、t5、t6、t7、t8、t9、t10菌株的原生质体,浓度为106个/mL,混合,30℃振荡处理15min,2000r/min离心10min,收集细胞,加入2mL 35%PEG-4000促融剂,30℃,120r/min振荡处理20min,2000r/min离心10min,用KCl高渗缓冲液洗涤两次,取0.1mL菌液涂布于再生培养基(YEPD琼脂培养基,添加蔗糖至0.5mol/L)平板上,分别置于44℃、45℃、46℃和47℃恒温培养箱中培养2~3d,待长出菌落后覆盖一层TTC上层培养基,避光保温2~3h,比较各菌株间颜色深浅,实验重复3次,从中筛选出颜色较深的菌株,接种到内含杜氏管的酒精梯度试管中,酒精浓度分别为13%~17%,30℃培养36h。从中选出产气较快的株菌株进行摇瓶发酵试验,获得10株性状稳定的菌株,即第一轮融合菌株T1(T10、T11、......、T19);
5.第二轮基因组改组:将T1代融合菌株(T10、T11、......、T19)进行原生质体融合,涂布在再生培养基平板上,分别置于46℃、47℃、48℃和49℃恒温培养箱中培养2~3d,待长出菌落后覆盖一层TTC上层培养基,避光保温2~3h,比较各菌株间颜色深浅,实验重复3次,从中筛选出颜色较深的菌株,接种到内含杜氏管的酒精梯度试管中,酒精浓度分别为15%~19%,30℃培养36h。从中选出产气较快的菌株进行摇瓶发酵试验,获得10株性状稳定的菌株,即第二轮融合菌株T2(T20、T21、......、T29);
6.第三轮基因组改组:将T2代融合菌株(T20、T21、......、T29)进行原生质体融合,涂布在再生培养基平板上,分别置于47℃、48℃、49℃和50℃恒温培养箱中培养2~3d,待长出菌落后覆盖一层TTC上层培养基,避光保温2~3h,比较各菌株间颜色深浅,实验重复3次,从中筛选出颜色较深的菌株,接种到内含杜氏管的酒精梯度试管中,酒精浓度分别为17%~21%,30℃培养36h。从中选出产气较快的菌株进行摇瓶发酵试验。经过三轮基因组改组操作,最终得到一株耐高温49℃,耐酒精20%,耐酸(pH2.6)的突变株TT31,在35℃发酵条件下,以蔗糖为碳源进行发酵72h,酒精产量达到了101.9g/L。
所述菌株高产酒精的发酵条件为:培养基:蔗糖240g/L,酵母膏28g/L,硫酸铵4.7g/L,pH4.5。发酵条件:35℃,80r/min,发酵72h。
(1)耐温试验:将TT31菌株按10%的接种量接入到YEPD培养基中,在温度分别为47℃,48℃,49℃,50℃及51℃条件下培养48h,观察产气情况,结果见表1。
表1突变株TT31的耐热性
注:“+”表示产气,“+”的多少表示产气的多少,“++++”表示气泡满管
由表1可以看出,突变株TT31最高能耐热49℃。
(2)耐酒精试验:将TT31菌株按10%的接种量接入到内置杜氏管,酒精含量分别为17%,18%,19%,20%和21%的YEPD液体培养基试管中,30℃培养48h,观察产气情况,结果见表2。
表2突变株TT31的耐酒精性
注:“+”表示产气,“+”的多少表示产气的多少,“++++”表示气泡满管
由表2可以看出,突变株TT31耐酒精能力为20%(v/v)。
(3)耐酸试验:将TT31菌株按10%的接种量接入到内置杜氏管、pH分别为2.0,2.2,2.4,2.6,2.8和3.0的YEPD液体培养基试管中(用乳酸调节pH),30℃培养24h后观察产气情况,结果见表3。
表3突变株TT31的耐酸情况
注:“+”表示产气,“+”的多少表示产气的多少,“++++”表示气泡满管
由表3可以看出,突变株耐酸能力为pH2.6。
(4)酒精测定方法:碘量滴定法(重铬酸钾氧化法)
(5)最适发酵pH的确定
将酵母种子液以8%的接种量接入到不同pH(2.5,3.0,3.5,4.0,4.5,5.0,5.5,6.0)的发酵培养基中,35℃发酵72h,发酵结束后测各pH下的CO2失重,结果如图1。由图1可以看出,突变株TT31的最适发酵pH为4.5左右。(葡萄糖发酵成乙醇的总反应式为:C6H12O6→2C2H5OH+2CO2↑+2ATP。根据CO2失重量来衡量乙醇的产量。)
“TTC法一级筛选,杜氏管发酵法二级筛选,摇瓶发酵法”筛选方法叙述如下:
(1)TTC法一级筛选
将在YEPD琼脂培养基平板上生长的酵母菌落加入一层含有TTC显色剂的TTC上层培养基,培养后能够显示不同颜色,产酒精能力强的酵母菌落一般成深红色,次之为粉红色。将融合得到的菌株依次接入TTC下层培养基平皿中,35~50℃培养48h,长出菌落后再倒入TTC上层培养基,将菌落覆盖,移至暗处35~50℃培养2~3h后,迅速比较菌落颜色深浅,选出色较深的菌落,从对应的平皿上挑出相应的菌落接种至YEPD琼脂培养基平板上,重复3次进行平板初筛,挑出菌落颜色深的酵母菌进行斜面保存。
(2)杜氏管发酵法二级筛选
将一级筛选得到的酵母菌株分别按5%~15%接种量接种到装有杜氏管的YEPD液体培养基试管中,在无菌条件下分别加入不同体积的无水乙醇,25~35℃静置培养,35~50h后观察产气情况,选择产气快且产气量大的菌株进行三级筛选。
(3)摇瓶发酵法三级筛选
将二级筛选得到的酵母菌株活化后进行扩大培养,以8%的接种量转入发酵培养基,30~40℃,75~85r/min发酵70~75h,测定发酵液中酒精含量,比较酒精产量。
(4)筛选用培养基
①一级筛选培养基:
TTC上层培养基:TTC 0.05g,葡萄糖0.5g,琼脂1.5g,水100mL;
TTC下层培养基(YEPD固体培养基):葡萄糖2g,蛋白胨2g,酵母膏1g,琼脂2g,用水定容至100mL,115℃灭菌20min。
②二级筛培养基:加杜氏小管的YEPD液体培养基。
③三级培养基(发酵培养基):
蔗糖240g/L,硫酸铵4.7g/L,酵母膏28g/L,pH 4.5(用柠檬酸调节),其余为水。
一种多耐性高产酒精酵母突变株TT31及其筛选方法专利购买费用说明
![]()
Q:办理专利转让的流程及所需资料
A:专利权人变更需要办理著录项目变更手续,有代理机构的,变更手续应当由代理机构办理。
1:专利变更应当使用专利局统一制作的“著录项目变更申报书”提出。
2:按规定缴纳著录项目变更手续费。
3:同时提交相关证明文件原件。
4:专利权转移的,变更后的专利权人委托新专利代理机构的,应当提交变更后的全体专利申请人签字或者盖章的委托书。
Q:专利著录项目变更费用如何缴交
A:(1)直接到国家知识产权局受理大厅收费窗口缴纳,(2)通过代办处缴纳,(3)通过邮局或者银行汇款,更多缴纳方式
Q:专利转让变更,多久能出结果
A:著录项目变更请求书递交后,一般1-2个月左右就会收到通知,国家知识产权局会下达《转让手续合格通知书》。
动态评分
0.0