IPC分类号 : C07J71/00,C07J31/00,C07J41/00,C07J43/00,A61P35/00
专利摘要
本发明属于医药学技术领域,公开了一种薯蓣皂苷元抗肿瘤衍生物及其合成方法,得到化合物3后,再以三乙胺作碱,与氯乙酰氯反应,得到3‑C位酰胺类化合物4,最后化合物4再与含氮化合物反应,得到一系列酰胺类含氮衍生物5。本发明的衍生物及中间体整体显示出高的抑制活性和低细胞毒性,其中含有哌嗪环的衍生物5a、5e及中间体4显示出了较强的抑制活性,5c、5e、5f、5g、5h、5i衍生物对HBE细胞显示低的细胞毒性;本发明的结果对薯蓣皂苷元的结构修饰和不同基团抗肿瘤活性的分析提供一定的参考价值。
权利要求
1.一种薯蓣皂苷元抗肿瘤衍生物的合成方法,以化合物3加以三乙胺作碱,与氯乙酰氯反应,得到3-C位酰胺类化合物4,化合物4再与含氮化合物反应,得到一系列酰胺类含氮衍生物5a~5i;含氮化合物为不同结构特征的含氮杂环类、含氮直链类。
2.如权利要求1所述的薯蓣皂苷元抗肿瘤衍生物的合成方法,其特征在于,所述的薯蓣皂苷元抗肿瘤衍生物的合成方法的分子式合成方法为:
3.如权利要求1所述的薯蓣皂苷元抗肿瘤衍生物的合成方法,其特征在于,(25R)-3α-哌嗪乙酰胺基螺甾烷-5-烯5a的合成方法包括:
称取中间体40.15g,0.31mmol、哌嗪0.13g,1.5mmol、溶于丙酮8mL中,在60℃下回流反应6h;停止反应,80KPa下减压蒸去丙酮溶剂,加10mL H2O析出固体,抽去H2O、80℃烘干滤饼,重结晶得白色固体5a 0.15g。
4.如权利要求1所述的薯蓣皂苷元抗肿瘤衍生物的合成方法,其特征在于,(25R)-3α-咪唑乙酰胺基螺甾烷-5-烯5b的合成方法包括:
将中间体4 0.13g,0.26mmol、咪唑0.18g,2.6mol、CH2Cl210mL加入圆底烧瓶中,加入三乙胺0.22mL在60℃下回流反应,用TLC跟踪反应;用水洗涤、干燥、过滤的米白色固体5b 0.12g。
5.如权利要求1所述的薯蓣皂苷元抗肿瘤衍生物的合成方法,其特征在于,
(25R)-3α-哌啶乙酰胺基螺甾烷-5-烯5c的合成方法包括:
依次将中间体40.09g,0.18mmol、CH2Cl23mL、哌啶0.2mL,1.9mmol加入圆底烧瓶中室温反应,反应结束后,减压蒸去溶剂,加水析出固体,抽滤,滤饼用水洗涤三次,烘干,得化合物5c 0.08g。
6.如权利要求1所述的薯蓣皂苷元抗肿瘤衍生物的合成方法,其特征在于,(25R)-3α-吗啉乙酰胺基螺甾烷-5-烯(5f)的合成方法包括:
将中间体40.31g,0.63mmol溶于吗啉10mL中,室温搅拌10h后停止反应;反应液中加入水有固体析出,抽滤、滤饼用水洗涤、烘干、重结晶得化合物5f0.30g。
7.如权利要求1所述的薯蓣皂苷元抗肿瘤衍生物的合成方法,其特征在于,
(25R)-3α-四氢吡咯乙酰胺基螺甾烷-5-烯5g的合成方法包括:
依次将中间体40.13g,0.26mmol、CH2Cl27mL、四氢吡咯0.25mL,3.0mmol、三乙胺0.20mL,1.5mmol加入圆底烧瓶中室温反应,TLC跟踪反应直至反应完全;减压蒸去溶剂,加水析出固体,抽滤、滤饼用水洗涤、烘干、重结晶得化合物5g 0.10g。
8.一种如权利要求1所述薯蓣皂苷元抗肿瘤衍生物的合成方法合成的薯蓣皂苷元抗肿瘤衍生物。
说明书
技术领域
本发明属于医药学技术领域,尤其涉及一种薯蓣皂苷元抗肿瘤衍生物及其合成方法。
背景技术
薯蓣皂苷元是从薯蓣科植物盾叶薯、穿龙薯蓣等根茎中分离出来的一种甾体类化合物,其化学名称为Δ5-异螺旋甾烯-3β-醇,是合成甾体激素类药物和甾体避孕药的重要原料,具有降血脂、抗血栓、抗肿瘤等药理活性。但是薯蓣皂苷元的药物脂溶性大,口服生物利用度很低,抗肿瘤活性较弱,毒副作用较大等缺陷,这使得薯蓣皂苷元在在医药上的应用受到限制。近年来,分析工作者对薯蓣皂苷元的A环3-C位羟基和F环26-C进行一系列的结构修饰和改造,部分衍生物表现出了良好的抗肿瘤活性,但并未完全解决薯蓣皂苷元存在的缺陷。因此,对薯蓣皂苷元进行合理的结构修饰,设计合成新型衍生物,筛选出更加有效的化学结构,仍然具有一定的挑战性。
由于酰胺结构及含氮类衍生物结构具有独特的生物活性,所以本发明设计合成了该类结构的衍生物,该类结构的衍生物可以延长药物在体内的作用时间,降低毒副作用,提高水溶性及药物的生物利用度。
综上所述,现有技术存在的问题是:
由于薯蓣皂苷元存在脂溶性大、毒副作用大、口服利用度低和抗肿瘤活性差等问题,所以在医药上的应用受到限;通过将薯蓣皂苷元A环3位改造成酰胺含氮类结构的化合物,改善了薯蓣皂苷元存在的问题,且同类衍生物的合成鲜有报道。
发明内容
针对现有技术存在的问题,本发明提供了一种薯蓣皂苷元抗肿瘤衍生物及其合成方法。
本发明是这样实现的,一种薯蓣皂苷元抗肿瘤衍生物的合成方法,包括:
以薯蓣皂苷元为底物,将3-C位羟基叠氮化,然后使叠氮基还原为氨基,得化合物3,再以三乙胺作碱,与氯乙酰氯反应,得到3-C位酰胺类化合物4,最后化合物4再与含氮化合物反应,得到一系列酰胺类含氮衍生物5a~5i;含氮化合物为不同结构特征的含氮杂环类、含氮直链类;
进一步,分子式合成方法为:
进一步,(25R)-3α-哌嗪乙酰胺基螺甾烷-5-烯5a的合成方法包括:
称取中间体40.15g,0.31mmol、哌嗪0.13g,1.5mmol、溶于丙酮8mL中,在60℃下回流反应6h;停止反应,80KPa下减压蒸去丙酮溶剂,加10mL H2O析出固体,抽去H2O、80℃烘干滤饼,重结晶得白色固体5a 0.15g。
进一步,(25R)-3α-咪唑乙酰胺基螺甾烷-5-烯5b的合成方法包括:
将中间体4 0.13g,0.26mmol、咪唑0.18g,2.6mol、CH2Cl210mL加入圆底烧瓶中,加入三乙胺0.22mL在60℃下回流反应,用TLC跟踪反应;用水洗涤、干燥、过滤的米白色固体5b 0.12g。
进一步,(25R)-3α-哌啶乙酰胺基螺甾烷-5-烯5c的合成方法包括:
依次将中间体40.09g,0.18mmol、CH2Cl23mL、哌啶0.2mL,1.9mmol加入圆底烧瓶中室温反应,反应结束后,减压蒸去溶剂,加水析出固体,抽滤,滤饼用水洗涤三次,烘干,得化合物5c 0.08g。
进一步,(25R)-3α-吗啉乙酰胺基螺甾烷-5-烯(5f)的合成方法包括:
将中间体40.31g,0.63mmol溶于吗啉10mL中,室温搅拌10h后停止反应;反应液中加入水有固体析出,抽滤、滤饼用水洗涤、烘干、重结晶得化合物5f0.30g。
进一步,(25R)-3α-四氢吡咯乙酰胺基螺甾烷-5-烯5g的合成方法包括:
依次将中间体40.13g,0.26mmol、CH2Cl27mL、四氢吡咯0.25mL,3.0mmol、三乙胺0.20mL,1.5mmol加入圆底烧瓶中室温反应,TLC跟踪反应直至反应完全;减压蒸去溶剂,加水析出固体,抽滤、滤饼用水洗涤、烘干、重结晶得化合物5g0.10g。
本发明的另一目的在于提供一种薯蓣皂苷元抗肿瘤衍生物。
本发明的优点及积极效果为:
本发明以薯蓣皂苷元为先导物,设计并合成了9个新的薯蓣皂苷元含氮衍生物,其结构经过1H NMR、13C NMR、IR和HRMS鉴定。所有衍生物采用MTT法进行的抗肿瘤活性(A549、A431、H1975、HCT-116、Aspc-1、Ramos)的测定,以及细胞毒性(HBE、LO-2)的分析。
与薯蓣皂苷元对比,衍生物及中间体整体显示出高的抑制活性和低细胞毒性,其中含有哌嗪环的衍生物5a、5e及中间体4对A549、A431、H1975、HCT-116、Aspc-1、Ramos等细胞显示出了较强的抑制活性,5c(IC50 51.85)、5e(IC50 63.07)、5f(IC50 85.49)、5g(IC5055.74)、5h(IC50>80)、5i(IC50 55.38)衍生物对HBE细胞显示低的细胞毒性;本发明得到一系列酰胺类含氮衍生物5a~5i,对薯蓣皂苷元的结构修饰和不同基团抗肿瘤活性的分析提供一定的参考价值。
附图说明
图1是本发明实施例提供的薯蓣皂苷元抗肿瘤衍生物的合成方法流程图。
具体实施方式
为了使本发明的目的、技术方案及优点更加清楚明白,以下结合实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。
现有技术中,薯蓣皂苷元在在医药上的应用受到限;通过将薯蓣皂苷元A环3位改造成酰胺含氮类结构的化合物,同类衍生物的合成鲜有报道。
本发明的薯蓣皂苷元分子式为:
下面结合附图对本发明的应用原理作详细描述。
本发明实施例提供的薯蓣皂苷元抗肿瘤衍生物的合成方法,以薯蓣皂苷元为底物,将3-C位羟基叠氮化,然后使叠氮基还原为氨基,得化合物3;
具体包括:
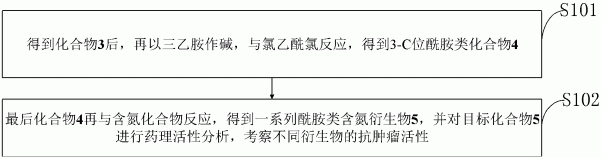
S101:得到化合物3后,再以三乙胺作碱,与氯乙酰氯反应,得到3-C位酰胺类化合物4;
S102:最后化合物4再与含氮化合物反应,得到一系列酰胺类含氮衍生物5,并对目标化合物5进行药理活性分析,考察不同衍生物的抗肿瘤活性。
下面结合具体实施例对本发明的应用原理作进一步描述。
下面结合薯蓣皂苷元抗肿瘤衍生物的合成方法对本发明作进一步描述。
1.结果
1.1目标化合物5的设计合成
薯蓣皂苷元结构中存在不同的活性基团,首先将3-C位羟基转变为酰胺基团,再与含氮类化合物反应生成目标化合物5a~5i(Scheme 1)。在这些衍生物合成中,为了考察不同含氮化合物的药理活性,本发明选择了不同结构特征的含氮化合物,如含氮杂环类、含氮直链类。
目标化合物5的合成:
1.2目标化合物5的合成条件分析
衍生物5合成的中,首先以甲苯、二氯甲烷、丙酮作溶剂,对溶剂进行了筛选,当甲苯作溶剂时,由于对原料溶解性差,原料无法反应完全;当二氯甲烷、丙酮作溶剂时,对原料溶解性提高,原料反应完全且产率显著提高。本发明不仅考察了溶剂对反应的影响,而且也考察缚酸剂对反应的影响,其中5b、5g的合成中,当以丙酮作溶剂,三乙胺为缚酸剂时,副产物减少且原料反应完全,产率提高到86%。其可能原因是,5b、5g含氮五元环活性较差,不加缚酸剂的条件下,原料无法反应完全,且副产物较多。
1.3目标化合物5的结构表征
薯蓣皂苷元含氮衍生物,在IR谱图中,N-H的伸缩振动峰在3354~3553cm-1左右,酰胺结构的C=O的伸缩振动峰在1651~1688cm-1。在1H NMR谱图中,薯蓣皂苷元的特征峰分别是δ5.41~5.38为6-H,δ4.41为16-H,δ4.12附近的3-H,δ2.89~4.61处的CH2-H和δ3.46~3.35处的26-H;含氮衍生物中,δ7.50、7.14、6.91处为咪唑环上的质子信号,吗啉环的质子信号在δ3.69和2.5左右,羟乙基哌嗪环的质子信号在δ3.04左右,哌嗪环的质子信号在δ2.97左右,四氢吡咯环的质子信号在δ3.13和2.5左右,二乙醇胺的质子信号在δ3.63和2.74左右,二乙胺的质子信号在δ2.50左右处。在HRMS谱图中,目标产物的HRMS[M+H]+实测值和理论计算值一致,进一步证实了目标化合物的结构。
1.4药理实验
采用MTT法考察了所有衍生物对A549(人肺癌细胞)、A431(人肺癌细胞)、H1975(人肺癌细胞)、HCT-116(人结肠癌细胞)、Aspc-1(人胰腺癌细胞)和Ramos(人B淋巴瘤细胞)的抗肿瘤活性,以及对HBE(人支气管上皮细胞)、LO-2(正常肝细胞)的细胞毒性,测定结果如表1所示。
表1 薯蓣皂苷元衍生物的抗肿瘤活性及细胞毒性
Table1 Antitumor Activity and Cytotoxicity of Diosgenin Derivatives
薯蓣皂苷元含氮衍生物IC50值显示,大部分衍生物比薯蓣皂苷元具有高的肿瘤抑制活性和低的细胞毒性。尤其是5a、5e含有哌嗪环的衍生物对所有抗肿瘤活性显著,仅对A431、Ramos细胞抑制活性较差。此外,除衍生物5a(IC50=5.72)、5b(IC50=10.91)、5d(IC50=13.50)外,其余衍生物对HBE细胞均显低的细胞毒性,对LO-2细胞,除5f(IC50>40)外,其余衍生物的细胞毒性较高。中间体4衍生物5对肺癌细胞A549、H1975表现出良好的生物活性,对肺癌细胞A431,生物活性较差,其中中间体4、化合物5a和5e,对三种肺癌细胞都具有显著的抗肿瘤活性。对于HCT-116(人结肠癌细胞)、Aspc-1(人胰腺癌细胞),化合物4和衍生物5有较好的生物活性,对Ramos(人B淋巴瘤细胞),化合物5a、5c、5e、5i、及4抗肿瘤活性较高,其余衍生物抗肿瘤活性较差。
下面结合具体分析对本发明作进一步描述。
2.分析。
本发明以薯蓣皂苷元为先导物,设计合成了9个新型薯蓣皂苷元含氮衍生物。其结构经1H NMR、13C NMR、IR和HRMS鉴定。所有衍生物都经过了抗肿瘤活性和细胞毒性的分析,与薯蓣皂苷元对比,衍生物及中间体整体显示出高的抑制活性和低细胞毒性,其中含有哌嗪环的衍生物5a、5e及中间体4显示出了较强的抑制活性,5c、5e、5f、5g、5h、5i衍生物对HBE细胞显示低的细胞毒性。本发明的分析结果对薯蓣皂苷元的结构修饰和不同基团抗肿瘤活性的分析提供一定的参考价值。
下面结合实验对本发明作进一步描述。
3实验部分
3.1仪器与试剂
(Agilent-400(400MHz)型核磁共振仪,TMS作内标,CDCl3作溶剂;SGW-4显微熔点测定仪(上海精密科学仪器有限公司),温度计未经校正;LCQADVANTAGE MAX质谱仪;SGW-1型旋光仪(上海仪电物理光学仪器有限公司);FTS 3000傅里叶变换红外光谱仪(美国DIGILAB公司),KBr压片;硅胶GF254高效板(烟台江友硅胶开发有限公司)。其余试剂均为分析纯试剂。
3.2细胞的培养
收集对数期生长的A549、A431、H1975、HCT-116、Aspc-1、Ramos、HBE和LO-2细胞,调整悬浊液浓度,每孔体积100μL,7×103个细胞,接种到96孔板。细胞贴壁后,0%FBS RPMI-1640饥饿10h,对照组用10%FBS RPMI-1640培养,36℃,5%CO2培养箱中培养50h。
3.3MTT法测定药理活性及细胞毒性
A549、A431、H1975、HCT-116、Aspc-1、Ramos、HBE和LO-2八种细胞培养后,加入100μL MTT溶液,4h后终止培养,每孔加入100μL三联液,在摇床上轻微振荡,使结晶全部溶解。用酶联检测仪测定各孔吸光度值,选择570nm波长,以RPMI-1640培养液空白凋零,测各孔的吸光度值。细胞生长抑制率=(对照组吸光度值-实验组吸光度值)/对照组吸光度值×100%。GraphPad软件中的GraphPad prism针对抑制浓度作图,由log[抑制剂]相对于反应,可变斜率模型估算出IC50值。
3.4实验方法
(25R)-3α-氯乙酰胺基螺甾烷-5-烯(4)的合成
氮气保护下,将薯蓣皂苷元(6.62g,15.9mmol)、三乙胺(11mL,79.0mmol)和CH2Cl2(12mL)加入圆底烧瓶中,冰浴下滴加甲磺酰氯(5mL,63.6mmol),控制温度不超过5℃,滴完继续冰浴反应。待反应结束后,依次用H2O、饱和NaHCO3、饱和NaCl洗涤,干燥过滤,减压浓缩得浅黄色固体1(7.52g,96%)。
称取化合物1(7.52g,15.2mmol)溶于DMF(70mL)中,于85℃下加入NaN3(1.98g,30.4mol),在90℃下搅拌反应10h后停止反应。加入H2O(70mL),乙酸乙酯萃取(70mL×4),有机层用H2O、饱和NaHCO3洗涤,无水硫酸钠干燥,过滤,减压浓缩得化合物2(6.50g,97%)。
依次将化合物2(3.56g,8.1mmol)、PPh3(4.25g,16.2mmol)、THF(18mL)、H2O(2mL)加入圆底瓶中,在60℃下反应。反应结束,减压蒸去溶剂。柱色谱分离提纯得化合物3(1.52g,45%)。
氮气保护下,将化合物3(1.95g,4.7mmol)溶于CH2Cl2(60mL)中,0℃下加入三乙胺(2.6mL),滴加氯乙酰氯(0.7mL),滴毕在0℃下继续4.5h。停止反应加水(60mL×3)洗涤,无水硫酸钠干燥,减压浓缩。柱色谱分离得化合物4(1.20g,52%)m.p.183~187℃; 1H NMR(CDCl3,400MHz)δ:6.72(brs,1H,N-H),5.44(d,J=5.1Hz,1H,6-H),4.40(q,J=7.5Hz,1H,16-H),4.12(q,J=2.9Hz,1H,3-H),4.00(d,J=4.8Hz,2H,CH2-H),3.46(dd,J=2.8Hz,1H,26α-H),3.36(t,J=10.9Hz,1H,26β-H);13C NMR(CDCl3,100MHz)δ:164.71,138.36,123.89,109.31,80.74,66.82,62.06,56.34,50.58,46.01,42.88,41.59,40.20,39.65,37.51,36.94,34.29,32.07,31.79,31.36,31.33,30.26,28.77,25.98,20.55,18.85,17.10,16.23,16.2314.49;IR(KBr)ν:3286,2955,1683,1651,1538,1059,903cm-1;HRMS(ESI)calcd for C29H44ClNO3[M+H]+490.3088,found 490.3160.
(25R)-3α-哌嗪乙酰胺基螺甾烷-5-烯(5a)的合成
称取中间体4(0.15g,0.31mmol)、哌嗪(0.13g,1.5mmol)、溶于丙酮(8mL)中,在60℃下回流反应6h。停止反应,减压蒸去溶剂,加10mLH2O析出固体,抽滤、烘干滤饼,重结晶得白色固体5a(0.15g,91%)。m.p.174~177℃; 1H NMR(CDCl3,400MHz)δ:7.44(brs,1H,N-H),5.38(d,J=5.0Hz,1H,6-H),4.41(q,J=7.54Hz,1H,16-H),4.12(s,1H,3-H),3.46(d,J=10.2Hz,1H,26α-H),3.37(t,J=10.9Hz,1H,26β-H);13C NMR(CDCl3,100MHz)δ:168.80,139.26,123.05,109.25,80.70,77.19,62.05,61.97,56.55,54.18,51.07,46.14,44.94,41.58,40.21,39.68,37.58,37.26,34.68,32.37,31.79,31.38,31.36,30.26,28.77,20.54,18.93,17.11,16.26,14.51,0.98;IR(KBr)ν:3350,2948,2870,1683,1521,1461,1058cm-1;HRMS(ESI)calcd for C33H53N3O3[M+H]+540.4165,found 540.4167.
同法制备5d、5e、5i.
(25R)-3α-咪唑乙酰胺基螺甾烷-5-烯(5b)的合成
将中间体4(0.13g,0.26mmol)、咪唑(0.18g,2.6mol)、CH2Cl2(10mL)加入圆底烧瓶中,加入三乙胺(0.22mL)在60℃下回流反应,用TLC跟踪反应。用水洗涤、干燥、过滤的米白色固体5b(0.12g,86%)。m.p.179~180℃; 1H NMR(CDCl3,400MHz)δ:7.50(s,1H,咪唑-H),7.14(s,1H,咪唑-H),6.91(s,1H,咪唑-H),5.41(d,J=7.6Hz,1H,6-H),5.17(brs,1H,N-H),4.61(s,2H,CH2-H),4.41(q,J=7.4Hz,1H,16-H),4.07(s,1H,3-H),3.46(d,J=7.2Hz,1H,26α-H),3.36(t,J=10.9Hz,1H,26β-H);13C NMR(CDCl3,100MHz)δ:165.73,137.92,137.75,130.60,124.31,119.50,109.20,80.70,66.79,62.01,56.20,50.57,50.24,45.60,41.57,40.14,39.53,37.43,37.04,34.56,31.94,31.76,31.36,31.27,30.25,28.77,25.96,20.47,18.74,17.10,16.20,14.51;IR(KBr)ν:3408,2968,1685,1082,806cm-1;HRMS(ESI)calcd for C32H47N3O3[M+H]+522.3696,found 522.3699.
(25R)-3α-哌啶乙酰胺基螺甾烷-5-烯(5c)的合成
依次将中间体4(0.09g,0.18mmol)、CH2Cl2(3mL)、哌啶(0.2mL,1.6mmol)加入圆底烧瓶中室温反应,反应结束后,减压蒸去溶剂,加水析出固体,抽滤,滤饼用水洗涤三次,烘干,得化合物5c(0.08g,81%)。m.p.128~132℃; 1H NMR(CDCl3,400MHz)δ:7.95(brs,1H,N-H),5.39(d,J=7.5Hz,1H,6-H),4.42(q,J=7.4Hz,1H,16-H),4.11(s,1H,3-H),3.46(d,J=7.7Hz,1H,26α-H),3.35(t,J=13.4Hz,1H,26β-H),2.89(s,2H,CH2-H),2.39(d,J=26.8Hz,4H,哌啶-H);13C NMR(CDCl3,100MHz)δ:139.14,123.03,109.27,80.72,77.19,66.81,62.18,62.04,56.67,54.86,50.89,44.91,44.56,41.56,40.21,39.75,37.50,37.21,34.60,32.33,31.78,30.26,28.76,26.41,26.18,23.74,20.54,18.95,17.10,16.27,14.50,0.98;IR(KBr)ν:3553,3355,2941,1677,1522,1054cm-1;HRMS(ESI)calcd for C34H54N2O3[M+H]+539.4213,found 539.4206.
(25R)-3α-二乙醇胺乙酰胺基螺甾烷-5-烯(5d)的合成:
白色固体,收率67%,m.p.234~236℃; 1H NMR(CDCl3,400MHz)δ:7.33(brs,1H,N-H),5.39(d,J=7.6Hz,1H,6-H),4.40(q,J=7.2Hz,1H,16-H),4.17(s,1H,3-H),3.63(t,J=4.7Hz,4H,OHCH2-H),3.47(d,J=10.8Hz,1H,26α-H),3.37(t,J=10.9Hz,1H,26β-H),3.30(m,2H,CH2-H),2.74(t,J=4.7Hz,4H,NCH2-H);13C NMR(CDCl3,100MHz)δ:165.73,137.96,137.75,130.60,124.31,119.50,109.20,80.70,77.19,66.79,62.01,56.20,50.57,50.24,45.60,41.57,40.14,39.53,37.43,37.04,34.56,31.85,31.32,30.25,28.77,25.96,20.47,18.74,17.10,16.20,14.51;IR(KBr)ν:3435,3349,2953,1659,1526,1053,984cm-1;HRMS(ESI)calcd for C33H54N2O5[M+H]+559.4111,found 559.4106.
(25R)-3α-羟乙基哌嗪乙酰胺基螺甾烷-5-烯(5e):
重结晶得白色固体5e,收率66%,m.p.202~204℃; 1H NMR(CDCl3,400MHz)δ:7.47(brs,1H,N-H),5.38(s,1H,6-H),4.45~4.37(m,1H,16-H),4.18~4.06(m,1H,3-H),3.62(d,J=4.7Hz,2H,CH2-H),3.46(d,J=10.3Hz,1H,26α-H),3.36(t,J=11.0Hz,1H,26β-H),3.04~2.91(m,2H,OHCH2-H);13C NMR(CDCl3,100MHz)δ:168.88,139.30,122.98,109.30,80.68,77.21,66.82,62.03,61.17,59.39,57.74,56.81,53.35,53.27,51.06,44.85,41.56,40.23,39.80,37.51,37.28,37.28,34.63,32.40,31.76,31.33,31.29,30.23,28.73,26.28,20.53,18.93,17.10,16.26,14.48,0.97;IR(KBr)ν:3367,2957,1672,1526,1058,985cm-1;HRMS(ESI)calcd for C35H57N3O4[M+H]+584.4427,found 584.4421.
(25R)-3α-吗啉乙酰胺基螺甾烷-5-烯(5f)的合成:
将中间体4(0.31g,0.63mmol)溶于吗啉(10mL)中,室温搅拌10h后停止反应。反应液中加入水有固体析出,抽滤、滤饼用水洗涤(5mL×3)、烘干、重结晶得化合物5f(0.30g,88%),m.p.218~220℃; 1H NMR(CDCl3,400MHz)δ:7.48(brs,1H,N-H),5.39(d,J=1.2Hz,1H,6-H),4.43(q,J=7.5Hz,1H,16-H),4.14(s,1H,3-H),3.69(s,4H,吗啉环-H),3.48(d,J=9.0Hz,1H,26α-H),3.38(t,J=10.8Hz,1H,26β-H),2.97(d,J=3.9Hz,2H,CH2-H);13C NMR(CDCl3,100MHz)δ:139.27,13.06,109.23,80.68,77.21,67.18,66.80,62.05,61.60,56.57,53.63,51.09,45.01,41.58,40.21,39.68,37.56,37.26,34.66,32.34,31.78,31.36,30.25,28.77,26.19,20.54,18.94,17.11,16.26,14.51;IR(KBr)ν:3354,2955,2894,1687,1515,1119,1049,905cm-1;HRMS(ESI)calcd for C33H52N2O4[M+H]+541.4005,found 541.4007.
(25R)-3α-四氢吡咯乙酰胺基螺甾烷-5-烯(5g)的合成
依次将中间体4(0.13g,0.26mmol)、CH2Cl2(7mL)、四氢吡咯(0.25mL,3.0mmol)、三乙胺(0.20mL,1.5mmol)加入圆底烧瓶中室温反应,TLC跟踪反应直至反应完全。减压蒸去溶剂,加水析出固体,抽滤、滤饼用水洗涤(5mL×3)、烘干、重结晶得化合物5g(0.10g,77%),m.p.164~167℃; 1H NMR(CDCl3,400MHz)δ:7.45(brs,1H,N-H),5.37(d,J=5.2Hz,1H,6-H),4.41(q,J=7.5Hz,1H,16-H),4.12(t,J=7.1Hz,3H,3-H,CH2-H),3.46(dd,J=3.4Hz,1H,26α-H),3.37(t,J=10.9Hz,1H,26β-H),3.13(q,J=16.2Hz,2H,N-CH2-H);13C NMR(CDCl3,100MHz)δ:138.98,123.13,109.26,80.73,77.19,66.81,62.05,58.35,56.55,54.12,50.79,45.20,41.57,40.21,39.70,37.48,37.22,34.53,32.30,31.79,31.34,30.26,28.76,26.22,23.97,20.54,18.99,17.11,16.26,14.50,0.99;IR(KBr)ν:3356,2949,2868,2795,1688,1515,1057,903,804cm-1;HRMS(ESI)calcd for C33H52N2O3[M+H]+525.4056,found 525.4049.
(25R)-3α-二乙胺乙酰胺基螺甾烷-5-烯(5h)的合成
柱色谱分离得米白色固体5h,收率58%,m.p.173~177℃; 1H NMR(CDCl3,400MHz)δ:7.69(brs,1H,N-H),5.37(d,J=5.2Hz,1H,6-H),4.41(q,J=7.4Hz,1H,16-H),4.12(s,1H,3-H),3.46(d,J=10.7Hz,1H,26α-H),3.37(t,J=10.9Hz,1H,26β-H),2.98(s,2H,N-CH2-H),2.54(dd,J=11.4Hz,4H,N-CH2-H);13C NMR(CDCl3,100MHz)δ:110.0,109.27,80.76,77.18,66.82,62.83,62.06,41.58,40.21,39.71,38.79,37.47,32.18,31.80,31.35,30.27,28.77,26.21,20.55,18.98,17.11,16.26,14.51,0.99,0.05;IR(KBr)ν:3374,2943,1686,1514,1061,905,803cm-1;HRMS(ESI)calcd for C33H54N2O3[M+H]+527.4213,found 527.4224.
(25R)-3α-N-甲基哌嗪乙酰胺基螺甾烷-5-烯(5i)的合成
重结晶得化合物5i,收率68%,m.p.173~177℃; 1H NMR(CDCl3,400MHz)δ:7.50(brs,1H,N-H),5.38(s,1H,6-H),4.42(d,J=7.0Hz,1H,16-H),4.13(s,1H,3-H),3.47(d,J=10.5Hz,1H,26α-H),3.37(t,J=10.9Hz,1H,26β-H),2.98(s,2H,N-CH2-H);13C NMR(CDCl3,100MHz)δ:168.90,139.26,128.03,109.28,、80.70,77.20,66.82,62.04,61.15,56.81,55.56,53.17,51.04,46.07,44.79,41.56,40.23,39.81,37.48,37.31,34.63,32.37,31.77,31.34,31.30,30.24,28.74,26.33,20.55,18.95,17.10,16.27,14.48,0.98;IR(KBr)ν:3357,2950,1687,1513,1462,1053cm-1;HRMS(ESI)calcd for C34H55N3O3[M+H]+554.4322,found 554.4327。
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。
一种薯蓣皂苷元抗肿瘤衍生物及其合成方法专利购买费用说明
![]()
Q:办理专利转让的流程及所需资料
A:专利权人变更需要办理著录项目变更手续,有代理机构的,变更手续应当由代理机构办理。
1:专利变更应当使用专利局统一制作的“著录项目变更申报书”提出。
2:按规定缴纳著录项目变更手续费。
3:同时提交相关证明文件原件。
4:专利权转移的,变更后的专利权人委托新专利代理机构的,应当提交变更后的全体专利申请人签字或者盖章的委托书。
Q:专利著录项目变更费用如何缴交
A:(1)直接到国家知识产权局受理大厅收费窗口缴纳,(2)通过代办处缴纳,(3)通过邮局或者银行汇款,更多缴纳方式
Q:专利转让变更,多久能出结果
A:著录项目变更请求书递交后,一般1-2个月左右就会收到通知,国家知识产权局会下达《转让手续合格通知书》。
动态评分
0.0