IPC分类号 : C07J1/00,C07J31/00,C07J41/00,A61K31/5685,A61K31/568,A61P35/00
专利摘要
本发明属药物化学领域,涉及以雌甾为母核的2位或16位取代的查耳酮衍生物及其制备方法和应用。其制备方法是将查尔酮结构片段骈和在雌甾母体上,保持或增强了抗肿瘤细胞的活性及抑制肿瘤细胞血管生成的活性。具有如下结构通式:???????通式Ⅰ?????????????????????通式Ⅱ经体外抗肿瘤细胞增殖活性试验和鸡胚尿囊膜试验研究证明:该类衍生物具有一定的抗肿瘤细胞增殖活性和抑制肿瘤细胞血管生成的活性,在量效关系研究中,其对肿瘤细胞的抑制作用优于具有广谱抗肿瘤活性的2-甲氧基雌二醇,且半衰期延长。
权利要求
1.以雌甾为母核的2位取代的查耳酮衍生物,其特征在于,该类化合物具有如下结构通式:
通式Ⅰ
所述的通式Ⅰ中的R1为H、F、Cl、Br、CH3、OCH3、OH、CN、NO2、SO2CH3、CF3或OBn中之一,R2为H、F、Cl、Br、CH3、OCH3、OH、CN、NO2、SO2CH3、CF3或OBn中之一;R3为H、F、Cl、Br、CH3、OCH3、OH、CN、NO2、SO2CH3、CF3或OBn中之一;其中所选的R1、R2、R3取代基相同或不同。
2.根据权利要求1所述的以雌甾为母核的2位取代的查耳酮衍生物,其特征在于,选以下化合物:
Ⅰ-1Ⅰ-2Ⅰ-3
Ⅰ-4Ⅰ-5Ⅰ-6
Ⅰ-7Ⅰ-8Ⅰ-9
Ⅰ-10Ⅰ-11Ⅰ-12
Ⅰ-13。
3.以雌甾为母核的16位取代的查耳酮衍生物,其特征在于,该类化合物具有如下结构通式:
通式Ⅱ
所述的通式Ⅱ中的R1为H、F、Cl、Br、CH3、OCH3、OH、CN、NO2、SO2CH3、CF3或OBn中之一,R2为H、F、Cl、Br、CH3、OCH3、OH、CN、NO2、SO2CH3、CF3或OBn中之一;R3为H、F、Cl、Br、CH3、OCH3、OH、CN、NO2、SO2CH3、CF3或OBn中之一;其中所选的R1、R2、R3取代基相同或不同。
4.根据权利要求3所述的以雌甾为母核的16位取代的查耳酮衍生物,其特征在于,选以下化合物:
Ⅱ-1Ⅱ-2Ⅱ-3
Ⅱ-4Ⅱ-5Ⅱ-6
Ⅱ-7Ⅱ-8Ⅱ-9
Ⅱ-10Ⅱ-11。
5.制备如权利要求1或3所述的以雌甾为母核的2位或16位取代的查耳酮衍生物方法,其特征在于,制备步骤如下:
将雌甾母体溶解在溶剂中,搅拌下加入路易斯碱的水溶液至固体全部溶解,然后慢慢滴加苯甲醛或取代苯甲醛,滴加完后控制反应温度,20~60℃反应,薄层检测至反应完全,停止加热;后处理:待反应温度降低后,加水稀释,调pH值到4~6,得到固体,抽滤,通过重结晶或柱层析进行分离纯化,得到产品;
其中所述的雌甾母体和取代芳香醛的配料摩尔比选1:1~1:2.0;
路易斯碱选质量百分比5%~10%的氢氧化钠、氢氧化钾、碳酸钠、碳酸钾、碳酸氢钠、碳酸氢钾之一的水溶液;
所述溶剂选甲醇、乙醇、丙醇、丁醇、甲苯、四氢呋喃、二氯甲烷、N,N-二甲基甲酰胺、N,N-二甲基乙酰胺、二氧六环、水中的一种或两种;
所述的雌甾母体具有如下分子结构通式:
或
AB
雌甾母体中的R4、R5各自为氢原子、乙酰基、苄基、甲氧基亚甲基或四氢吡喃基;R4、R5同时相同或不同;
所述的取代苯甲醛为一取代、二取代或三取代的苯甲醛,取代基为F、Cl、Br、CH3、OCH3、OH、CN、NO2、SO2CH3、CF3或OBn,多取代的取代基相同或不同。
6.如权利要求1~4其中之一所述的以雌甾为母核的2位或16位取代的查耳酮衍生物在药物制备中的应用,其特征在于,将其作为活性成分或与其他药物组合,与药物中可以接受的辅助和/或添加成分混合后,按常规制药方法和工艺,制成用于抗肿瘤的药物制剂。
7.如权利要求1~4其中之一所述的以雌甾为母核的2位或16位取代的查耳酮衍生物在药物制备中的应用,其特征在于,将其作为活性成分或与其他药物组合,与药物中可以接受的辅助和/或添加成分混合后,按常规制药方法和工艺,制成与血管新生相关的疾病治疗药物。
说明书
技术领域
本发明涉及药物化学领域,主要涉及一类以雌甾为母核的2位或16位取代的查耳酮衍生物及其制备方法和用途。
背景技术
血管新生(angiogenesis)是指在原来存在的血管结构基础上通过血管内皮细胞(VEC)的增殖和迁移,从先前存在的血管处以芽生或非芽生(或称套迭)的形成生成新的毛细血管(capillaries)的过程,也称之为血管生成。血管新生是胚胎发育、伤口愈合、组织再生和修复所必需的生理变化,但同时也是多种全身和局部疾病的病理基础。血管新生涉及一个复杂的多步骤过程,包括血管内皮细胞的增殖、迁移、侵蚀及管腔形成等。血管新生过程受到血管新生诱导因子和抑制因子的严格调控,正常情况下血管新生诱导因子与抑制因子处于动态平衡(即Hanahen等提出的调控血管平衡的开关系统)。人体内存在多种血管新生诱导因子(如血管内皮细胞生长因子(VEGF)、碱性成纤维细胞生长因子(bFGF)、促血管生成素-1(Ang-1)、血管生成素(angiogenin)等)和多种血管新生抑制因子(如血管新生抑制素(angiostatin)、内皮细胞抑制素(endostatin)、促血管生成素-2(angiopoietin-2)、组织金属蛋白酶抑制剂(TIMPS)、血小板反应蛋白-1(TSP-1)、迁移抑制因子(MIG)、血小板因子-4(PF-4)等([1]金惠铭,李先涛.“血管新生的调控”《中国微循环,》2001,5(2):85-88))。如果这种平衡被打破即可启动血管生成的细胞信号,从而导致病理性新生血管发生。例如,肿瘤、糖尿病视网膜黄斑病变、风湿性关节炎、血管瘤、牛皮癣、类风湿性关节炎等是常见的血管异常增生引起的疾病。而冠心病、心肌梗死、脑梗塞、血管闭塞性血栓性脉管炎等新血管疾病则是由于血管新生受到抑制而引发的缺血性疾病([2]金惠铭,李先涛.“血管新生与疾病”《中国微循环》,2001,5(3):173-177)。
自20世纪70年代Folkman首先提出血管生成理论至今,人们对血管形成的机制己经取得了较大进展。目前,以肿瘤血管生成为靶点,开发血管生成抑制剂在抗肿瘤研究中是一个十分活跃的研究领域,目前大约有30多种抗血管生成新药处于临床研究阶段([3]阎锡蕴.“血管生成及靶向治疗”,《医学分子生物学杂志》,2006,3(5):323-330)。其中,大多数都属于抗癌药。此外,还有许多新药尚处于临床前评价阶段([4]周峰,朱驹,吕加国等,“具新生血管抑制及血管阻断双重作用的肿瘤血管靶向药物研究进展”,《药学进展》,2013,37(1):17-23)。而促血管生成疗法(therapeuticangiogenesis)也称治疗性血管新生是近年来用于缺血性疾病的新策略,其研究刚处于起步阶段,1997年第一个通过FDA批准的促血管生成药物上市,重组人血小板源生长因子-BB(rhPDGF-BB,商品名Regranex)已用于治疗糖尿病造成的足部溃疡([5]FutregaK.,KingM.,LottW.B.,etal.“Treatingthewholenotthehole:necessarycouplingoftechnologiesfordiabeticfootulcertreatment”《TrendsMol.Med.》,2014,20(3):137-142)。
本发明人在多年来研究2-甲氧基雌二醇(2-ME)抗肿瘤活性的构效关系中发现一个有趣的现象:雌二醇(E2)、雌酚酮(E1)具有雌激素活性,同时雌二醇(E2)具有促进血管生成的活性,其代谢产物雌三醇(E3)和16α-羟基雌酚酮(16αOH-E1)具有较弱的雌激素活性,同样也具有促有丝分裂、促炎症、和促进新生血管生成的作用([6]赵晓辉,吴楠,尹扬光等,“雌二醇调控小鼠内皮祖细胞凋亡及体外血管新生研究”,《第三军医大学学报》2010,32(13):1399-1402;[7]ArdeltA.A.,CarpenterR.S.,LoboM.R.,etal.Estradiolmodulatespost-ischemiccerebralvascularremodelingandimproveslong-termfunctionaloutcomeinaratmodelofstroke.BrainRes.,2012,1461:76-86;[8]刘伟强,陈玉成,熊素彬等,“心肌内注射17β-雌二醇纳米粒的促血管生成效应及相关机制研究”,《心脏杂志》2008,20(1):17-20;[9]GM.Rubanyi,AJohnsb,KKauser,“Effectofestrogenonendothelialfunctionandangiogenesis“,《Vasc.Pharmacol》,2002,38:89-98)。而其代谢产物2-甲氧基雌二醇(2-ME)却没有雌激素活性,具有抗细胞有丝分裂、抗炎、抗血管生成的作用([10]VerenichS.,GerkP.M.,“Therapeuticpromisesof2-methoxyestradiolanditsdrugdispositionchallenged”,《Mol.Pharm》2010,7(6):2030–2039;[11]QuezadaM.,AlvarezM., O.A.,etal.“Antiangiogenic,antimigratoryandantiinflammatoryeffectsof2-methoxyestradiolinzebrafishlarvae”,《Compar.Biochem.Physio.PartC》2013,157:141-149;[12]GBasini,SBussolati,SESantinia,etal.“Antiangiogenesisinswineovarianfollicle:Apotentialrolefor2-methoxyestradiol,《Steroids》2007,72:660–665)。
2-甲氧基雌二醇(2-ME)是雌二醇在体内经细胞色素P450(CYPs)、儿茶酚-O-甲基化转移酶(COMT)作用下的代谢产物,2-ME对雌激素受体的亲和力较弱([13]PribludaV.S.,GubishE.R.Jr,LavalleeT.M.,etal.“2-Methoxyestradiol:anendogenousantiangiogenicandantiproliferativedrugcandidate”《CancerMetastRev.》,2000,19:173-200),研究发现2-ME通过抑制微管蛋白聚合,促进p53蛋白的表达,抑制核转录因子NF-κB,抑制细胞内重要的抗凋亡基因Bcl-2蛋白的表达,抑制血管内皮生长因子(VEGF)和低氧诱导因子(HIF-1)等途径实现抗肿瘤细胞增殖,诱导细胞凋亡和血管新生等作用([14]GongQ.,LiuE.,XinR.,etal.“2MEand2OHE2exhibitgrowthinhibitoryeffectsandcellcyclearrestatG2/MinRL95-2humanendometrialcancercellsthroughactivationofp53andChk1”,《Mol.Cell.Biochem.》,2011,352(1-2):221-230;[15]WilczynskiJ.,DuechlerM.,CzyzM.“TargetingNF-κBandHIF-1pathwaysforthetreatmentofcancer:partII”,《Arch.Immunol.Ther.Exp.》,2011,59(4):301-307;[16]LeeS.T.,LeeJ.Y.,HanC.R.,etal.“Dependencyof2-methoxyestradiol-inducedmitochondrialapoptosisonmitoticspindlenetworkimpairmentandprometaphasearrestinhumanJurkatTcells”,《Biochem.Pharmacol》,2015,94(4),:257-269]。该药只作用于活跃增殖期的细胞,对静止期的细胞无作用,有相对较高的特异性,其独特的的抗肿瘤机制,使得2-ME相比于常规的抗肿瘤药物,具有低毒性、高效性、靶向性、不易产生耐药性、不良反应少等特点。EntreMed公司开发的2-ME( )对乳腺癌、前列腺癌、卵巢癌及多发性骨髓瘤的研究,已分别进入Ⅰ、Ⅱ期临床阶段([17]MateiD.,SchilderJ.,SuttonG.,etal.“Activityof2methoxyestradiol( NCD)inadvanced,platinum-resistantovariancancerandprimaryperitonealcarcinomatosis:AHoosierOncologyGrouptrial”,《Gynecol.Oncol.》,2009,115(1):90-96;[18]SweeneyC.,LiuG.,YiannoutsosC.,etal.“AphaseIImulticenter,randomized,double-blind,safetytrialassessingthepharmacokinetics,pharmacodynamics,andefficacyoforal2-methoxyestradiolcapsulesinhormone-refractoryprostatecancer”,《Clin.CancerRes.》,2005,11(18):6625-6633;[19]BruceJ.Y.,EickhoffJ.,PiliR.,etal.“AphaseIIstudyof2-methoxyestradiolnanocrystalcolloidaldispersionaloneandincombinationwithsunitinibmalateinpatientswithmetastaticrenalcellcarcinomaprogressingonsunitinibmalate”,《Invest.NewDrug》,2012,30(2):794-802),ElanPharma公司将2-ME配制成纳米口服液,用于治疗风湿性关节炎已进入Ⅰ期临床试验([20]StubeliusA.,AndréassonbE.,KarlssonbA.,etal.,“Roleof2-methoxyestradiolasinhibitorofarthritisandosteoporosisinamodelofpostmenopausalrheumatoidarthritis”,《Clin.Immunol》2011,140,37-46)。然而,2-ME存在水溶性差,半衰期短(~20min)等缺点,并且在体内快速代谢而很难达到有效的体内血药浓度,生物利用度很低([21]StanderB.A.,MaraisS.,VorsterC.J.J.,etal.“Invitroeffectsof2-methoxyestradiolonmorphology,cellcycleprogression,celldeathandgeneexpressionchangesinthetumorigenicMCF-7breastepithelialcellline.”,《J.SteroidBiochem》,2010,119(3):149-160)。
以2-ME为先导化合物,对其进行结构修饰,期望得到一种溶解度高,靶向性强,生物利用度好的前体药物,成为国内外研发新药的热点。也成为解决2-ME低溶解度,低生物利用度问题的一种有效途径。通过构效关系研究发现,若在母核A环上进行结构修饰,3-OH成氨基磺酸酯后,抗肿瘤活性增强。C2被烷氧基取代,2-乙氧基雌二醇显示了较高的抑制微管蛋白和抗肿瘤活性。对B环和C环的结构修饰虽然发现部分化合物有较好活性,但总体上通常会降低对肿瘤细胞的抑制作用。对D环结构修饰,通常是对17羟基或是羰基进行结构修饰。如ENMD-1198和STX140已进入临床研究阶段([22]PasquierE,SinnappanS,MunozMA,etal.ENMD-1198,“anewanalogueof2-methoxyestradiol,displaysbothantiangiogenicandvascular-disruptingproperties.”,《Mol.CancerTher.》,2010,9(5):1408-1418;[23]Meyer-LosicF.,NewmanS.P.,DayJ.M.,etal.“STX140,butNotPaclitaxel,InhibitsMammaryTumourInitiationandProgressioninC3(1)/SV40T/t-AntigenTransgenicMice”,《PloSone》,2013,8(12):e80305)。
查尔酮类化合物为广泛存在于天然药物中的一种黄酮类化合物,其具有一定的抗肿瘤、抗病毒、抗寄生虫、抗炎和抗菌等生物活性([24]“Synthesisantimicrobialandantioxidantstudiesofnewoximesofsteroidalchalcones”,LoneI.H.,KhanK.Z.,FozdarB.I.etal.《Steroids》2013,78:945–950;[25]CabreraM.,SimoensM.,FalchiG.,etal.,“Syntheticchalcones,flavanones,andflavonesasantitumoralagents:Biologicalevaluationandstructure–activityrelationships”,《Bioorg.Med.Chem.》2007,15:3356–3367)。而以2-ME为母核,在其2位或16位上引入查尔酮的结构片段很少见有报道。因此,本发明以雌甾烷为母核,在其2位或16位上引入查尔酮的结构片段,期望得到毒性较小、口服易吸收、靶向性更强的新型抗肿瘤药物。
发明内容
针对上述情况,本发明的目的在于提供一种具有较好抗肿瘤活性的新型雌甾衍生物,即以雌甾为母核的2位或16位取代的查耳酮衍生物,并提供其制备方法和在抗肿瘤药物方面的应用。
为实现本发明目的,技术方案如下:
所述以雌甾为母核的2位或16位取代的查耳酮衍生物是以雌甾母体和芳香醛为原料经克莱森-斯密特(Claisen-Schimidt)反应制得。其分子结构通式为:
所述的通式Ⅰ和通式Ⅱ中的R1可为H、F、Cl、Br、CH3、OCH3、OH、CN、NO2、SO2CH3、CF3或OBn中之一,R2可为H、F、Cl、Br、CH3、OCH3、OH、CN、NO2、SO2CH3、CF3或OBn中之一;R3可为H、F、Cl、Br、CH3、OCH3、OH、CN、NO2、SO2CH3、CF3或OBn中之一;其中所选的R1、R2、R3的取代基可以相同也可以不同。
其中,通式Ⅰ为以雌甾为母核的2位取代的查耳酮衍生物(系列Ⅰ),优选以下化合物:
(1)2-苯丙烯酰基雌二醇(Ⅰ-1)
(2)2-(3’,4’,5’-三甲氧基苯丙烯酰基)雌二醇(Ⅰ-2)
(3)2-(3’,5’-二氯苯丙烯酰基)雌二醇(Ⅰ-3)
(4)2-(2’-甲氧基苯丙烯酰基)-雌二醇(Ⅰ-4)
(5)2-(3’-甲氧基苯丙烯酰基)-雌二醇(Ⅰ-5)
(6)2-(4’-甲氧基苯丙烯酰基)-雌二醇(Ⅰ-6)
(7)2-(2’-氯苯丙烯酰基)-雌二醇(Ⅰ-7)
(8)2-(3’-氯苯丙烯酰基)-雌二醇(Ⅰ-8)
(9)2-(4’-氯苯丙烯酰基)-雌二醇(Ⅰ-9)
(10)2-(3’-甲氧基-4’-苄氧基苯丙烯酰基)-雌二醇(Ⅰ-10)
(11)2-(3’-苄氧基-4’-甲氧基苯丙烯酰基)-雌二醇(Ⅰ-11)
(12)2-(2’,3’-二甲氧基苯丙烯酰基)-雌二醇(Ⅰ-12)
(13)2-(4’-苄氧基苯丙烯酰基)-雌二醇(Ⅰ-13)
其中,通式II为以雌甾为母核的16位取代的查耳酮衍生物(系列Ⅱ),优选以下化合物:
(1)2-甲氧基-16-苯亚甲基雌酚酮(Ⅱ-1)
(2)2-甲氧基-16-(4’-氟苯亚甲基)雌酚酮(Ⅱ-2)
(3)2-甲氧基--16-(4’-氯苯亚甲基)雌酚酮(Ⅱ-3)
(4)2-甲氧基-16-(4’-溴苯亚甲基)雌酚酮(Ⅱ-4)
(5)2-甲氧基-16-(4’-甲基苯亚甲基)雌酚酮(Ⅱ-5)
(6)2-甲氧基-16-(4’-甲砜基苯亚甲基)雌酚酮(Ⅱ-6)
(7)2-甲氧基-16-(3’-氯苯亚甲基)雌酚酮(Ⅱ-7)
(8)2-甲氧基-16-(3’-硝基苯亚甲基)雌酚酮(Ⅱ-8)
(9)2-甲氧基-16-(3’,5’-二氟苯亚甲基)雌酚酮(Ⅱ-9)
(10)2-甲氧基-16-(3’,5’-二氯苯亚甲基)雌酚酮(Ⅱ-10)
(11)2-甲氧基-16-(3’,4’,5’-三甲氧基苯亚甲基)雌酚酮(Ⅱ-11)
本发明所述以雌甾为母核的2位或16位取代的查耳酮衍生物,其制备步骤如下:
将雌甾母体溶解在溶剂中,搅拌下加入路易斯碱的水溶液至固体全部溶解,然后慢慢滴加苯甲醛或取代苯甲醛,滴加完后控制反应温度,20~60℃反应,薄层检测至反应完全,停止加热。后处理:待反应温度降低后,加水稀释,调pH值到4~6,得到白色或黄色固体,抽滤,粗产品可以通过重结晶或柱层析进行分离纯化,得到产品。
其中所述的雌甾母体和取代苯甲醛的配料摩尔比可选1:1~1:2.0;优选1:2~1:1.6
路易斯碱优选质量百分比5%~10%的氢氧化钠、氢氧化钾、碳酸钠、碳酸钾、碳酸氢钠、碳酸氢钾之一的水溶液。
反应温度可选0~80℃,优选20~60℃;
反应溶剂可选甲醇、乙醇、丙醇、丁醇、甲苯、四氢呋喃、二氯甲烷、N,N-二甲基甲酰胺、N,N-二甲基乙酰胺、二氧六环、水中的的一种或两种,优选乙醇、甲醇或水。
重结晶溶剂优选甲醇、乙醇。
所述的雌甾母体具有如下分子结构通式:
雌甾母体中的R4、R5可为氢原子或常见的酚羟基、羟基的保护基,R4、R5可以相同,也可以不同。其中R4可优先氢原子(H)、乙酰基(Ac)、苄基(Bn)、甲氧基亚甲基(MOM)、或四氢吡喃基(THP)中之一;R5优先氢原子(H)、乙酰基(Ac)、苄基(Bn)、甲氧基亚甲基(MOM)、或四氢吡喃基(THP)中之一;
所述的取代苯甲醛为一取代、二取代或三取代的苯甲醛,取代基为F、Cl、Br、CH3、OCH3、OH、CN、NO2、SO2CH3、CF3或OBn,多取代基可以相同,也可以不同。
所述的取代苯甲醛优选苯甲醛、2-氟苯甲醛、3-氟苯甲醛、4-氟苯甲醛、2,4-二氟苯甲醛、3,5-二氟苯甲醛、2-氯苯甲醛、3-氯苯甲醛、4-氯苯甲醛、2,4-二氯苯甲醛、3,5-二氯苯甲醛、2-溴苯甲醛、3-溴苯甲醛、4-溴苯甲醛、2,4-二溴苯甲醛、3,5-二溴苯甲醛、3-溴-6-羟基苯甲醛、2-甲基苯甲醛、3-甲基苯甲醛、4-甲基苯甲醛、2-(三氟甲基)苯甲醛、3-(三氟甲基)苯甲醛、4-(三氟甲基)苯甲醛、2-氰基苯甲醛、3-氰基苯甲醛、4-氰基苯甲醛、2-硝基苯甲醛、3-硝基苯甲醛、4-硝基苯甲醛、4-(N,N-二甲基)苯甲醛、2-甲氧基苯甲醛、3-甲氧基苯甲醛、4-甲氧基苯甲醛、2,4-二甲氧基苯甲醛、3,5-二甲氧基苯甲醛、3,4,5-三甲氧基苯甲醛、4-对甲砜基苯甲醛、3-甲氧基-4-羟基苯甲醛、3-羟基-4-甲氧基苯甲醛、3-甲氧基-4-苄氧基苯甲醛或3-苄氧基-4-甲氧基苯甲醛中之一。
其中所述的用于制备系列Ⅰ化合物的雌甾母体优选2-乙酰基雌二醇(A1)、2-乙酰基雌二醇-17β-乙酯(A2)、2-乙酰基雌二醇-3,17β-二乙酯(A3)、2-乙酰基-3-苄氧基雌二醇-17β-乙酯(A4)、2-乙酰基-3-甲氧基亚甲基氧雌二醇-17β-乙酯(A5)、2-乙酰基雌二醇-3,17β-二苄氧基醚(A6)、2-乙酰基雌二醇-3,17β-二甲氧基亚甲醚(A7)、2-乙酰基雌二醇-3,17β-二四氢吡喃醚(A8);制备系列Ⅰ化合物,最优选的雌甾母体为A1、A2、A3。
其中所述的用于制备系列Ⅱ化合物的雌甾母体优选2-甲氧基雌酚酮(B1)、2-甲氧基-3-乙酰氧基雌酚酮(B2)、2-甲氧基-3-苄氧基雌酚酮(B3)、2-乙氧基-3-甲氧基亚甲基氧基雌酚酮(B4)、2-甲氧基-3-四氢吡喃氧基雌酚酮(B5);制备系列Ⅱ化合物,最优选的雌甾母体为B1、B2。
其中,本发明优选的用于制备系列Ⅰ化合物的雌甾母体可以通过以下方法制备得到:
方法一:以雌二醇为原料,先对3位和17位的羟基进行乙酰基保护,然后经Fies重排在2位上引入乙酰基得到化合物A2,A2经碱水解得到化合物A1,或A2乙酰化得到A3,或A2在Lewis碱作用在3位上引入烷基,得到化合物A4和A5。
方法二:以雌二醇为原料,先在3位上引入烷基(甲基或乙基),然后对17位羟基进行乙酰基保护,经F-C酰基化反应在2-位上引入乙酰基得到化合物,然后再脱掉3位上甲基得到化合物A2。
方法三:以雌二醇为原料,先经F-C酰基化反应在2-位上引入乙酰基得到化合物A1,然后再对3位、17位上羟基进行乙酰基保护得到化合物A3;苄氧基保护得到A6;甲氧基亚甲基醚保护得到A7;四氢吡喃醚保护得到A8。
本发明优选的用于制备系列Ⅱ化合物的雌甾母体可以通过以下方法制备得到:
方法一:以2-甲氧基雌二醇为原料,先将3位羟基进行酰化保护,然后对17位羟基进行Jones氧化得到化合物B2,经水解制得化合物B1。以B1为原料再经3位烷基化引入苄氧基得到化合物B3,引入甲氧基亚甲基氧基得到B4,引入四氢吡喃醚得到B5。
方法二:以2-甲氧基雌二醇为原料,环己酮(或丙酮)为氧化剂,异丙醇铝(或叔丁醇铝)为催化剂进行Oppenauer氧化得到化合物B1,然后3位进行乙酰化得到B2,3位经烷基化分别得到化合物B3、B4、B5。
方法三:以雌二醇为原料,经乙酰化、Fries重排反应、苄基保护、间氯过氧苯甲酸氧化、水解、2-位甲氧基化制得2-甲氧基-3-苄氧基雌二醇,然后经Jones氧化制得B3。
方法四:以雌酚酮为原料,在甲苯磺酸(p-TsOH)催化下,用乙二醇(ethyleneglycol)保护17位羰基,甲氧基氯甲醚或2,3-二氢吡喃保护3位羟基,在低温-78℃下用异丁基锂拔2位H,在DMF存在下发生Vilsmeier反应形成甲酰基,然后用间氯过氧苯甲酸氧化,水解在2位上引入羟基,然后经2-位甲氧基化,最后在Lewis酸存在下脱保护得到化合物B1。
最后,分别以不同结构的雌甾母体和不同结构的取代芳香醛为原料进行克莱森-斯密特(Claisen-Schimidt)缩合反应,可制得系列Ⅰ和系列Ⅱ的雌甾母核的2位或16位取代的查耳酮衍生物。
通式I、II所述的其它化合物的合成方法同上。
经体外抗肿瘤细胞增殖活性试验和鸡胚尿囊膜试验研究证明:本发明以雌甾为母核的2位或16位取代的查耳酮衍生物具有一定的抗肿瘤细胞增殖活性和抑制肿瘤细胞血管生成的活性,在量效关系研究中,其对肿瘤细胞的抑制作用优于具有广谱抗肿瘤活性的2-甲氧基雌二醇,且半衰期延长。
本发明合成的雌甾为母核的2位或16位取代的查耳酮衍生物可作为活性成分或与其他药物组合,与药物中可以接受的辅助和/或添加成分混合后,按常规制药方法和工艺,制成用于抗肿瘤的药物制剂或用于与血管新生相关的疾病治疗。
附图说明
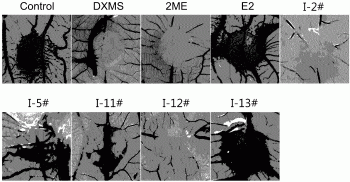
图1为本发明系列Ⅰ化合物对血管生成作用的照片,图中,Control-不加药,DXMS-地塞米松对照组,2ME-2-甲氧基雌二醇,E2-雌二醇,I-2#-化合物Ⅰ-2,I-5#-化合物Ⅰ-5,I-11#-化合物Ⅰ-11,I-12#-化合物Ⅰ-12,I-13#-化合物Ⅰ-13;
图2为本发明系列Ⅰ化合物对血管面积和血管数的影响,图中,Control-不加药,DXMS-地塞米松对照组,2ME-2-甲氧基雌二醇,E2-雌二醇,I-2#-化合物Ⅰ-2,I-5#-化合物Ⅰ-5,I-11#-化合物Ⅰ-11,I-12#-化合物Ⅰ-12,I-13#-化合物Ⅰ-13;
图3为本发明系列II化合物对血管生成作用的照片,图中,Control-不加药,DXMS-地塞米松对照组,2ME-2-甲氧基雌二醇,E2-雌二醇,II-2#-化合物Ⅱ-2,II-3#-化合物Ⅱ-3,II-4#-化合物Ⅱ-4,II-6#-化合物Ⅱ-6,I-7#-化合物Ⅱ-7,II-11#-化合物Ⅱ-11;
图4为本发明系列II化合物对血管面积和血管数的影响,图中,Control-不加药,DXMS-地塞米松对照组,2ME-2-甲氧基雌二醇,E2-雌二醇,II-2#-化合物Ⅱ-2,II-3#-化合物Ⅱ-3,II-4#-化合物Ⅱ-4,II-6#-化合物Ⅱ-6,I-7#-化合物Ⅱ-7,II-11#-化合物Ⅱ-11。
图5为本发明化合物Ⅰ-2、Ⅱ-3给药后的药时曲线,图中,2-ME-2-甲氧基雌二醇,Ⅰ-2#-化合物Ⅰ-2,II-3#-化合物Ⅱ-3。
具体实施方式
以下结合实施例对本发明的具体实施方式做详细说明,以下所加物质的百分含量均为质量百分含量。
实施例1系列Ⅰ雌甾母核原料的制备
(1)2-乙酰基雌二醇-17β-乙酯(A2)的制备
参考文献Steroids,2002,67:1065–1070方法,称取雌二醇30.0g(111.65mmol)转移至1000ml圆底烧瓶中,加入300ml无水吡啶,充分搅拌溶解后,在氮气保护下,缓慢加入75ml(396.7mmol)醋酸酐,避光条件下室温搅拌。经过15小时后,反应基本完成,为保证完全反应继续搅拌1h检测无明显变化,确定反应完全。处理:将反应混合物冰浴下搅拌冷却后,快速倾倒入盛有大量冰水的容器中,继续搅拌有白色絮状沉淀析出,静置30min,真空抽滤,滤饼用水洗至无吡啶味为止,真空干燥,用甲醇中进行重结晶得到白色晶体37.6g。收率为95.5%。
在氮气保护下,称取双乙酰化中间体10.6g(29.7mmol)溶解在500ml二氯甲烷溶剂中,在剧烈搅拌下快速加入四氯化锆固体38g(163.1mmol)。反应液在室温下,避光搅拌48h。棕色的反应液在冰浴中冷却后搅拌下缓慢加入冰水(100ml),搅拌一小时,分层后,有机相用水萃取两次,水相用二氯甲烷萃取一次,合并有机相,饱和食盐水洗涤1次。有机相加入无水硫酸镁干燥,抽滤,液体旋转蒸发浓缩得黄色粘稠物。用甲醇重结晶得到化合物2-乙酰基雌二醇-17β-乙酯(A2)黄色固体8.6g,收率为81.8%。1HNMR(400MHz,CDCl3)δ(ppm):12.04(s,1H),7.59(S,1H),6.69(s,1H),4.70(dd,J1=9.3Hz,J2=7.5Hz,1H),2.60(s,3H),2.07(s,3H,17-OAc),0.84(s,3H)。
(2)2-乙酰基雌二醇(A1)的制备
方法一:参考文献Steroids,2002,67,1079-1089
称取2-乙酰基雌二醇-17β-乙酯(A2,3g,8.42mmol)置于100ml三颈烧瓶中,加入20ml无水甲醇使其溶解,再用恒压滴液漏斗加入20%氢氧化钠溶液1500ml,室温搅拌10h。后处理:将反应液用100ml冰水稀释,用乙酸乙酯(3*150ml)萃取,随后用蒸馏水(100ml)和饱和食盐水(100ml)洗涤。浓缩液用甲醇重结晶得2-乙酰基雌二醇(A1)白色固体2.1g,收率为78%。1HNMR(400MHz,CDCl3)δ(ppm):12.02(s,1H),7.61(s,1H),6.69(s,1H),3.75(t,J=8.4Hz,1H),2.87(m,2H),2.60(s,3H),0.80(s,3H)。
方法二:参考文献J.Med.Chem.2004,47,5126-5139以雌二醇为原料,先经F-C酰基化反应在2-位上引入乙酰基,然后水解得到化合物A1。
(3)2-乙酰基雌二醇-3,17β-二乙酯(A3)的制备
参考文献J.Med.Chem.2004,47,5126-5139方法,取2-乙酰基雌二醇(A1,3g,9.55mmol)置于250ml三颈烧瓶中,加入吡啶(60ml),酸酐(20ml),室温反应15~20小时。处理:将反应混合物快速倾倒入盛有1000ml冰水的容器中,继续搅拌有白色絮状沉淀析出,静置30min,真空抽滤,滤饼用水洗至无吡啶味为止,真空干燥,用甲醇中进行重结晶得到白色晶体3.27g。收率为86%。1HNMR(400MHz,CDCl3)δ(ppm):7.74(s,1H),6.81(s,1H),4.70(t,J=16.92Hz,1H),2.90(m,2H),2.53(s,3H),2.26(m,4H),2.07(s,3H),2.05(s,3H),1.93-1.24(m,11H),0.84(s,1H)。
实施例2系列Ⅱ雌甾母核原料的制备
(1)2-甲氧基雌二醇(2-ME)的制备
2-甲氧基雌二醇(2-ME)可以参考文献Steroids,2002,67:1065–1070方法制备得到。
(2)2-甲氧基-3-乙酰氧基雌酚酮(B2)的制备
参考文献Steroids,2008,73,171-183方法,取2-甲氧基雌二醇(3g,0.01mol),溶于异丙醇100ml中,加氢氧化钠(1.2g,3eq.)水溶液20ml至全溶,再滴加醋酐3ml(3eq.),室温搅拌。反应约3h后,TLC检测原料反应完全,展开剂为丙酮/石油醚(1:3)。后处理:慢慢滴加甲醇猝灭反应,浓缩溶剂,加稀盐酸,用二氯甲烷萃取三次,合并有机相,再依次用水、饱和碳酸氢钠、饱和食盐水各洗一次。无水硫酸钠干燥,抽滤,浓缩,得2-甲氧基-3-乙酰氧基雌二醇白色固体3.28g,收率95.35%。1HNMR(400MHz,CDCl3)δ6.92(s,1H),6.76(s,1H),3.82(s,3H),3.75(t,J=8.3Hz,1H,17-αH),2.79(m,2H),2.33(s,3H),2.10-2.30(m,3H),1.97-2.0(m,1H),1.96-2.0(m,1H),1.20-1.76(m,9H),0.81(s,3H)。
取2-甲氧基-3-乙酰氧基雌二醇(2g,5.81mmol)在常温下溶于100ml丙酮中,溶解后改为冰浴,冰浴条件下,慢慢滴加新制的Jones试剂,随着反应的进行,体系颜色逐渐变化,由无色变为深黄色,随后又变为淡黄色,反应30min后溶液呈现浅绿色且体系中出现墨绿色不容物。TLC检测原料反应完全。后处理:加异丙醇猝灭反应,再加水稀释,用二氯甲烷萃取三次,合并有机相,依次用水、饱和食盐水各洗一次。无水硫酸钠干燥,抽滤,蒸干溶剂,粗品用甲醇重结晶,得到2-甲氧基-3-乙酰氧基雌酚酮(B2)白色晶体1.83g,收率91.4%。1HNMR(400MHz,CDCl3)δ6.91(s,1H),6.78(s,1H),3.83(s,3H),2.85(dd,J=9.8,5.0Hz,2H),2.58-2.49(m,1H),2.44-2.38(m,1H),2.34(s,3H),2.23-1.97(m,4H),1.71-1.38(m,7H),0.94(s,3H)。
(3)2-甲氧基雌酚酮(B1)的制备
取化合物2-甲氧基-3-乙酰氧基雌酚酮(B2,5g,14.6mmol)溶于100ml甲醇中,油浴加热到60℃,待化合物完全溶解后,慢慢滴加新鲜配制的10%NaOH水溶液,用薄层板随时监测反应的进行,至反应完全。后处理:浓缩溶剂,然后将溶液置于冰浴下搅拌,慢慢滴加10%盐酸水溶液至PH=2-3,有大量白色粉末析出,抽滤,干燥,得2-甲氧基雌酚酮(B1)3.8g,收率87%。1HNMR(400MHz,CDCl3)δ6.79(s,1H),6.56(s,1H),5.62(s,1H),3.86(s,3H),2.87(m,2H),2.72-1.55(m,18H),0.91(s,3H)。
也可参考文献J.Med.Chem.2004,47,5126-5139方法制备得到B1。
实施例32-苯丙烯酰基雌二醇(Ⅰ-1)的制备
将2-乙酰基雌二醇-17β-乙酯(A2,200mg,0.562mmol)溶解在5ml95%乙醇溶液中,加入5ml10%氢氧化钠水溶液,置于搅拌器上搅拌至溶解;常温下逐滴滴入5ml苯甲醛(69.17mg,1.2eq)的95%的乙醇溶液,体系变成橘红色,滴加完之后转移至45℃的油浴之中,回流四个小时后,薄层检测,展开剂为乙酸乙酯:石油醚=1:2,反应完全。停止加热,待温度降低后冰浴下加入10%的盐酸,调PH到5左右,抽滤,用乙酸乙酯:石油醚=1:3过柱,得化合物2-苯丙烯酰基雌二醇(Ⅰ-1)黄色粉末183mg,收率为83%。1HNMR(400MHz,CDCl3)δ12.60(s,1H),7.90(d,J=15.5HZ,1H),7.79(s,1H),7.67(dd,J=6.5,3.1Hz,2H),7.63(d,J=15.5Hz,1H),7.45(m,3H),6.75(s,1H),3.76(m,1H),2.91(m,2H),2.40(m,1H),2.10-2.24(m,2H),0.81(s,3H)。
实施例42-(3’,4’,5’-三甲氧基苯丙烯酰基)雌二醇(Ⅰ-2)的制备
将2-乙酰基雌二醇(A1,177mg,0.562mmol)溶解在10ml95%乙醇溶液中,置于搅拌器上搅拌,加入5ml8%氢氧化钠水溶液搅拌至溶解,然后慢慢滴入10ml3,4,5-三甲氧基苯甲醛(132.3mg,1.2eq)的95%乙醇溶液,体系变成橘黄色,滴加完之后转移至60℃的油浴之中,回流两个小时后,薄层检测,展开剂为乙酸乙酯:石油醚=1:2,反应完全。停止加热,待温度降低后冰浴下加入10%的盐酸,调PH到5左右,抽滤,用乙酸乙酯:石油醚=1:3过柱。得化合物2-(3’,4’,5’-三甲氧基苯丙烯酰基)雌二醇(Ⅰ-2)黄色粉末235mg,收率为85%。1HNMR(400MHz,CDCl3)δ12.58(s,1H),7.81(d,J=15.4Hz,1H),7.76(s,1H),7.47(d,J=15.4Hz,1H),6.88(s,2H),6.75(s,1H),3.93(d,J=9.8Hz,9H),3.76(m,1H),2.88(m,2H),0.81(s,3H)。
实施例52-(3’-甲氧基-4’-苄氧基苯丙烯酰基)-雌二醇(Ⅰ-10)的制备
取香草醛(200mg,1.32mmol),用5mlDMF溶解,加入1.1eq的碳酸钾,待体系升温至60℃之后,加入1.1eq的苄氯,反应三小时,点板,反应完全,等体系温度降低后,冰浴,加入纯水搅拌,抽滤,干燥,得4-苄基香草醛293mg,收率为92%。
将2-乙酰基雌二醇-3,17β-二乙酯(A3,224mg,0.562mmol)溶解在10ml乙醇溶液中,加入5ml10%碳酸钠钠水溶液搅拌至溶解,然后慢慢滴加4-苄基香草醛(163mg,1.2eq)的乙醇溶液,体系变成橘黄色,滴加完之后转移至60℃的油浴之中,回流三个小时后,薄层检测,展开剂为乙酸乙酯:石油醚=1:2,反应完全。停止加热,待温度降低后冰浴下加入10%的盐酸,调PH到5左右,抽滤,用乙酸乙酯:石油醚=1:3过柱,得化合物2-(3’-甲氧基-4’-苄氧基苯丙烯酰基)-雌二醇(Ⅰ-10)黄色粉末211mg,收率为70%。1HNMR(400MHz,CDCl3)δ12.67(s,1H),7.83(d,J=15.4Hz,1H),7.76(s,1H),7.45(m,3H),7.38(t,J=7.3Hz,1H),7.32(m,1H),7.16(s,1H),6.93(d,J=8.4Hz,1H),6.73(s,1H),5.22(s,2H),3.96(s,3H),3.75(m,1H),2.89(m,2H),0.81(s,3H)。
实施例62-(2’,3’-二甲氧基苯丙烯酰基)-雌二醇(Ⅰ-12)的制备
将2-乙酰基-3-甲氧基雌二醇-17β-乙酯(A2,200mg,0.562mmol)溶解在10ml甲醇溶液中,加入3ml8%氢氧化钾水溶液搅拌至溶解,然后慢慢滴加2’,3’-二甲氧基苯甲醛(91mg,1.2eq)的乙醇溶液,体系变成橘红色,滴加完之后转移至60℃的油浴之中,回流四个小时后,薄层检测,展开剂为乙酸乙酯:石油醚=1:2,反应完全。停止加热,待温度降低后冰浴下加入10%的盐酸,调PH到5左右,抽滤,用乙酸乙酯:石油醚=1:3过柱,得化合物2-(2’,3’-二甲氧基苯丙烯酰基)-雌二醇(Ⅰ-12)黄色粉末208mg,收率为80%。1HNMR(400MHz,CDCl3)δ12.60(s,1H),7.88(d,J=15.4Hz,1H),7.78(s,1H),7.63(d,J=8.8Hz,1H),7.50(d,J=15.4Hz,1H),7.26(s,1H),6.96(d,J=8.7Hz,H),6.73(s,1H),3.92(s,3H),3.86(s,3H),3.76(m,1H),2.87(m,2H),0.81(s,3H)。
实施例72-甲氧基-16-(4’-氟苯亚甲基)雌酚酮(Ⅱ-2)的合成
取2-甲氧基-3-乙酰氧基雌酚酮(B2,229mg,0.67mmol)溶于20ml甲醇中,室温下搅拌,向溶液中滴加10%NaOH溶液3ml至固体全部溶解,然后慢慢滴加对氟苯甲醛107μl(1.5eq),溶液瞬间由无色变为淡黄色,反应3h,薄层板检测反应完全,展开剂选为二氯甲烷/丙酮(20/1)。后处理:将反应液置于冰浴下,加水稀释,滴加10%盐酸水溶液至PH5-6,溶液中出现黄色不容物,抽滤,水洗,烘干,得粗品。然后加入适量的甲醇使产物溶解后重结晶,得化合物2-甲氧基-16-(4’-氟苯亚甲基)雌酚酮(Ⅱ-2)黄色粉末250mg,收率92.5%。1HNMR(400MHz,CDCl3)δ7.55(dd,J=8.0,5.7Hz,2H),7.44(s,1H),7.12(t,J=8.5Hz,2H),6.80(s,1H),6.67(s,1H),5.49(s,1H),3.88(s,3H),2.95(dd,J=15.6,6.4Hz,1H),2.92–2.81(m,2H),2.51(t,J=14.1Hz,1H),2.45–2.38(m,1H),2.32(dd,J=12.2,8.0Hz,1H),2.13–2.03(m,2H),1.62(dd,J=13.3,7.0Hz,5H),1.01(s,3H)。
实施例82-甲氧基-16-(4’-氯苯亚甲基)雌酚酮(Ⅱ-3)的合成
取2-甲氧基雌酚酮(B1,200mg,0.67mmol)溶于20ml乙醇中,室温下搅拌,向溶液中滴加10%KOH溶液2ml至固体全部溶解,然后慢慢滴加对氯苯甲醛0.14g(1.5eq),溶液瞬间由无色变为淡黄色,反应3h,薄层板检测反应完全,展开剂选为二氯甲烷/丙酮(20/1)。后处理:将反应液置于冰浴下,加水稀释,滴加10%盐酸水溶液至PH5-6,溶液中出现黄色不容物,抽滤,水洗,烘干,得粗品。然后加入适量的甲醇使产物溶解后重结晶,得2-甲氧基-16-(4’-氯苯亚甲基)雌酚酮(Ⅱ-3)黄色粉末260mg,收率92.0%。1HNMR(400MHz,CDCl3)δ7.48(d,J=8.5Hz,2H),7.42–7.39(m,2H),7.37(s,1H),6.79(s,1H),6.66(s,1H),5.48(s,1H),3.86(s,3H),3.00–2.90(m,1H),2.85(dd,J=11.3,5.7Hz,2H),2.51(ddd,J=15.6,12.6,2.9Hz,1H),2.36(ddd,J=20.3,10.6,6.0Hz,2H),2.15–2.00(m,2H),1.65–1.59(m,5H),1.00(s,3H)。
实施例92-甲氧基-16-(4’-甲砜基苯亚甲基)雌酚酮(Ⅱ-6)的合成
取2-甲氧基雌酚酮(B1,200mg,0.67mmol)溶于20ml95%乙醇中,室温下搅拌,向溶液中滴加10%Na2CO3溶液2ml至固体全部溶解,然后慢慢滴加对甲砜基苯甲醛0.18g(1.5eq),溶液瞬间由无色变为淡黄色,40℃反应3~4h,薄层板检测反应完全,展开剂选为二氯甲烷/丙酮(20/1)。后处理:将反应液置于冰浴下,加水稀释,滴加10%盐酸水溶液至PH5-6,溶液中出现黄色不容物,抽滤,水洗,烘干,得粗品。然后加入适量的甲醇使产物溶解后重结晶,得到2-甲氧基-16-(4’-甲砜基苯亚甲基)雌酚酮(Ⅱ-6)白色粉末290mg,收率93.0%。1HNMR(400MHz,CDCl3)δ7.99(d,J=8.1Hz,2H),7.72(d,J=8.2Hz,2H),7.48(s,1H),6.80(s,1H),6.67(s,1H),3.87(s,3H),3.09(s,3H),2.97(dd,J=15.9,5.9Hz,1H),2.91–2.80(m,2H),2.59(t,J=14.3Hz,1H),2.43(s,1H),2.33(s,1H),2.09(dd,J=19.9,8.9Hz,2H),1.62(d,J=15.7Hz,5H),1.03(s,3H)。
实施例102-甲氧基-16-(3’,4’,5’-三甲氧基苯亚甲基)雌酚酮(Ⅱ-11)的制备
取2-甲氧基-3-乙酰氧基雌酚酮(B2,229mg,0.67mmol)雌甾烷溶于20ml乙醇中,向溶液中滴加10%KOH溶液5ml,然后加入3,4,5-三甲氧基苯甲醛0.20g(1.5eq),加热回流反应3h,将反应液置于冰浴下,加水稀释,滴加10%盐酸水溶液至PH5-6,溶液中出现黄色不容物,抽滤,水洗,烘干,经柱层析分离纯化,得化合物2-甲氧基-16-(3’,4’,5’-三甲氧基苯亚甲基)雌酚酮(Ⅱ-11)黄色晶体260mg,收率82.1%。1HNMR(400MHz,CDCl3)δ7.39(s,1H),6.80(s,3H),6.67(s,1H),5.47(s,1H),4.06(q,2H),3.93-3.86(m,12H),3.04-1.57(m,13H),1.00(s,3H)。
按照上述类似方法同样可以合成得到Ⅰ-3,Ⅰ-4,Ⅰ-5,Ⅰ-6,Ⅰ-7,Ⅰ-8,Ⅰ-9,Ⅰ-11,Ⅰ-13,Ⅱ-1,Ⅱ-,4,Ⅱ-5,Ⅱ-7,Ⅱ-8,Ⅱ-9,Ⅱ-10;其核磁数据如下:
2-(3’,5’-二氯苯丙烯酰基)-雌二醇(Ⅰ-3):1HNMR(400MHz,CDCl3)δ12.43(s,1H),8.18(d,J=15.5Hz,1H),7.76–7.68(t,2H),7.56(d,J=15.5Hz,1H),7.49(d,J=2.1Hz,1H),7.33(dd,J=8.4,2.0Hz,1H),6.75(s,1H),3.75(m,1H),2.88(m,2H),0.80(s,3H).
2-(2’-甲氧基苯丙烯酰基)-雌二醇(Ⅰ-4):1HNMR(400MHz,CDCl3)δ12.69(s,1H),8.19(d,J=15.7Hz,1H),7.80(s,1H),7.73(d,J=15.7Hz,1H),7.65(dd,J=7.7,1.6Hz,1H),7.40(m,1H),7.02(t,J=8.0Hz,1H),6.96(d,J=8.3Hz,1H),6.73(s,1H),3.93(s,3H),3.75(m,1H),2.87(m,2H),0.81(s,3H).
2-(3’-甲氧基苯丙烯酰基)-雌二醇(Ⅰ-5):1HNMR(400MHz,CDCl3)δ12.59(s,1H),7.85(d,J=15.5Hz,1H),7.76(s,1H),7.58(d,J=15.5Hz,1H),7.36(t,J=7.9Hz,1H),7.28(s,1H),7.16(s,1H),6.99(m,1H),6.73(s,1H),3.87(s,3H),3.75(m,1H),2.88(m,2H),2.36(m,1H),0.81(s,3H).
2-(4’-甲氧基苯丙烯酰基)-雌二醇(Ⅰ-6):1HNMR(400MHz,CDCl3)δ12.72(s,1H),7.88(d,J=15.4Hz,1H),7.78(s,1H),7.63(d,J=8.8Hz,2H),7.50(d,J=15.4Hz,1H),6.96(d,J=8.7Hz,2H),6.73(s,1H),3.87(s,3H),3.76(m,1H),2.87(m,2H),0.81(s,3H).
2-(2’-氯苯丙烯酰基)-雌二醇(Ⅰ-7):1HNMR(400MHz,CDCl3)δ12.49(s,1H),8.26(d,J=15.6Hz,1H),7.76(s,2H),7.58(d,J=15.6Hz,1H),7.45(m,1H),7.35(m,2H),6.75(s,1H),3.75(m,1H),0.80(s,3H).
2-(3’-氯苯丙烯酰基)-雌二醇(Ⅰ-8):1HNMR(400MHz,CDCl3)δ12.52(s,1H),7.80(d,J=15.5Hz,1H),7.74(s,1H),7.63(s,1H),7.58(d,J=15.5Hz,1H),7.52(d,J=6.6Hz,1H),7.34-7.39(m,2H),6.74(s,1H),3.76(m,1H),3.48(s,1H),2.89(m,2H),0.81(s,3H).
2-(4’-氯苯丙烯酰基)-雌二醇(Ⅰ-9):1HNMR(400MHz,CDCl3)δ12.55(s,1H),7.83(d,J=15.5Hz,1H),7.75(s,1H),7.58(m,3H),7.41(d,J=8.5Hz,2H),6.74(s,1H),3.76(m,1H),2.87(m,2H),2.41(m,1H),0.81(s,3H).
2-(3’-苄氧基-4’-甲氧基苯丙烯酰基)-雌二醇(Ⅰ-11):1HNMR(400MHz,CDCl3)δ12.67(s,1H),8.09(d,J=15.6Hz,1H),7.72(d,J=15.6Hz,1H),7.64(s,1H),7.46(d,J=6.7Hz,2H),7.33(m,2H),7.27(m,1H),7.24(m,1H),7.13(t,J=8.0Hz,1H),7.02(m,1H),6.73(s,1H),5.05(dd,J=26.0,10.8Hz,2H),3.92(s,3H),3.74(m,1H),2.87(m,2H),0.78(s,3H).
2-(4’-苄氧基苯丙烯酰基)-雌二醇(Ⅰ-13):1HNMR(400MHz,CDCl3)δ12.65(s,1H),7.87(d,J=15.4Hz,1H),7.78(s,1H),7.63(d,J=8.8Hz,2H),7.51(d,J=15.3Hz,1H),6.96(d,J=8.7Hz,2H),6.73(s,1H),4.07(q,2H),3.76(m,1H),2.87(m,2H),0.81(s,3H).
2-甲氧基-16-苯亚甲基雌酚酮(Ⅱ-1):1HNMR(400MHz,CDCl3)δ7.59(d,J=7.4Hz,2H),7.51(s,1H),7.49–7.38(m,3H),6.83(s,1H),6.70(s,1H),5.55(s,1H),3.90(s,3H),3.02(dd,J=15.7,5.6Hz,1H),2.87(dt,J=16.5,8.3Hz,2H),2.63–2.52(m,1H),2.43(d,J=9.6Hz,1H),2.34(dd,J=12.1,7.8Hz,1H),2.16–2.04(m,2H),1.69(dt,J=9.0,8.1Hz,5H),1.04(s,3H).
2-甲氧基-16-(4’-溴苯亚甲基)-雌酚酮(Ⅱ-4):1HNMR(400MHz,CDCl3)δ7.55(d,J=8.5Hz,2H),7.43(s,1H),7.42–7.38(m,2H),6.80(s,1H),6.67(s,1H),5.50(s,1H),3.87(s,3H),2.93(ddd,J=15.7,6.4,1.5Hz,1H),2.86(dd,J=11.4,5.6Hz,2H),2.50(ddd,J=15.7,12.6,3.0Hz,1H),2.46–2.36(m,1H),2.37–2.27(m,1H),2.17–1.99(m,2H),1.68–1.56(m,5H),1.00(s,3H).
2-甲氧基-16-(4’-甲基苯亚甲基)-雌酚酮(Ⅱ-5):1HNMR(400MHz,CDCl3)δ7.47(s,1H),7.45(s,2H),7.25(s,1H),7.21(s,1H),6.80(s,1H),6.66(s,1H),5.47(s,1H),3.86(s,3H),2.97(dd,J=15.6,5.2Hz,1H),2.85(dd,J=11.9,6.0Hz,2H),2.56–2.43(m,2H),2.38(s,3H),2.11–2.05(m,2H),1.62(dd,J=15.9,13.0Hz,7H),1.00(s,3H).
2-甲氧基-16-(3’-氯苯亚甲基)-雌酚酮(Ⅱ-7):1HNMR(400MHz,CDCl3)δ7.54(d,J=9.6Hz,1H),7.48–7.32(m,4H),6.81(d,J=10.2Hz,1H),6.69(d,J=10.0Hz,1H),5.50(d,J=10.0Hz,1H),3.88(d,J=10.0Hz,3H),2.92(d,J=45.6Hz,3H),2.55(d,J=10.7Hz,1H),2.42(s,1H),2.32(s,1H),2.10(s,2H),1.63(d,J=8.2Hz,5H),1.02(d,J=10.1Hz,3H).
2-甲氧基-16-(3’-硝基苯亚甲基)-雌酚酮(Ⅱ-8):1HNMR(400MHz,CDCl3)δ8.41(s,1H),8.22(d,J=8.0Hz,1H),7.84(d,J=7.5Hz,1H),7.61(t,J=8.0Hz,1H),7.49(s,1H),6.80(s,1H),6.68(s,1H),5.49(s,1H),3.88(s,3H),2.99(dd,J=15.8,6.2Hz,1H),2.95–2.82(m,2H),2.62(t,J=13.5Hz,1H),2.43(s,1H),2.33(s,1H),2.10(t,J=10.6Hz,2H),1.67–1.58(m,5H),1.03(s,3H).
2-甲氧基-16-(3’,5’-二氟苯亚甲基)-雌酚酮(Ⅱ-9):1HNMR(400MHz,CDCl3)δ7.73(s,1H),7.57–7.44(m,2H),7.29(d,J=8.2Hz,1H),6.80(s,1H),6.66(s,1H),5.49(s,1H),3.87(s,3H),2.49(t,J=14.0Hz,1H),2.41(d,J=4.3Hz,1H),2.31(s,1H),2.11(d,J=8.1Hz,1H),2.01(d,J=10.3Hz,1H),1.75–1.53(m,6H),1.46–1.37(m,1H),1.02(s,3H).
2-甲氧基-16-(3’,5’-二氯苯亚甲基)-雌酚酮(Ⅱ-10):1HNMR(400MHz,CDCl3)δ7.73(s,1H),7.57–7.44(m,2H),7.29(d,J=8.2Hz,1H),6.80(s,1H),6.66(s,1H),5.49(s,1H),3.87(s,3H),2.49(t,J=14.0Hz,1H),2.41(d,J=4.3Hz,1H),2.31(s,1H),2.11(d,J=8.1Hz,1H),2.01(d,J=10.3Hz,1H),1.75–1.53(m,6H),1.46–1.37(m,1H),1.02(s,3H).
实施例11以雌甾为母核的2位或16位取代的查耳酮衍生物对肿瘤细胞的抗增殖活性评价实验资料如下:
(1)受试样品和癌细胞系
本发明以雌甾为母核的2位或16位取代的查耳酮衍生物(共24种本发明化合物)及2-ME分别用二甲基亚砜(DMSO,Amresco0231ACSGrade)配制成10mmol/L的原药贮存液,4℃保存,临用时以RPMI-1640(或DMEM)培养基(10%FBS,1%青链霉素)稀释。
实验所选用癌细胞系为人神经母细胞瘤SK-N-SH细胞、食管癌EC-109细胞、乳腺癌MCF-7细胞、胃癌MGC803细胞、肺癌细胞A549及小鼠黑色素瘤细胞系B16细胞。其中SK-N-SH、B16细胞在DMEM培养基中培养,其它细胞在RPMI1640培养基中培养。
(2)实验方法
用SRB染色法检测24种以雌甾为母核的2位或16位取代的查耳酮衍生物对不同癌细胞增殖的抑制作用,筛选出抑制效果较好的化合物。取对数生长期细胞,调整浓度为2.5×104个/ml,接种于96孔培养板中,每孔200μl。5%CO2、饱和湿度37℃孵育箱中培养24h。待细胞贴壁,实验组加入RPMI-1640培养基(10%FBS,1%青链霉素)稀释本发明衍生物至终浓度均为1μmol/L,溶剂组加入含DMSO的培养基,空白组加入RPMI-1640培养基(10%FBS,1%青链霉素),调零组为无细胞的培养基,每孔终体积为200μl,每组设6个复孔。5%CO2,37℃孵育72小时后,每孔加入预冷的50%TCA200μl(终浓度为10%)固定,静置10min,4℃放置1h。吸出含药培养基,每孔用150μl超纯水洗5遍,甩干,空气干燥。每孔加入100μl的SRB溶液,静置放置15min,未与蛋白结合的SRB用1%醋酸洗5遍,空气干燥。结合的SRB用150μl10mmol/L非缓冲Tris碱溶解。用全自动酶标仪在515nm波长处测定每孔OD值,按如下公式计算抑制率。抑制率的计算公式:抑制率=1-实验组OD值/空白组OD值×100%,其中实验组和空白组均为扣除调零组后的值,并利用SPSS15.0统计软件计算衍生物对不同肿瘤细胞株的半数抑制浓度(IC50)。
(3)试验结果
采用Logit法对本发明衍生物作用72h时的IC50进行统计,实验结果分别见表1:
表1系列I和系列II化合物对几种细胞的IC50值(μmol/L)
实例12以雌甾为母核的2位或16位取代的查耳酮衍生物对血管生成作用的活性筛选资料如下:
(1)鸡胚绒毛尿囊膜(CAM)模型
材料与试剂:受精的鸡胚;Fishers培养液;系列Ⅰ和系列Ⅱ化合物
试验步骤:
a)配药:用倍比稀释法配好浓度梯度的药液(PBS),将滤纸小片放入其中。b)鸡蛋开窗:在超净台内,鸡蛋表面消毒,然后用刀片和镊子将气室部分蛋壳剪掉。c)制作假气室:用刀片在膜上轻割一个小口子,在鸡蛋窗里加PBS,膜鼓起后撕掉该膜。d)加药片:将蘸好一定浓度药液的药片放入,最好在中间。e)封口:塑料帽盖上,透气胶布粘好,然后拿出超净台蜡封。f)培养三天:放入37度培养箱,有湿度下培养三天。g)拆封。h)固定:加入适量冷丙酮(或甲醛)固定膜。i)剪膜:沿气室边缘减掉此层膜,剥净,放入含PBS(不需灭菌)的培养皿中。
(2)试验结果
拍照和数据处理与分析:用SPSS软件统计分析数药片上血管数;用IPP图像处理软件统计药片上血管面积和药片总面积,算出比值VA/VC.
系列Ⅰ化合物的试验结果见图1、2:
“*”表示该药有抑制血管生成作用,且该组与地塞米松对照组相比差异显著;
“**”表示该药有抑制血管生成作用,且该组与地塞米松对照组相比差异极其显著;
“#”表示该药有促进血管生成作用,且该组与地塞米松对照组相比差异显著;
“##”表示该药有促进血管生成作用,且该组与地塞米松对照组相比差异极其显著。
系列Ⅰ化合物中Ⅰ-2、Ⅰ-12都显示较好的抑制血管生成的作用,Ⅰ-2、Ⅰ-12作用后血管面积和血管数与地塞米松对照组相比差异极其显著。相反,Ⅰ-5有显著的促进血管生成的活性,可以用于与心脑血管有关的疾病。
系列Ⅱ化合物的试验结果见图3、4:
“*”表示该药有抑制血管生成作用,且该组与地塞米松对照组相比差异显著;
“**”表示该药有抑制血管生成作用,且该组与地塞米松对照组相比差异极其显著;“#”表示该药有促进血管生成作用,且该组与地塞米松对照组相比差异显著。
系列Ⅱ化合物中Ⅱ-2、Ⅱ-3、Ⅱ-4、Ⅱ-7都显示一定抑制血管生成的作用,Ⅱ-2和Ⅱ-7作用后血管面积与对地塞米松对照组相比差异显著,Ⅱ-3作用后血管数与地塞米松对照组相比差异极其显著,Ⅱ-4作用后血管数与地塞米松对照组相比差异显著。
血管新生过程受到血管新生诱导因子和抑制因子的严格调控,正常情况下血管新生诱导因子与抑制因子处于动态平衡。根据鸡胚绒毛尿囊膜(CAM)试验结果,我们对系列Ⅰ和系列Ⅱ化合物的甾体结构、取代基的位置、取代基的电子效应等进行了初步分析,推测系列Ⅰ和系列Ⅱ化合物对血管新生的抑制或促进的活性可能和甾体母核上的取代位置、结构、取代基的电子效应、空间位阻等多种因素有关。比如,研究发现雌二
以雌甾为母核的2位或16位取代的查耳酮衍生物及其制备方法和用途专利购买费用说明
![]()
Q:办理专利转让的流程及所需资料
A:专利权人变更需要办理著录项目变更手续,有代理机构的,变更手续应当由代理机构办理。
1:专利变更应当使用专利局统一制作的“著录项目变更申报书”提出。
2:按规定缴纳著录项目变更手续费。
3:同时提交相关证明文件原件。
4:专利权转移的,变更后的专利权人委托新专利代理机构的,应当提交变更后的全体专利申请人签字或者盖章的委托书。
Q:专利著录项目变更费用如何缴交
A:(1)直接到国家知识产权局受理大厅收费窗口缴纳,(2)通过代办处缴纳,(3)通过邮局或者银行汇款,更多缴纳方式
Q:专利转让变更,多久能出结果
A:著录项目变更请求书递交后,一般1-2个月左右就会收到通知,国家知识产权局会下达《转让手续合格通知书》。
动态评分
0.0