专利摘要
本发明涉及具有产生包括烷烃在内的烃的能力的微生物变体和使用该微生物变体产生包括烷烃在内的烃的方法。更具体地,本发明涉及这样的微生物变体:其中在经改良适于产生包括烷烃在内的烃的微生物中引入了编码将脂肪酰基载体蛋白转化成游离脂肪酸的酶的基因、编码将游离脂肪酸转化成脂肪酰基辅酶A的酶的基因、编码将脂肪酰基辅酶A转化成脂肪醛的酶的基因和编码将脂肪醛转化成烷烃的酶的基因而获得。本发明还涉及产生包括烷烃在内的烃的方法。本发明的微生物变体可用在通过额外代谢流改造对菌株的改良中,并因而可用于工业生产包括烷烃在内的烃。
权利要求
1.微生物变体,其能够产生选自烷烃、烯烃、炔烃和芳香烃的烃,在所述微生物变体中删除或削弱了编码酰基辅酶A脱氢酶的基因和编码DNA结合转录二元调节子的基因;并且引入或增强了编码将脂肪酰基载体蛋白转化成游离脂肪酸的酶的基因、编码将游离脂肪酸转化成脂肪酰基辅酶A的酶的基因、编码将脂肪酰基辅酶A转化成脂肪醛的酶的基因和编码将脂肪醛转化成烷烃的酶的基因。
2.权利要求1的微生物变体,其中在所述微生物变体中用强启动子进一步取代编码酰基辅酶A合成酶的基因的天然启动子和编码脂肪酸外膜转运蛋白的基因的含衰减子的天然启动子,并且在所述微生物变体中进一步引入编码短链脂肪酸外膜转运蛋白的基因。
3.权利要求1的微生物变体,其中在所述微生物变体中用强启动子进一步取代所述fabDHG操纵子的天然启动子和fabA操纵子的天然启动子。
4.权利要求1的微生物变体,其中通过额外删除乙酸激酶A编码基因(ackA)构建所述微生物变体。
5.权利要求1的微生物变体,其中所述微生物选自细菌、酵母和真菌。
6.权利要求5的微生物变体,其中所述细菌是具有脂肪酸代谢途径的细菌。
7.权利要求6的微生物变体,其中所述具有脂肪酸代谢途径的细菌选自棒状杆菌(Corynebacterium)、短棒菌(Brevibacterium)和大肠杆菌(E.coli)。
8.权利要求1的微生物变体,其中所述编码酰基辅酶A脱氢酶的基因是fadE。
9.权利要求1的微生物变体,其中所述编码DNA结合转录二元调节子的基因是fadR。
10.权利要求1的微生物变体,其中所述将脂肪酰基载体蛋白转化成游离脂肪酸的酶是酰基辅酶A硫酯酶。
11.权利要求1的微生物变体,其中所述将游离脂肪酸转化成脂肪酰基辅酶A的酶是大肠杆菌来源的乙酰辅酶A:乙酰乙酰辅酶A转移酶或酰基辅酶A合成酶。
12.权利要求1的微生物变体,其中所述将脂肪酰基辅酶A转化成脂肪醛的酶是脂肪酰基辅酶A还原酶。
13.权利要求1的微生物变体,其中所述将脂肪醛转化成烷烃的酶是脂肪醛脱羰酶。
14.权利要求2的微生物变体,其中所述编码酰基辅酶A合成酶的基因是fadD,所述短链脂肪酸外膜转运蛋白的编码基因是atoE。
15.权利要求2的微生物变体,其中所述编码脂肪酸外膜转运蛋白的基因是fadL。
16.权利要求1的微生物变体,其中所述编码将脂肪酰基载体蛋白转化成游离脂肪酸的酶的基因是tesA(酰基辅酶A硫酯酶编码基因)。
17.权利要求1的微生物变体,其中所述编码将游离脂肪酸转化成脂肪酰基辅酶A的酶的基因是atoDA(乙酰辅酶A:乙酰乙酰辅酶A转移酶编码基因)或fadD(酰基辅酶A合成酶编码基因)。
18.权利要求1的微生物变体,其中所述编码将脂肪酰基辅酶A转化成脂肪醛的酶的基因是luxC(脂肪酰基辅酶A还原酶编码基因)。
19.权利要求1的微生物变体,其中所述编码将脂肪醛转化成烷烃的酶的基因是cer1(脂肪醛脱羰酶1编码基因)。
20.权利要求1至19之一的微生物变体,其中所述烃选自十五烷、十七烷、辛烷、壬烷和壬烯。
21.权利要求2或3的微生物变体,其中所述强启动子选自trc启动子、tac启动子、T7启动子、lac启动子和trp启动子。
22.大肠杆菌变体,其能够产生选自烷烃、烯烃、炔烃和芳香烃的烃,所述大肠杆菌变体是通过删除或削弱编码酰基辅酶A脱氢酶的基因(fadE)和编码DNA结合转录二元调节子的基因(fadR)而构建,并且在所述大肠杆菌变体中用强启动子进一步取代编码酰基辅酶A合成酶的基因(fadD)的天然启动子和编码脂肪酸外膜转运蛋白的基因(fadL)的含衰减子的天然启动子;并且其中所述大肠杆菌变体通过引入或增强编码将脂肪酰基载体蛋白转化成游离脂肪酸的酶(酰基辅酶A硫酯酶)的基因、编码将游离脂肪酸转化成脂肪酰基辅酶A的酶的基因、编码将脂肪酰基辅酶A转化成脂肪醛的酶(脂肪酰基辅酶A还原酶)的基因和编码将脂肪醛转化成烷烃的酶(脂肪醛脱羰酶)的基因而构建。
23.大肠杆菌变体,其能够产生选自烷烃、烯烃、炔烃和芳香烃的烃,所述大肠杆菌变体通过删除或衰减编码酰基辅酶A脱氢酶的基因(fadE)和编码DNA结合转录二元调节子的基因(fadR)而构建,并且在所述大肠杆菌变体中用强启动子进一步取代fabDHG操纵子的天然启动子和fabA基因的天然启动子,所述大肠杆菌变体中已经引入或增强了编码将脂肪酰基载体蛋白转化成游离脂肪酸的酶(酰基辅酶A硫酯酶)的基因、编码将游离脂肪酸转化成脂肪酰基辅酶A的酶的基因、编码将脂肪酰基辅酶A转化成脂肪醛的酶(脂肪酰基辅酶A还原酶)的基因和编码将脂肪醛转化成烷烃的酶(脂肪醛脱羰酶)的基因。
24.权利要求22或23的大肠杆菌变体,其中所述烃选自十五烷、十七烷、辛烷、壬烷和壬烯。
25.用于制备能够产生选自烷烃、烯烃、炔烃和芳香烃的烃的微生物变体的方法,其中所述微生物突变体通过删除编码酰基辅酶A脱氢酶的基因和编码DNA结合转录二元调节子的基因,并通过引入或增强编码将脂肪酰基载体蛋白转化成游离脂肪酸的酶的基因、编码将游离脂肪酸转化成脂肪酰基辅酶A的酶的基因、编码将脂肪酰基辅酶A转化成脂肪醛的酶的基因和编码将脂肪醛转化成烷烃的酶的基因而构建。
26.权利要求25的方法,其中在所述微生物变体中用强启动子进一步取代编码酰基辅酶A合成酶的基因的天然启动子和编码长链脂肪酸外膜转运蛋白的基因的含衰减子的天然启动子,并且在所述微生物变体中进一步引入编码短链脂肪酸外膜转运蛋白的基因。
27.权利要求25的方法,其中用强启动子进一步取代所述fabDHG操纵子的天然启动子和fabA基因的天然启动子。
28.权利要求25的方法,其包括额外删除乙酸激酶A编码基因(ackA)。
29.权利要求25的方法,其中所述微生物选自细菌、酵母和真菌。
30.权利要求29的方法,其中所述细菌是具有脂肪酸代谢途径的细菌。
31.权利要求30的方法,其中所述具有脂肪酸代谢途径的细菌选自棒状杆菌、短棒菌和大肠杆菌。
32.权利要求25的方法,其中所述烃选自十五烷、十七烷、辛烷、壬烷和壬烯。
33.用于产生烃的方法,所述烃选自烷烃、烯烃、炔烃和芳香烃,所述方法包括:培养权利要求1至19中任何一项的能够产生烃的微生物变体,由此产生烃;并从培养液中回收所述烃。
34.权利要求33的方法,其中所述烃选自十五烷、十七烷、辛烷、壬烷和壬烯。
35.用于产生烃的方法,所述烃选自烷烃、烯烃、炔烃和芳香烃,所述方法包括:培养权利要求22或23的能够产生烃的大肠杆菌变体,由此产生烃;并从培养液中回收所述烃。
36.权利要求35的方法,其中所述烃选自十五烷、十七烷、辛烷、壬烷和壬烯。
说明书
技术领域
本发明涉及能够产生烃(包括烷烃(alkane))的微生物变体和使用该微生物变体产生烃(包括烷烃)的方法。具体地,本发明涉及这样的微生物变体和使用该微生物变体产生包括烷烃在内的烃的方法,其中在经改良适于产生包括烷烃在内的烃的微生物中引入了编码将脂肪酰基载体蛋白(fatty acyl-acp)转化成游离脂肪酸的酶的基因、编码将游离脂肪酸转化成脂肪酰基辅酶A的酶的基因、编码将脂肪酰基辅酶A转化成脂肪醛的酶的基因和编码将脂肪醛转化成烷烃的酶的基因而获得。
背景技术
近些年,由于高油价和环境问题,微生物生产生物燃料已经引起了很多关注。而且,由于生物燃料已经被认定为化石燃料的替代燃料,它们的市场规模迅速扩大。特别地,烷烃具有包括能量密度高、挥发性可控、辛烷值充足和杂质含量低等适合用作燃料的性质,并且因为更节能且更容易与汽油混合而比乙醇有优势。此外,烷烃已经用在现有的油管道或汽车引擎中。因此,如果使用微生物大量产生作为最合适的替代燃料的烷烃,则可减少原煤气的输入并可减少温室气体的排放,产生环境影响。
目前,市售汽油是线性烃化合物,其在一个分子中具有6-10个碳原子并含有直接的碳-碳键以及与支链结构共存的直链结构。
此外,市售汽油每kg含有约40MJ的能量,可能在室温和大气压下蒸发,并且具有明显的易燃性。汽油的最重要因素是辛烷值。一些具有高分支结构的烃在汽车引擎中平稳燃烧,而具有无分支碳链的烃在汽缸中可能会爆炸,从而引起活塞剧烈运动。这种不期望的爆炸导致汽车的爆震现象(knocking phenomena)。作为对该爆震性质的定量测定方式,将异辛烷(2,2,4-三甲基戊烷,其为具有高分支结构的高品质燃料)的辛烷值设定为100,而将庚烷(其为低品质的汽车燃料)的辛烷值设定为0。在该体系下,普通级汽油的辛烷值为约87。为此,产生大量高分支的烃是很重要的,所述高分支的烃,如异辛烷,是汽油中的重要物质。
通常,原油中汽油的比例仅为25%,并且该部分最常被用作燃料。因此,为了提高石油化工厂中汽油的产量,将具有高沸点的C12-C18馏分进行裂化处理,以产生碳原子数少且沸点低的馏分。从这个观点出发,当相对高碳原子数的馏分对应于煤油或柴油范畴时,通过在油精炼厂中热裂化和催化裂化成汽油而重新形成燃料。根据由于气液色谱的发展而对从海洋细菌和藻类的细胞中分离烃样物质的研究,对微生物产生烃的研究开始逐渐增加。对微生物产生烃的研究可大体上分为两类:涉及微生物细胞内烃的方法和涉及微生物细胞外烃的方法。对于细胞内产生,具有多种微生物系统组,其通常基于干重显示约0.005-2.69%的值。能够通过该方法产生烃的菌株包括蓝细菌(cyanobacteria)、厌氧型光养菌、革兰氏阴性厌氧硫酸盐还原菌、革兰氏阴性兼性厌氧菌、酵母和真菌等。各种菌株均可产生多种烃,并显示独特的馏分和优势。在细胞外产生的研究中,能够产生烃的菌株包括脱硫弧菌(Desulfovibrio)和梭状芽胞杆菌(Clostridium),能够产生异戊二烯(其为挥发性非甲烷烃)的菌株包括放线菌(Actinomycetes),能够产生乙烯的菌株包括棒曲霉(Aspergillus clavatus)。
因此,已经在能够产生烃的工业上可应用的菌株中对培养条件的优化进行了研究,对诸如烃相关基因和酶的关键物质进行了研究,对代谢流进行了研究。然而,对基因和酶的分析和代谢加工应用的研究仍然不够。因此,需要更基础的方法去筛选工业上可应用的菌株、分析与目标烃的产生有关的基因并从这些菌株中分离与代谢流相关的酶,以优化烃产生过程,由此提高烃的产量。
因此,本发明人已经做出了巨大努力去开发用于微生物产生烃(包括烷烃)的新方法,并通过构建将脂肪酸作为底物转化成烷烃的新代谢途径而构建了经改良以适于产生包括烷烃在内的烃的微生物变体,并且已经发现所述微生物变体可用于产生包括辛烷、壬烷和壬烯(其为汽油范畴内的烷烃)在内的烷烃,及十五烷和十七烷,由此完成本发明。
发明概述
本发明的目的是提供能够产生烃(包括烷烃)的微生物变体及其制备方法。
本发明的另一目的是提供使用上述微生物变体产生烃(包括烷烃)的方法。
为了实现上述目的,本发明提供了能够产生选自烷烃、烯烃、炔烃和芳香烃的烃的微生物变体及其制备方法,其中在所述微生物变体中删除(缺失)或削弱了编码酰基辅酶A脱氢酶的基因和编码DNA结合转录二元调节子(DNA-binding transcriptional dual regulator)的基因,并且引入或增强了编码将脂肪酰基载体蛋白转化成游离脂肪酸的酶的基因、编码将游离脂肪酸转化成脂肪酰基辅酶A的酶的基因、编码将脂肪酰基辅酶A转化成脂肪醛的酶的基因和编码将脂肪醛转化成烷烃的酶的基因。本发明还提供了用于产生选自烷烃、烯烃、炔烃和芳香烃的烃的方法,所述方法包括:培养能够产生烃的微生物变体,由此产生选自烷烃、烯烃、炔烃和芳香烃的烃;并从培养液中回收所述烃。
附图说明
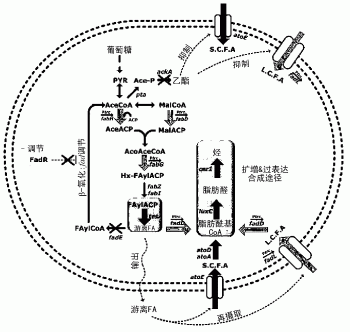
图1显示了用于在微生物中生物合成烷烃的代谢途径,其中所述微生物的脂肪酸代谢经过了改造从而适于产生烃(包括烷烃)。
图2显示了pTrc99a_luxC_tac_tesA质粒。
图3显示了pTac15k_atoDAE_tac_CER1质粒。
图4显示在改良的菌株中产生的汽油范畴的烃。
图5是pTac15k的酶切图。
发明详述和优选实施方案
除非另有定义,否则本文使用的所有技术术语和科学术语均具有本发明所属领域的技术人员通常理解的相同含义。通常,本文使用的命名法为本领域所熟知并经常被使用。
一方面,本发明涉及能够产生选自烷烃、烯烃、炔烃和芳香烃的烃的微生物变体,其中所述微生物变体通过删除或衰减编码酰基辅酶A脱氢酶的基因和编码DNA结合转录二元调节子的基因,并且通过引入或增强编码将脂肪酰基载体蛋白转化成游离脂肪酸的酶的基因、编码将游离脂肪酸转化成脂肪酰基辅酶A的酶的基因、编码将脂肪酰基辅酶A转化成脂肪醛的酶的基因和编码将脂肪醛转化成烷烃的酶的基因而构建。
在本发明中,为了提高微生物变体产生包括烷烃在内的烃的能力,在所述突变微生物中可用强启动子进一步取代编码酰基辅酶A合成酶的基因的天然启动子和编码脂肪酸外膜转运蛋白的基因的含衰减子的天然启动子,并且可以向所述微生物变体中进一步引入编码短链脂肪酸外膜转运蛋白(short-chain fatty acid outer membrane transporter)的基因。
在本发明中,为了提高本发明微生物变体产生包括烷烃在内的烃的能力,可用强启动子进一步取代fabDHG(fabD:丙二酰辅酶A[酰基载体蛋白]酰基转移酶;fabG:3-氧酰基-[酰基载体蛋白]还原酶;fabH:3-氧酰基-[酰基载体蛋白]合成酶III)操纵子的天然启动子和fabA(β-羟基癸酰硫酯脱水酶)的天然启动子。
而且,可通过乙酸激酶A编码基因(ackA)的额外删除而构建所述微生物变体。
在本发明中,所述微生物可选自细菌、酵母和真菌。在本文中,所述细菌可以是具有脂肪酸代谢途径的细菌。优选地,所述细菌可选自棒状杆菌(Corynebacteriumsp.)、短杆菌(Brevibacterium sp.)和大肠杆菌(E.coli)。更优选地,该细菌可以是大肠杆菌。能够使用葡萄糖作为碳源的任何微生物都可不受限制地用在本发明中。
在本发明中,编码酰基辅酶A脱氢酶的基因是fadE,而编码DNA结合转录二元调节子的基因是fadR。编码酰基辅酶A合成酶的基因可以是fadD,而可进一步引入的短链脂肪酸外膜转运蛋白编码基因是atoE。同时,编码脂肪酸外膜蛋白转运蛋白的基因是fadL。
在本发明中,将脂肪酰基载体蛋白转化成游离脂肪酸的酶可以是酰基辅酶A硫酯酶,而将游离脂肪酸转化成脂肪酰基辅酶A的酶可以是大肠杆菌来源的乙酰辅酶A:乙酰乙酰辅酶A转移酶或酰基辅酶A合成酶。
将脂肪酰基辅酶A转化成脂肪醛的酶可以是克氏梭菌(Clostridium kluyveri)来源的脂肪酰基辅酶A还原酶,而将脂肪醛转化成烷烃的酶是拟南芥(Arabidopsis thaliana)col.来源的脂肪醛脱羰酶(fatty aldehydedecarbonylase)。此外,可在本发明中使用任何酶,只要它们在宿主细胞中表达,显示出与上述酶相同的酶活性。
在本发明中,编码将脂肪酰基载体蛋白转化成游离脂肪酸的酶的基因可以是tesA(酰基辅酶A硫酯酶编码基因),而编码将游离脂肪酸转化成脂肪酰基辅酶A的酶的基因可以是atoDA或fadD(酰基辅酶A合成酶编码基因)。在本文中,atoDA由atoD(酰基辅酶A:乙酰乙酰辅酶A转移酶α亚基)和atoA(酰基辅酶A:乙酰乙酰辅酶A转移酶β亚基)组成。
编码将脂肪酰基辅酶A转化成脂肪醛的酶的基因可以是luxC(脂肪酰基辅酶A还原酶编码基因),而编码将脂肪醛转化成烷烃的酶的基因可以是cer1(脂肪醛脱羰酶1编码基因)。
在本发明中,引入微生物变体中的重组载体可以是含有luxC、cer1、tesA或atoDAE基因的载体,其包含强启动子。所述重组载体可以是pTrc99a_luxC_tac_tesA或pTac15k_atoDAE_tac_CER1载体,并且所述强启动子可以选自trc启动子、tac启动子、T7启动子、lac启动子和trp启动子。此外,一般用于本领域的任何强启动子均可不受限制地用在本发明中。
另一方面,本发明涉及制备微生物变体的方法,所述微生物变体具有产生选自烷烃、烯烃、炔烃和芳香烃的烃的能力,其中该微生物变体通过删除编码酰基辅酶A脱氢酶的基因和编码DNA结合转录二元调节子的基因,并且通过引入或增强编码将脂肪酰基载体蛋白转化成游离脂肪酸的酶的基因、编码将游离脂肪酸转化成脂肪酰基辅酶A的酶的基因、编码将脂肪酰基辅酶A转化成脂肪醛的酶的基因和编码将脂肪醛转化成烷烃的酶的基因而构建。
在本发明中,为了提高微生物变体产生包括烷烃在内的烃的能力,可以进一步在所述微生物变体中用强启动子取代编码酰基辅酶A合成酶的基因的天然启动子和编码脂肪酸外膜转运蛋白(fatty acid outer membrane transporter)的基因的含衰减基因的天然启动子,并且可以在所述微生物变体进一步引入编码短链脂肪酸外膜转运蛋白的基因。
在本发明中,为了提高本发明的微生物变体产生包括烷烃在内的烃的能力,可进一步用强启动子取代fabDHG(fabD:丙二酰辅酶A[酰基载体蛋白]酰基转移酶;fabG:3-氧酰基-[酰基载体蛋白]还原酶;fabH:3-氧酰基-[酰基载体蛋白]合成酶III)操纵子的天然启动子和fabA(β-羟基癸酰硫酯脱水酶)的天然启动子。
而且,可通过乙酸激酶A编码基因(ackA)的额外生产而构建所述微生物变体。
在又一方面,本发明涉及用于产生选自烷烃、烯烃、炔烃和芳香烃的烃的方法,所述方法包括:培养具有产生烃的能力的微生物变体,由此产生选自烷烃、烯烃、炔烃和芳香烃的烃;和从培养液中回收所述烃。
在本发明中,构建了将脂肪酸转化成烷烃的新代谢途径,由此制备了具有产生包括烷烃在内的烃的能力的微生物变体,并且测定了所制备的微生物变体是否能够产生包括烷烃在内的烃。
适于产生包括烷烃在内的烃的微生物变体通过削弱或删除酶fadE(酰基辅酶A脱氢酶)的基因(其为脂肪酸代谢的初始步骤,将脂肪酰基辅酶A转化成小链的脂肪酰基辅酶A——酰辅酶A)和fadR(DNA结合转录二元调节子)基因(其调节参与脂肪酸代谢的酶的基因)而获得。而且,所述微生物变体通过用强启动子取代fadD(酰基辅酶A合成酶)基因(其将脂肪酸转化成脂肪酰基辅酶A)的启动子和fadL(长链脂肪酸外膜转运蛋白)基因(其参与外部脂肪酸的吸收)的启动子而获得。
可以推断,以下述方式实现使用本发明的微生物变体产生烷烃。通过硫酯酶将从葡萄糖转化的脂肪酰基载体蛋白转化成游离脂肪酸,并且通过酰基辅酶A合成酶将所述游离脂肪酸转化成脂肪酰基辅酶A。所述脂肪酰基辅酶A通过脂肪酰基辅酶A还原酶转化成脂肪醛,并且该脂肪醛通过脂肪醛脱羰酶转化成烷烃(图1)。
在本发明的一个实例中,为了制备适于产生包括烷烃在内的烃的微生物变体,将fadE(酰基辅酶A脱氢酶)基因和fadR(DNA-结合转录二元调节子)从大肠杆菌W3110中删除。
全局调节子fadR(DNA-结合转录二元调节子)基因的功能是调节参与脂肪酸代谢的大多数基因。存在碳源,如葡萄糖时,fadR基因强烈抑制参与脂肪酸代谢的大多数基因,而不存在碳源,如葡萄糖时,fadR可释放所有的被抑制基因并降解脂肪酸。因此,在存在碳源,如葡萄糖时,fadR基因强烈抑制参与脂肪酸代谢的基因,从而使脂肪酸不被降解。为此,在本发明中,通过删除fadR基因而对微生物改造,从而使脂肪酸在即便存在葡萄糖时也能够被降解。
因为fadE(酰基辅酶A脱氢酶)基因是脂肪酸代谢的初始步骤(将脂肪酰基辅酶A转化成乙酰辅酶A,其为小链的脂肪酰基辅酶A),通过删除fadE基因而对微生物进行改造,从而使脂肪酰基辅酶A不被转化成乙酰辅酶A,但能够被转化成脂肪酰基醛。
在本发明的另一实例中,构建了克隆有编码将脂肪酰基辅酶A转化成脂肪醛的酶的基因luxC(脂肪酰基辅酶A还原酶编码基因)的ptrc99a_luxC_tac_CER1载体和克隆有编码将脂肪酰基载体蛋白转化成游离脂肪酸的酶的基因tesA(酰基辅酶A硫酯酶编码基因)和编码将脂肪醛转化成烷烃的酶的基因cer1(脂肪醛脱羰酶1编码基因)的pTac15k_atoDAE_tac_cer1载体。将所述构建载体引入上述突变生物中,由此构建具有产生烷烃的能力的微生物变体(WERPLD3110+ptrc99a_luxC_tac_tesA+pTac15k_atoDAE_tac_CER1)。
在本发明的又一实例中,培养根据本发明制备的微生物变体,并且发现所述微生物变体产生辛烷、壬烷和壬烯(其为汽油范畴的烷烃)以及十五烷和十七烷。然而,除了十五烷和十七烷,还可以由可在微生物中生物合成且具有多种碳结构的脂肪酸产生饱和烃或不饱和烃。可由具有多种碳结构的脂肪酸(其可在微生物中生物合成)产生的饱和烃或不饱和烃的实例包括癸烷、十一烷和十三烷等。
在本发明中,可使用本领域已知的常规培养方法进行微生物变体的培养和从所述培养物中回收烃。除了本发明实施例中使用的特定培养基和培养方法,还可以使用水解产物,如乳清或CSL(玉米浆)并使用多种培养方法,如补料分批式培养或连续培养(Lee等,Bioprocess Biosyst.Eng.,26:63,2003;Lee等,Appl.Microbiol.Biotechnol.,58:663,2002;Lee等,Biotechnol.Lett.,25:111,2003;Lee等,Appl.Microbiol.Biotechnol.,54:23,2000;Lee等,Biotechnol.Bioeng.,72:41,2001)。
本文所用的术语“烃”指仅由碳和氢组成的有机化合物的集合。根据分子结构,可以将烃大体上分为环烃和链状烃。此外,还可将烃分为仅由单键组成的饱和烃和含有双键或三键的不饱和烃。
如本文所用的术语“削弱(衰减)”意在包括突变、取代或删除目的基因的一部分,或向该基因中引入一个或多个碱基,从而降低由该基因表达的酶的活性,由此阻断该基因的酶参与的生物合成途径的一部分或重要部分。
本文所用的术语“删除(缺失)”意在包括突变、取代或删除目的基因的部分或全部,或向该基因中引入一个或多个碱基,从而使该基因不表达或即便表达也不显示酶活性,由此阻断该基因参与的生物合成途径。
尽管在以下实施例中具体使用了大肠杆菌W3110作为宿主微生物,但对本领域技术人员显而易见的是可不受限制地使用其他大肠杆菌菌株、细菌、酵母和真菌,只要它们能利用葡萄糖作为碳源。
此外,尽管以下实施例阐明了引入来自特定菌株的基因,但对本领域技术人员显而易见的是也可不受限制地使用其他基因,只要它们在宿主细胞中表达并显示与实施例中使用的基因相同的活性。
实施例
在下文中,将参考实施例进一步详细描述本发明。对本领域技术人员显而易见的是这些实施例仅为说明性目的,并不解释为限制本发明的范围。
实施例1
1-1:fadE基因的删除(WE3110的构建)
在大肠杆菌W3110(ATTC39936)中,使用SEQ ID NOs:1和2的引物通过一步失活法从大肠杆菌W3110(ATTC39936)中删除fadE(酰基辅酶A脱氢酶)基因并去除抗生素抗性(Warner等,PNAS,97(12):6640-6645,2000)。
[SEQ ID NO:1]WfadE k/o F:
5'-atgatgattttgagtattctcgctacggttgtcctgctcggcgcgttgttgtgtaggctggagctgcttc-3`]
[SEQ ID NO:2]WfadE k/o R:
5`-actgggcataagccgagaactccagcccgccgtactcttttttgatgatccatatgaatatcctccttag-3`
1-2:fadR基因的删除(WER3110的构建)
在实施例1-1构建的大肠杆菌WE3110中,使用SEQ ID NOs:3和4的引物通过一步失活法删除fadR(DNA结合转录二元调节子)基因并去除抗生素抗性(Warner等,PNAS,97(12):6640-6645,2000)。
[SEQ ID NO:3]WfadR k/o F:
5'-atggtcattaaggcgcaaagcccggcgggtttcgcggaagagtacattatgtgtaggctggagctgcttc-3'
[SEQ ID NO:4]WfadR k/o R:
5'-ccggattggcgaaatagtgacgaccaatacgcgtatacagccctttcatcCATATGAATATCCTCCTTAG-3'
1-3:用tac启动子取代fadD的天然启动子(WERPD3110的构建)
在实施例1-2构建的大肠杆菌WER3110中,用强tac启动子替换fadD基因的天然启动子,以使fadD基因的表达变强。
具体而言,使用SEQ ID NOs:5和6的引物,以与上述基因去除相同的方式用tac启动子取代天然启动子。
[SEQ ID NO:5]WfadDpch F:
5'-gtataatcccggccccgcgagagtacaaacagttgtaactgaataattgcCGCGTCATACACATACGATT-3'
[SEQ ID NO:6]WfadDpch R:
5'-ttgatctccgtcggaacgtccgcgggataacggttaagccaaaccttcttCATGGTCTGTTTCCTGTGTG-3'
1-4:用tac启动子取代fadL的天然启动子中的衰减子序列(WERPDL3110的构建)
在实施例1-3构建的大肠杆菌WERPD3110中,使用强tac启动子取代参与转录调节机制的fadD启动子中的衰减子序列。
为了取代衰减子序列,使用SEQ ID NOs:7和8的引物,以与上述基因去除相同的方式,使用tac启动子取代含衰减子的天然启动子。
[SEQ ID NO:7]WfadLpch F:
5'-gaaagtgctgctccagttgttaattctgcaaaatcggataagtgaccgaaCGCGTCATACACATACGATT-3'
[SEQ ID NO:8]WfadDLpch R:
5'-actgcgactgcgagagcagactttgtaaacagggttttctggctcatgacCATGGTCTGTTTCCTGTGTG-3'
1-5:ackA基因的缺失(WERAPDL3110的构建)
在实施例1-4构建的大肠杆菌WERPDL3110中,使用SEQ ID NOs:9和10的引物通过一步失活法删除ackA(乙酸激酶A)基因并去除抗生素抗性(Warner等,PNAS,97(12):6640-6645,2000)。
[SEQ ID NO:9]WackA k/o F:
5'-atgtcgagtaagttagtactggttctgaactgcggtagttcttcactgaaTAGGTGACACTATAGAACGCG-3'
[SEQ ID NO:10]WackAk/o R:
5'-tgccgtgcgcgccgtaacgacggatgccgtgctctttgtacaggttgtaaTAGTGGATCTGATGGGTACC-3’
1-6:用trc启动子取代fabHDG操纵子的天然启动子(WERAPDLB3110的构建)
在实施例1-5构建的大肠杆菌WERAPLD3110中,利用强trc启动子取代fabHDG操纵子基因的天然启动子,以使fabHDG操纵子基因的表达变强。
具体而言,使用SEQ ID NOs:11和12的引物,以与上述基因去除相同的方式用trc启动子取代天然启动子。
[SEQ ID NO:11]WfabHDGpch F:
5'-gtggtggctactgttattaaagcgttggctacaaaagagcctgacgaggcCGCGTCATACACATACGATT-3'
[SEQ ID NO:12]WfabHDGpch R:
5'-gtccgcacttgttcgggcagatagctgccagtaccaataatcttcgtataCATGGTCTGTTTCCTGTGTG-3’
1-7:用trc启动子取代fabA操纵子的天然启动子(WERAPDLBA3110的构建)
在实施例1-6构建的大肠杆菌WERAPLDB3110中,用强trc启动子取代fabA操纵子基因的天然启动子。
具体而言,使用SEQ ID NOs:13和14的引物,以与上述基因去除相同的方式用trc启动子取代天然启动子。
[SEQ ID NO:13]WfabApch F:
5'-accgttttccatggccattacgttggctgaactggtttattccgaactgaCGCGTCATACACATACGATT-3'
[SEQ ID NO:14]WfabApch R:
5'-gcgaccagaggcaagaaggtcttcttttgtataggattcgcgtttatctacCATGGTCTGTTTCCTGTGTG-3'
实施例2
2-1:pTrc99a_luxC载体的构建
使用克氏梭菌菌株(DSMZ,no.552,German)的染色体DNA作为模板和SEQ ID NOs:15和16的引物进行PCR,构建编码脂肪酰基辅酶A还原酶的luxC基因片段。
[SEQ ID NO:15]cklluxC F:
5'-TATAGGTACCATGATAGATTGTTATTCATTGGATG-3'
[SEQ ID NO:16]cklluxC R:
5'-TATTGGATCCTTAAATATTTAGACTACACCACGTT-3'
然后,所构建的luxC片段利用限制性内切酶(KpnI和BamHI)进行消化,并且将trc启动子的强基因表达的pTrc99a质粒(Phamacia,Biotech,Uppsala,Sweden)利用相同的限制性内切酶进行消化。所消化的luxC片段和质粒通过T4DNA连接酶彼此连接,由此构建具有高拷贝数的重组质粒pTrc99a_luxC。
2-2:pTrc99a_luxC_tac_tesA载体的构建
使用野生型大肠杆菌(大肠杆菌W3110)菌株的染色体DNA作为模板和SEQ ID NOs:17和18的引物进行PCR,构建编码酰基辅酶A硫酯酶的tesA基因片段。
[SEQ ID NO:17]tesAF:
5'-TATAGAATTCATGATGAACTTCAACAATGT-3'
[SEQ ID NO:18]tesAR:
5'-TATTGAGCTCTTATGAGTCATGATTTACTA-3'
然后,所构建的tesA片段利用限制性内切酶(EcoRI和SacI)进行消化,并且进行trc启动子的强基因表达的pTrc99a_luxC质粒(Phamacia,Biotech,Uppsala,Sweden)利用相同的限制性内切酶进行消化。所消化的tesA片段和pTrc99a_luxC质粒通过T4DNA连接酶彼此连接,由此构建具有高拷贝数的重组质粒pTrc99a_luxC_tac_tesA。
2-3:pTac15k_atoDAE_tac_CER1载体的构建
将pKK223-3(Pharmacia Biotech.,Uppsala,Sweden)的trc启动子和转录终止子区域插入到pACYC177(NEB,Beverly,MA,USA)中,由此构建pTac15K。pTac15K是具有图5的酶切图中所示结构的组成型表达载体。使用拟南芥col.的染色体DNA作为模板和SEQ ID NOs:19和20的引物进行PCR。所得CER1片段用限制性内切酶(SacI和kpnI)消化,并通过T4DNA连接酶连接到用相同的限制性内切酶消化的pTac15k(p15A起点,低拷贝,KmR;KAISTMBEL储存,tac启动子,4.0-kb,lap储存)(Zhi-Gang Qian等,Biotechnology and Bioengineering,104:651-654,2009以及Hiszczyn'ska-Sawicka和Kur,1997)质粒中,由此构建pTac15k_CER1。
然后,使用拟南芥col.的染色体DNA作为模板和SEQ ID NOs:21和22的引物进行PCR。所得atoDAE片段用限制性内切酶(XbaI和SphI)消化并通过T4DNA连接酶连接到以相同限制性内切酶处理的pTac15k_CER1质粒中,由此构建pTac15k_atoDAE_tac_CER1。在所述载体的构建中使用的引物对的核苷酸序列如下:
[SEQ ID NO:19]CER1F:5'-TATAGAGCTCATGGCCACAAAACCAGGAGTCCTCACC-3'
[SEQ ID NO:20]CER1R:5'-TATTGGTACCTTAATGATGTGGAAGGAGGAGAGGC-3'
[SEQ ID NO:21]atoDAEF:5'-GCCATCTAGAATGAAAACAAAATTGATGAC-3'
[SEQ ID NO:22]atoDAER:5'-TATTGCATGCTCAGAACAGCGTTAAACCAA-3'
实施例3:测定突变生物产生烷烃的能力
将实施例2-2和2-3构建的pTrc99a_luxC_tac_tesA和pTac15k_atoDAE_tac_CER1质粒引入实施例1-7中构建的适于产生烷烃的WERAPDLBA3110中,并使用大肠杆菌W3110(ATCC39936)作为对照菌株。在含有50μg/ml氨苄青霉素和30μg/ml卡那霉素的LB平板培养基上选择具有产生烷烃能力的突变微生物。将所转化的菌株接种至10ml的LB培养基中,并在37℃预培养12小时。然后,将5g/L的葡萄糖加入到含有100mlLB(在80℃或更高温度下灭菌)的250ml烧瓶中,并将1ml预培养液接种至烧瓶中,在31℃下培养10小时。接着,将含有2.0升培养基(每升蒸馏水中含有20g葡萄糖、13.5g KH2PO4、4.0g(NH4)2HPO4、1.7g柠檬酸、1.4gMgSO4·7H2O、3g酵母提取物、10ml痕量金属溶液(每升蒸馏水,10gFeSO4·7H2O、1.35g CaCl2、2.25g ZnSO4·7H2O、0.5g MnSO4·4H2O、1g CuSO4·5H2O、0.106g(NH4)6Mo7O24·4H2O、0.23g Na2B4O7·10H2O、35%HCl10ml))的5.0升发酵罐(LiFlus GX,Biotron Inc.,Korea)在121℃下灭菌15分钟,然后冷却至室温。使用1mM IPTG诱导所引入的或改造的基因表达,并通过自动补给50%(v/v)NH4OH将培养基的pH维持在6.8。
通过葡萄糖分析仪(STAT,Yellow Springs Instrument,Yellow Springs,Ohio,USA)测定培养基中的葡萄糖,然后当葡萄糖完全耗尽时,回收细胞,利用蒸馏水洗涤一次,然后在干燥器中100℃下干燥24小时。向干燥的细胞系中加入2ml氯仿,再向其中加入含有3%(v/v)H2SO4的1ml甲醇,并使混合物在100℃下反应12小时。反应完成后,将所述混合物冷却至室温,并向该混合物中加入1ml蒸馏水,然后剧烈搅拌所述混合物5分钟,以将其分成有机溶剂层(氯仿)和水层(水溶液)。然后,将所述混合物在10,000rpm下离心10分钟,收集所述有机溶剂层并通过气相色谱进行分析,由此测定烷烃的产量。
结果,如下表1中所见,在野生型大肠杆菌W3110中,没有产生烷烃,但在本发明的微生物变体中,分别产生了25mg/L和40mg/L量的十五烷和十七烷,并且分别产生了0.11564g/L、0.475g/L和0.12276g/L量的辛烷、壬烷和壬烯,其为汽油范畴的烷烃。
这些结果表明,微生物变体成功地产生了汽油范畴的烷烃。
[表1]
微生物变体产生的烷烃(mg/L)
尽管已经参考具体特征详细描述了本发明,但对本领域技术人员显而易见的是,本描述仅为优选的实施方案,而不限制本发明的范围。因此,本发明的实质范围将由所附权利要求及其等同项而定义。
工业应用性
如上所述,本发明提供了通过向微生物中引入编码参与烷烃产生的酶的基因以对其进行突变使之适于产生包括烷烃在内的烃而获得的微生物变体。本发明的微生物变体可用于通过额外代谢流改造改良菌株,并因而用于工业生产包括烷烃在内的烃。
能够产生烃的微生物变体及用其产生烃的方法专利购买费用说明
![]()
Q:办理专利转让的流程及所需资料
A:专利权人变更需要办理著录项目变更手续,有代理机构的,变更手续应当由代理机构办理。
1:专利变更应当使用专利局统一制作的“著录项目变更申报书”提出。
2:按规定缴纳著录项目变更手续费。
3:同时提交相关证明文件原件。
4:专利权转移的,变更后的专利权人委托新专利代理机构的,应当提交变更后的全体专利申请人签字或者盖章的委托书。
Q:专利著录项目变更费用如何缴交
A:(1)直接到国家知识产权局受理大厅收费窗口缴纳,(2)通过代办处缴纳,(3)通过邮局或者银行汇款,更多缴纳方式
Q:专利转让变更,多久能出结果
A:著录项目变更请求书递交后,一般1-2个月左右就会收到通知,国家知识产权局会下达《转让手续合格通知书》。
动态评分
0.0